- Enhanced Germination & Initial Seedling Development by Liquid Phase Ozonation of Plant Seeds
Heekyung Yang·Yuna Jeong·Wonchul Choi·Bumhan Bae*
Department of Civil & Environmental Engineering, Gachon University
- 식물종자의 액상오존처리에 의한 종자 발아 및 초기 성장 증진
양희경·정윤아·최원철·배범한*
가천대학교
The effects of liquid phase ozonation on seed dormant alleviation and
subsequent seedling growth were studied using two plant seeds of Indian
jointvetch (Aeschynomene indica L.) and Indian mallow (Abutilon avicennae Gaertn.). At a constant ozone concentration (80 g/m3), contact time varied from 10 to 60 min with 10
min interval. Germination rate, root length, and specific root length were
compared after 3-day incubation on gel-medium. The
germination rate increased significantly (p<0.05) in
the 50 min treatment of Indian mallow by 30% compared to
the control. Enhanced root elongation was observed in the seeds of 30 min treatment
of Indian jointvetch and 30~50 min treatment
of Indian mallow. Specific root length, an indicator of environmental change,
did not show significant changes, suggesting the level of ozone treatment has
no adverse effect on seedling development. The results indicate that liquid
phase seed ozonation can be an effective on-site germination alleviation method
in the application of phytoremediation.
Keywords: Gelling agent, Germination, Ozone, Root elongation, SmartRoot, Specific root length
식물상 정화공법은 경제적이고 친환경적 토양정화공법이며, 부가적으로 오염지역을 식피하여 오염토양이동과 인체접촉을 저감함으로써 위해도도
감소시킬 수 있다 (Rock, 2003). 오염토양에 정화식물을 식재하는 방법으로 유식물을 옮겨 심는 식물정식법 혹은 종자를 살포하는 파종법을
사용하는데, 오염범위가 넓은 지역에서는 식물정식 인건비가 높기 때문에 파종법이 경제적이다. 정화식물은 일반 작물과 달리 종자를 쉽게 구할 수 없는
경우가 많으므로 파종한 종자 발아율을 높이고 유식물 성장을 증진할 수 있다면, 보다 경제적이고 효율적인 식물정화를 달성할 수 있을 것이다.
종자 발아는 휴면호르몬 abscisic acid(ABA)과 성장호르몬 gibberellin(GA) 농도와 이에 대한 민감도에 의해 조절된다(Koornneef
et al., 2002; Finkelstein et al., 2008). 발아를 위해 세포벽과 원형질 거대분자의 작용으로 확산과 모세관
현상으로 수분을 흡수하는 종자흡수(seed imbibition)단계에서 종자 내부에 자발적으로 활성산소종(ROS, reactive oxygen
species)이 생성된다. 대사과정에서 산소 환원으로 발생하는 초과산화물(superoxide), 과산화수소, 수산기 라디칼 및 분자산소를 일컫는
ROS는 항산화효소 생산, 질병방어관련 유전자 발현, 뿌리 발생을 위한 세포벽 강성 완화, 병원균 방어 및 ABA 감소 등의 매우 다양한 반작용을
유도하며 종자발아에 매우 중요한 역할을 한다(Bailly, 2004). 또한 ABA 농도 감소는 상대적 GA 농도 증가로 이어져 휴면타파(dormancy
allevia-
tion)가 증진된다(El-Maarouf-Bouteau and Bailly, 2008; Liu et al.,
2014). Oracz et al.(2007)은 methyl viologen (MV)을 사용하여 인위적으로 종자 지질의 과산화 및 단백체 산화상태 변화(carbonylation)를
유도하면, 배아 축에 ROS가 축적됨으로써 건조상태 혹은 흡수상태 종자에 대한 휴면타파를 할 수 있는 새 모델을 보고하였다. 도깨비바늘
속 식물 Bidens pilosa L. 속씨는 휴면타파를 위해 후숙 및 적색광이 필요하다. 이에 속씨를 MV로 생성된
superoxide(O2∙ -)과 펜톤반응으로 발생시킨 ∙OH로 처리한 결과, 종자발아에 필요한 후숙 과정은 ∙OH과 superoxide(O2∙ -)에 의해, 적색광은 O2∙ -가 대체하여 종자 발아가 증진되었다(Whitaker et al., 2010).
오존(O3)은 MV 혹은 펜톤반응보다 사용이 편리한 ROS 발생법일 뿐 아니라, 종자의 표면 살균도 가능한 장점이
있다. 이에 다양한 식물들을 대상으로, 오존에 의한 휴면타파 연구가 실시되었다. Sudhakar et al.(2011)은 토마토씨를 오존으로 처리한
결과, 고농도로 오래 처리하는 것 보다는 종자 1 g 당 0.01 g-O3의
농도로 20분간 처리할 경우 발아율이 가장 높았으며, 휴면타파는 토마토씨 내부 ABA 농도 감소에 기인하는 것으로 보고하였다. 부채선인장(Opuntia)
종자를 치사용량 이하의 오존으로 처리한 실험에서는 발아율이 17.8~44.4% 증가하고, 물 흡수량이 33.5% 증가하였다(Vazquez et
al., 2017). 옥수수 알을 오존으로 처리하고 초기 유식물 성장을 관찰한 결과, 오존농도 30 mg/L의 오존수에
60~90분간 침지하였을 때 초기 유식물의 성장이 가장 활발하였고. 침지 시간이 120분으로 길거나, 오존 농도가 30 mg/L 미만인 경우에는
유식물 성장이 오히려 저해되었다(Mazimiano et al., 2018).
이상의 연구결과는 적정수준의 오존처리는 발아 및 유식물 성장에 유익하다는 일관성을 보이고 있다. 반면, 연질 소맥 씨앗 80 g을 1.5~25 g-O3/m3
농도로 15분간 처리한 결과, 종자 발아율에 변화가 없었다(Lazukin et al., 2018). 이 실험에서는 소맥을 포장실험과
유사하게 수분 80%의 모래로 채운 용기에 1 cm 간격으로 심고 20 ± 1oC 7일간 배양하여 발아율을
측정하였기 때문에 다른 실험과 동일 조건이라고 할 수 없으며, 오존에 의한 영향을 파악하기 위해서는 객관적이고 효율적인 식물발아법을 적용해야 함을
보이고 있다.
일반적으로 실험실에서는 고체배지인 한천에 무균식종하여 발아와 성장을 관찰하는 방법이 널리 사용되고 있다. 고체 배지로 사용하는
한천(agar)은 해조류를 원료로 하기에 정제하지 않은 경우 염도와 불순물 농도가 높고, 해조류에 기인한 indole-acetic acid과 유사한
성장호르몬 농도가 상당량(0.4~1.29 nmol/g) 존재하여 발아 및 유근/지상부 성장에 큰 영향을 줄
수 있다(Ichi et al., 1986; Arthur et al., 2004). 이에 Agar 대체제로 순도와 젤 투명성이 높고 식물 발달 및
성장에 효과적인 Gelrite를 많이 사용한다(Buah et al., 1999; van den Dries et al., 2013). Gelrite는 Pseudomonas
elodea 배양으로 생산되어(O'Neill et al., 1983) 불순물이 적고
agar에 비해 저농도로 배지를 제조할 수 있지만, 여전히 0.25 nmol/g의 성장호르몬을
가지고 있어(Arthur et al., 2004) 식물성장에 주는 영향을 검증할 필요가 있다.
본 연구에서는 콩과식물인 자귀풀(Aeschynomene indica L.)과 아욱과 식물인 어저귀(Abutilon
avicennae Gaertn.) 종자를 물에 넣고 일정 농도의 오존으로 폭기한 다음 인공배지에서 배양하여, 오존 폭기 시간이 종자 발아와
유식물 성장에 미치는 영향을 발아율, 뿌리 성장 및 고유뿌리길이(specific root length, SRL)로 비교하였다. 또한 agar와
Gelrite를 각각 사용하여, 두 배지에서의 발아율과 유식물 성장 차이를 비교·분석하였다.
2.1. 종자 및 배지 준비
발아실험에는 2011년 실외에서 재배하여 수확한 어저귀와 자귀풀 종자를 사용하였다. 두 식물은 화약물질을 흡수/분해할 수 있는 식물로(Bae
et al., 2002), 상용으로 종자를 생산하지 않아 현장적용에 충분한 양을 구하기 위해서는 야외에서 채종하거나 농장에서 주문 재배해야 한다.
냉장고에서 보관 중이던 종자는 7~8번 체(2.0~2.8 mm)로 체가름 한 것 중에서 모양과 색이 일정하고 손상되지 않은 것을 육안으로 1차선별하고,
250 mL 증류수에 넣고 교반하여
부유한 것을 제거한 다음, 3회 증류수로 세척하여 실험에 사용하였다.
종자의 표면살균은 종자 특성에 맞추어 변경하였다. 자귀풀은 종자 겉껍질이 매끈하고 두꺼워 차아염소산과 접촉이 원활하기에 4%
NaOCl에 넣고 20분간 교반하면서 부유 종자를 계속 제거하고 수거한 다음, 80% 에탄올 100 mL에 5분간 침지하여 표면 살균하였다. 어저귀 종자는
껍질이 거칠고 표면에 요철이 있어 차아염소산과 접촉이 원활하지 않았다. 이에 세척종자를 80% 에탄올 100 mL에 5분간 교반하여 표면을 적신
후, 0.5% 차아염소산 100 mL에 넣고 5분간 교반하면서
부유 종자를 제거하고 마지막으로 잔류 차아염소산 제거를 위해 0.01 N HCl 100 mL에 넣고 10분간 교반하였다(Abdul-Baki, 1974; Sauer and
Burroughs, 1986). 잔류 살균제는 각 단계마다 멸균된 탈이온수로 3회 이상 세척하여 제거하였고, 종자살균 및 세척은 모두 멸균작업대
내에서 실시하였다.
종자발아실험에는 0.25배 MS 배지(Murashige and Skoog, 1962)를 사용하였다. 이때, 응고제(젤)로는 agar와
Gelrite를 각각 사용하여 식물성장 차이를 비교하였다. Agar는 1.0% 농도로 사용하였으며, 이 농도에서 젤 강도는 약 450 g/cm2이다(Klimaszewska
et al., 2000). Gelrite 농도는 0.6%로, 젤 강도에 가장 영향을 주는 0.25배 MS 배지의 Mg2+ 농도
6.0 mg/L을 고려한 젤 강도는
약 300 g/cm2 이다(Carl Roth GmbH Co., 2017). 각각의 응고제를 포함한 MS배지는 고압멸균한 다음,
주사기 필터로 멸균한 항생제 streptomycin과 항진균제 fenbendazole을 최종농도 20 mg/L가 되도록 각각 주입하였다. 이후, 2 cm 크기의
격자 눈금이 있는 4각 페트리 디시(125 × 125 × 20 mm)에 배지 두께 1 cm로 넣고 식힌 다음 종자 발아 배지로 사용하였다.
2.2. 종자 오존 처리 및 식재
실험에 사용한 종자는 오존 처리를 하지 않은 대조군(control)과 10분 간격으로 총 60분까지 오존으로 처리한 실험군으로 구분하였다.
오존처리는 pyrex 유리 재질의 오존 반응조(1.2 L)에 1 L의 인산염 완충용액(10 mM, pH 7)과 종자를 넣은 다음, 오존을 주입하여
유리산기관으로 폭기하면서 10분 간격으로 종자를 건져 사용하였다. 오존 발생기(PC57-20, Ozonetech, Korea)에서 발생된 오존(80
g-O3/m3)은 질량유량계(mass flow controller, Teledyne
Technologies, USA)로 유량을 1.5 L/min으로 조절하여 주입하였는데, 사전에 기상 오존농도측정기(OM-1500B, Ozonetech,
Korea)로 기체상 오존 농도를 일정하게 조절하였다. 반응조에서 배출된 배오존은 활성탄으로 충진된 칼럼을 통과시켜 모두 제거하였다.
대조군(control) 종자는 표면 살균 후, 거름종이로 물을 제거하고 준비한 고체배지(agar-MS 및 Gelrite-MS 배지)에
파종하였다. 종자는 4각 페트리 접시의 2/3 지점에 1 cm 간격으로 11개를 일렬로 배치하였다. 이후, 10분 간격으로 오존 반응조에서 필요한
종자를 건져 고체배지에 파종하였다. 이때, 종자가 발아하여 수직으로 자랄 수 있도록 종자의 배(embryo) 부분을, 4각 페트리 접시를 세웠을
때 아래로 향하도록 배치하였다. 파종이 완료된 고체배지는 수분이 빠져나가지 않도록 테이프(Kisan Bio., Korea)로 밀봉하였다. 파종한
페트리 디시는 식물배양기(GC-1000TLH, Jeio Tech., Korea)에 87도 각도로 세워 25oC에서 4일 동안 암배양하였다.
모든 실험은 3배수로 하였고, 2주 간격을 두고 재반복 실험을 실시하여 총 6배수로 실험하였다. 모든 과정에서 사용하는 도구는
Autoclave를 통해 멸균된 것을 사용하고, 파종 작업은 모두 멸균작업대 내에서 실시하였다.
실험에 사용한 화학약품은 ACS 급으로 agar(대정화학), Gelrite(MB cell, USA)이며,
streptomycin, fenbendazole 및 MS medium(Sigma-Aldrich), NaOCl(SHC, Korea), HPLC급
에틸알코올(덕산화학)이었다. 배지 준비에는 syringe filter(0.22 um PVDF, Millex-GV, Millipore Co.)와 사각
petri dish(SPL Co.)를, 배지 제작 및 세척에는 탈이온수(18.3 MW-cm)를 사용하였다.
2.3. 종자 발아, 길이 및 부피
측정
배양 3일째에 실험을 종료하고, 일정 조건에서 페트리 디시의 사진을 촬영하고 사진 분석프로그램으로 발아, 뿌리 길이 및 부피를 산정하였다.
사진은 Canon G7 X Mark II로 해상도 3648×2432 DPI로 촬영하였고, Image J(Schneider er al.,
2012) 프로그램으로 24 비트 RGB로 포맷을 전환하여 SmartRoot(Lobet et al., 2011) 프로그램으로 뿌리길이 및 부피를
분석하였다. 또한 사진 분석에서 종자에서 유근 길이가 1 mm 이상 발달하면 발아한
것으로 간주하였다(KS&VS, 2017). 동시에 배지에서 성장한 각 식물체 뿌리를 15개체씩 60oC에서 3일간 건조하여 건조중량을
측정하고, SmartRoot로 평가한 뿌리부피와 건조중량으로 밀도를 산정한 다음, 식 (1)에 의해 SRL (specific root length)을 계산하였다(Eissenstat, 1991). 실험 결과는 대조군과 처리군으로 구분하여
95% 신뢰수준의 t-검정(이분산 가정)을 실시하였다.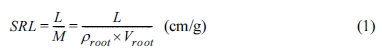
여기서, L은 뿌리길이(cm), ![]() 는 뿌리 밀도(g/cm3), Vroot는 뿌리부피(cm3)
는 뿌리 밀도(g/cm3), Vroot는 뿌리부피(cm3)
3.1. SmartRoot를 사용한 사진 분석
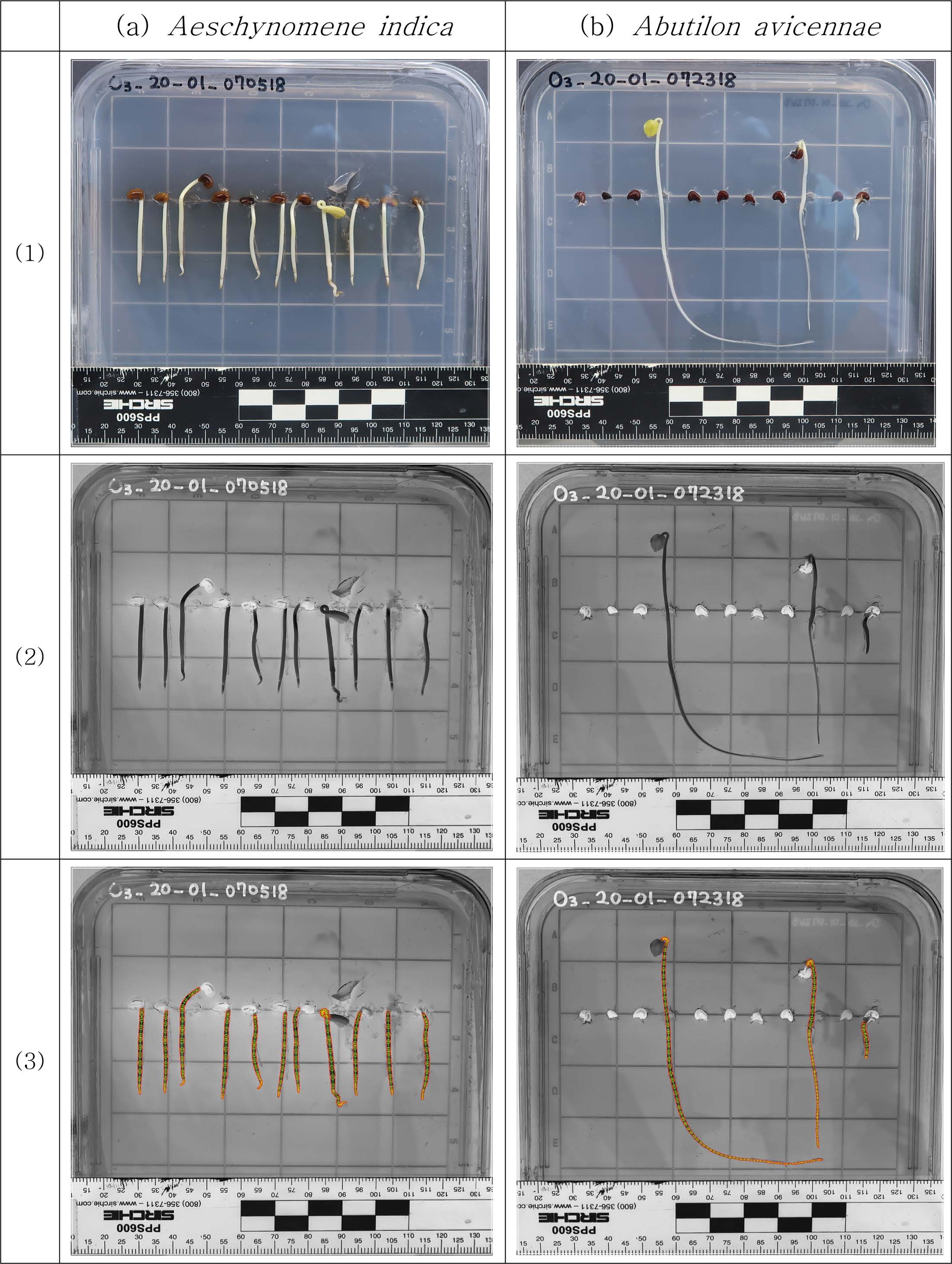
배지에 오존처리한 종자를 식재하고 24시간 간격으로 사진을 촬영하면서, 발아 및 유식물 뿌리 성장을 관찰하였다. 대부분 3일 배양 후에는
식물의 뿌리가 충분히 생장하여 3일차 사진으로 발아 여부를 판독하고, 뿌리 길이 및 부피를 산정하였다. 척도와 함께 촬영한 사진(Fig. 1,
row 1)은 Image J를 사용하여 24 비트 RGB 파일로 변환하였다(Fig. 1 row 2). SmartRoot 프로그램으로 변환된 이미지를
읽고 축척에 해당하는 픽셀수와 뿌리 시작점을 지정해 주면, 음영에 따라 픽셀단위로 식물을 인식하고 뿌리 발달방향으로 뿌리 축과 타원크기를 자동
판독하여 길이와 부피를 산정하였다(Fig. 1 row 3). 본 연구에서는 SmartRoot에 대한 검증은 실시하지 않았으므로, 발표된 참고문헌을 참조하면 될 것이다(Lobet
et al., 2011).
3.2. 종자 발아율
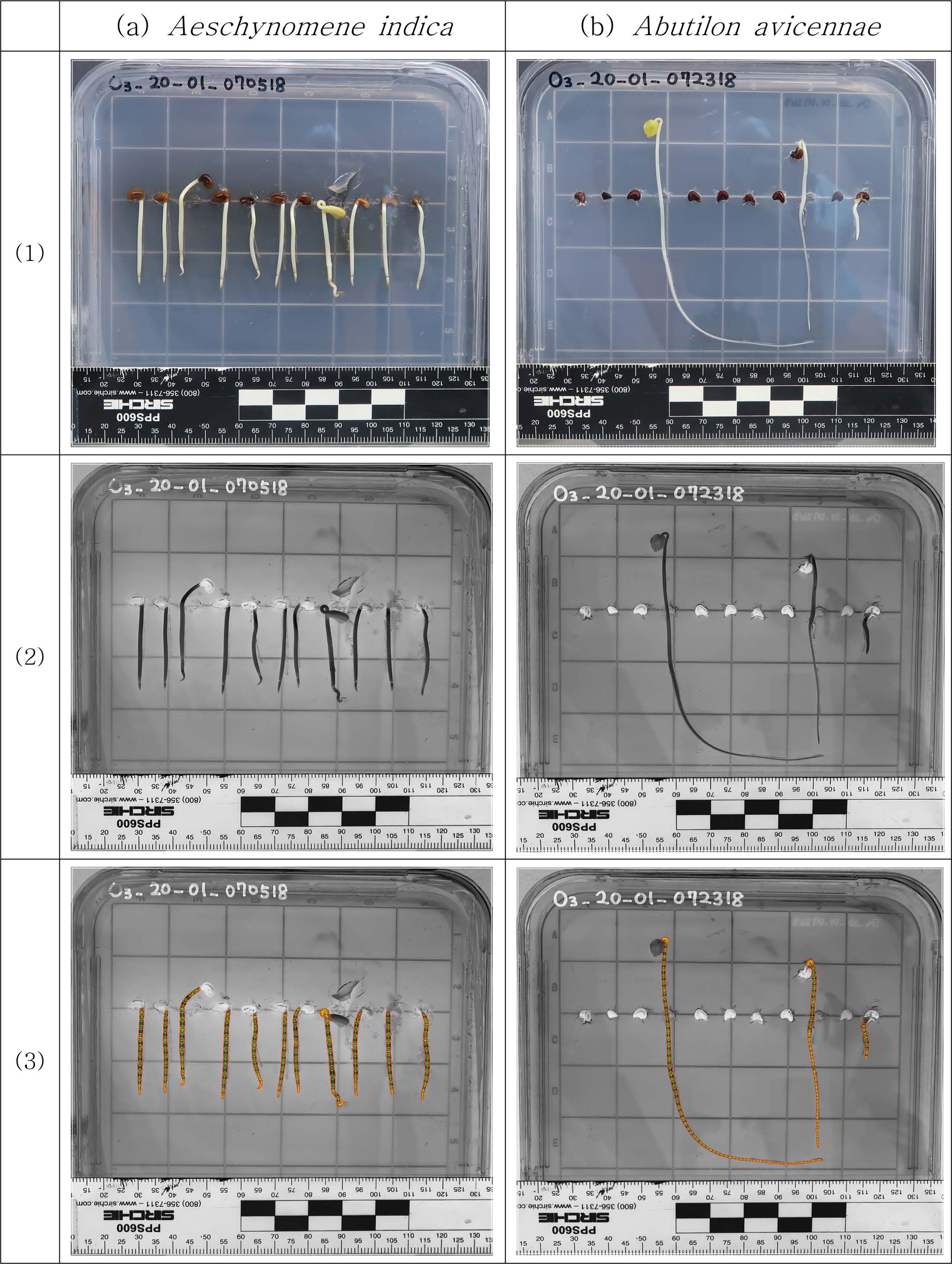
실험에 사용한 종자는 냉장고에서 약 10년간 보관하였음에도 자귀풀 발아율은 agar-MS배지(이후 agar 배지)에서 89.8%,
Gelrite-MS배지(이후 Gelrite 배지)에서 85.7%로, 어저귀 발아율 53.7%(agar 배지) 및 47.0%(Gelrite 배지)에
비해 상대적으로 높은 발아율을 보였다(Table 1). 또한 전반적으로 agar 배지에서의 발아율이 Gelrite 배지보다 약간 높았으나, 유의적이지
않았다(Fig. 2). 두 식물 종자를 오존 처리한 경우 일부 처리군에서 발아율이 증가하였다. 자귀풀의 경우 30 및 40분 오존처리하고
agar 배지에 파종한 경우, 발아율이 각각 96 및 94%로 높았으나 대조군 발아율도 높아 유의하지 않았다. 어저귀 종자는 오존처리 후
agar 배지에 파종한 경우 발아율이 증가하는 경향을 보였다. 특히 40~60분 처리한 종자 발아율이 60~70%로 높았으며, 50분 처리한 경우에는
발아율이 95% 신뢰도 수준에서 유의적이었으며, 이는 Sudhakar et al.(2011)의 연구와 같이 장시간 보다 적정시간으로 오존 처리할
경우 발아율이 증가한다는 결과와 동일하다.
3.3. 응고제에 따른 뿌리 성장
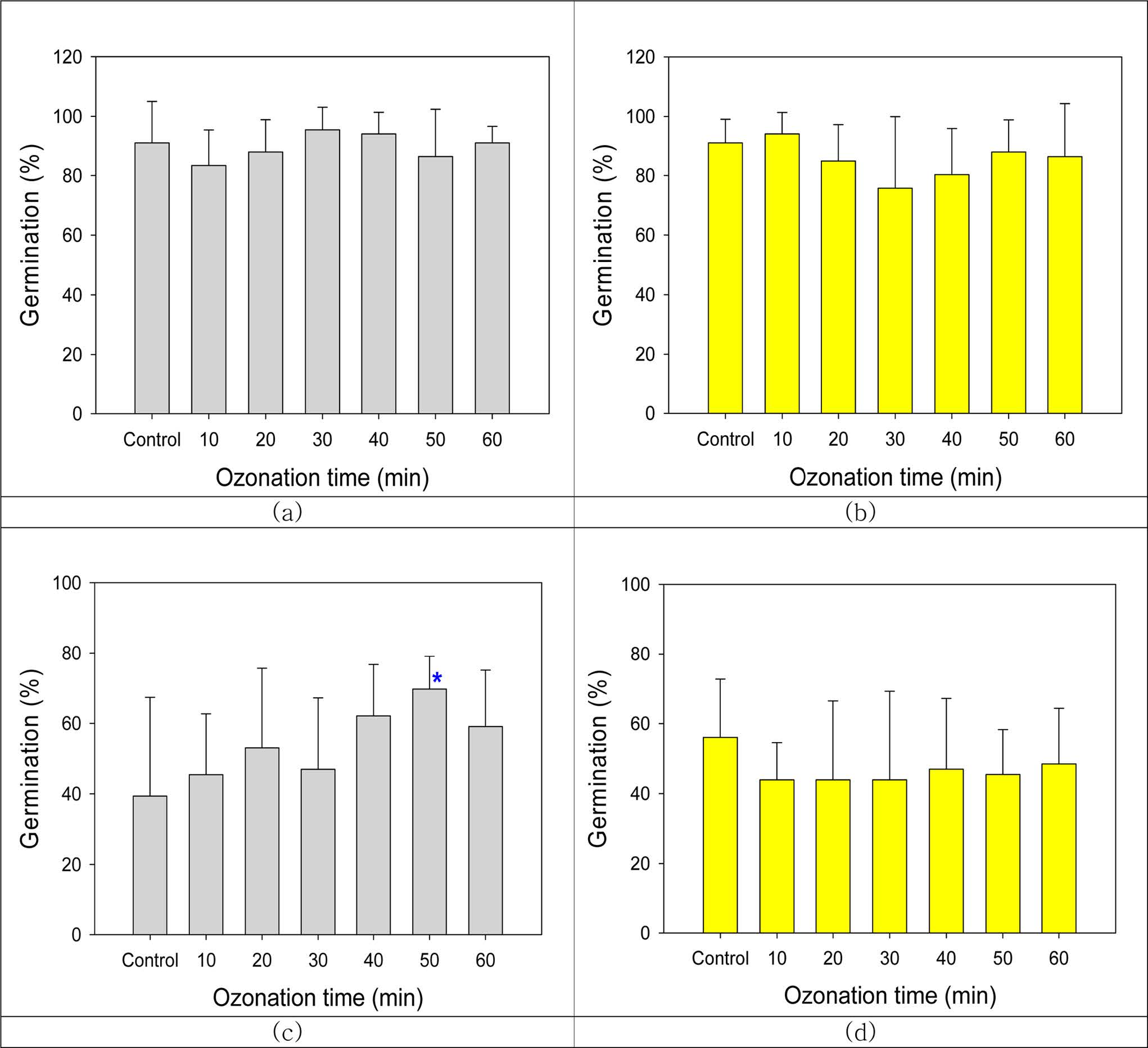
실험에 사용한 응고제(젤)에 따라 유근 성장이 매우 상반되는 결과를 보였다. 전반적으로 agar배지에서는 발아한 종자에서의 유근 성장이
균일하였으나, Gelrite배지에서는 유근 발달이 고르지 않았다. 자귀풀(A. indica)은 agar배지에서는 발아한 종자에서 뿌리가
고르게 성장하였지만, Gelrite배지에서는 성장이 매우 불균일하였다(Fig. 3, a&b). 어저귀(A. avicennae)
뿌리는 agar배지에서는 길고 균일하게 생장했지만 Gelrite배지에서는 생장도 느렸고 각 개체간 길이도 균일하지 않았다(Fig. 3,
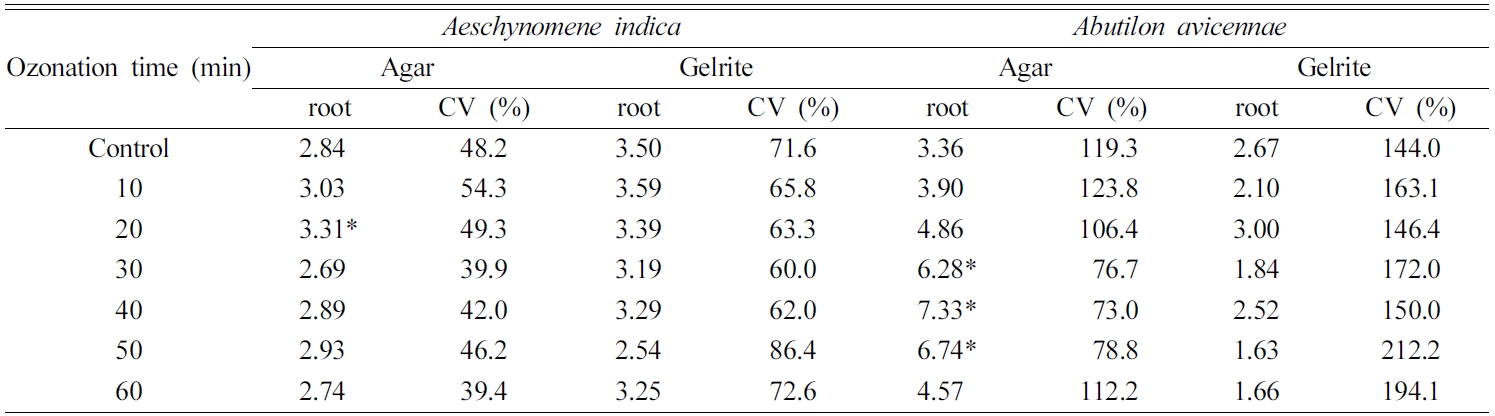
c&d). 배지가 미치는 영향은 변동계수(coefficient of variation, CV)에서도 알 수 있다(Table 2). 자귀풀은
Gelrite배지에서 뿌리길이가 평균 3.25 cm로 agar배지에서의 2.92 cm 보다 길었으나 평균 CV는
68.6%로 20% 포인트 높았다. 반면, 어저귀 뿌리길이는 Gelrite배지에서 평균 2.20 cm로 agar배지에서
5.29 cm의 1/2에 불과하였으나, 평균 CV는 168.8%로 1.7배 높았다. 또 다른 특성인 뿌리밀도는
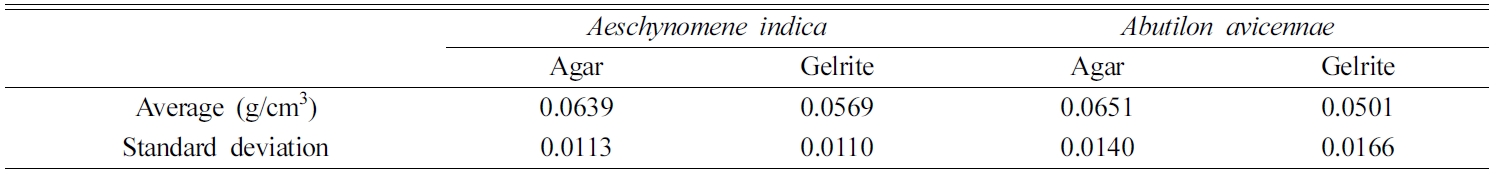
Table 3과 같다. Agar 및 Gelrite배지에서 성장했을 때 자귀풀 뿌리밀도는 각각 0.0639 및 0.0569 g/cm3이고,
어저귀는 0.0651 및 0.0501 g/cm3이었다. 두 식물 모두 agar배지에서
생장했을 때 밀도가 높았는데, 자귀풀은 약 11% 밀도가 높았고, 어저귀는 23% 높았다.
오이씨를 사용한 시험관 생장 실험에서 응고제로 Gelrite를 사용했을 때 agar에 비해 뿌리 길이가 약 1.8배 증가하였고(Ichi
et al., 1986), 바나나를 사용한 실험에서도 Gelrite에서 성장이 활발하였는데, 응고제가 식물성장에 영향을 주는 원인은 물 포텐셜
및 강도와 같은 매질의 물리적인 특성 차이에 기인하였다(Buah et al., 1999). 본 연구에서도 Gelrite배지의 강도가 낮아 뿌리
발달에 더욱 유리할 것이다. 또한 낮은 뿌리밀도는 식물 생장율이 높은 경우 관측되는 특성이다(Kramer-Walter et al.,
2016). 그러나 어저귀는 오히려 강도가 높은 agar 배지에서 뿌리가 더 잘 자랐기에 기존 연구결과와 배치되며, Gelrite에서 뿌리길이
편차가 심한 것은 배지 강도로 설명하기 어렵다. 식물 뿌리생장에 미치는 응고제의 영향은 식물종마다 다를 수 있으며, 향후 후속 연구가 필요할 것이라
사료된다.
3.4. 오존처리가 뿌리생장에 미치는
영향
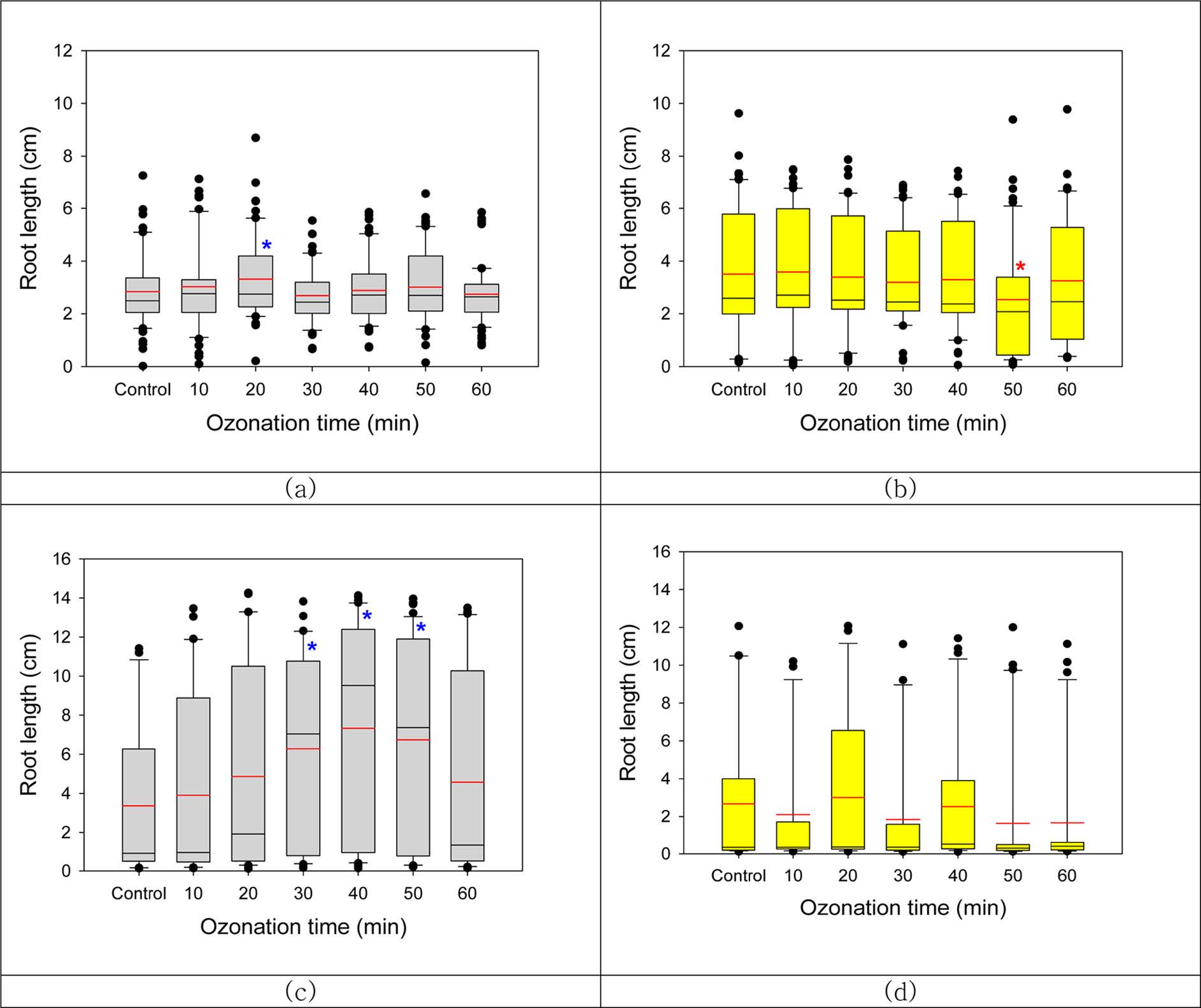
오존으로 20분 처리한 자귀풀 종자에서 생장한 뿌리길이는 3.31 cm로 대조군에 비해 유의적으로
증가하였지만(Fig. 4a), 오존처리 50분 후에 Gelrite배지에 식재하자 오히려 뿌리생장이 감소하였다(Fig. 4b). 어저귀 종자도
20, 30, 40분간 오존처리하고 agar배지에 식재한 경우 뿌리길이가 유의적으로 증가하였으나, 오존처리 후 Gelrite배지에서 생장한 경우는
편차가 커 유의적이지 않았다.
오존처리 후 유식물 생장이 증가한 경우는 다수 보고되었다. Violleau et al.(2008)은 산소를 혼합한 오존(20 g/m3)으로
6.8 혹은 20.5분간 처리한 옥수수 종자로 발아실험을 실시한 결과 발아율과 뿌리길이가 증가하였다. Maximiano et
al.(2018)은 30 mg/L 이하 오존수로 60~90분간 옥수수를 처리하여 종이 두루마리(paper-roll)
발아실험을 한 결과, 유식물 성장이 유의적으로 증가하였다 . 두 연구 공히 장기간의 오존처리는 식물생장에 유해하다고 보고하였다. 따라서 오존처리에
의한 식물생장 증진은 처리시간 및 농도에 최적값을 가지는 볼록 곡선일 것이며, 각 종자마다 다를 수 있기에 사전 실험으로 최적조건을 구하는 것이
필요할 것이라 판단된다.
3.5. 고유뿌리길이(specific
root length, SRL)
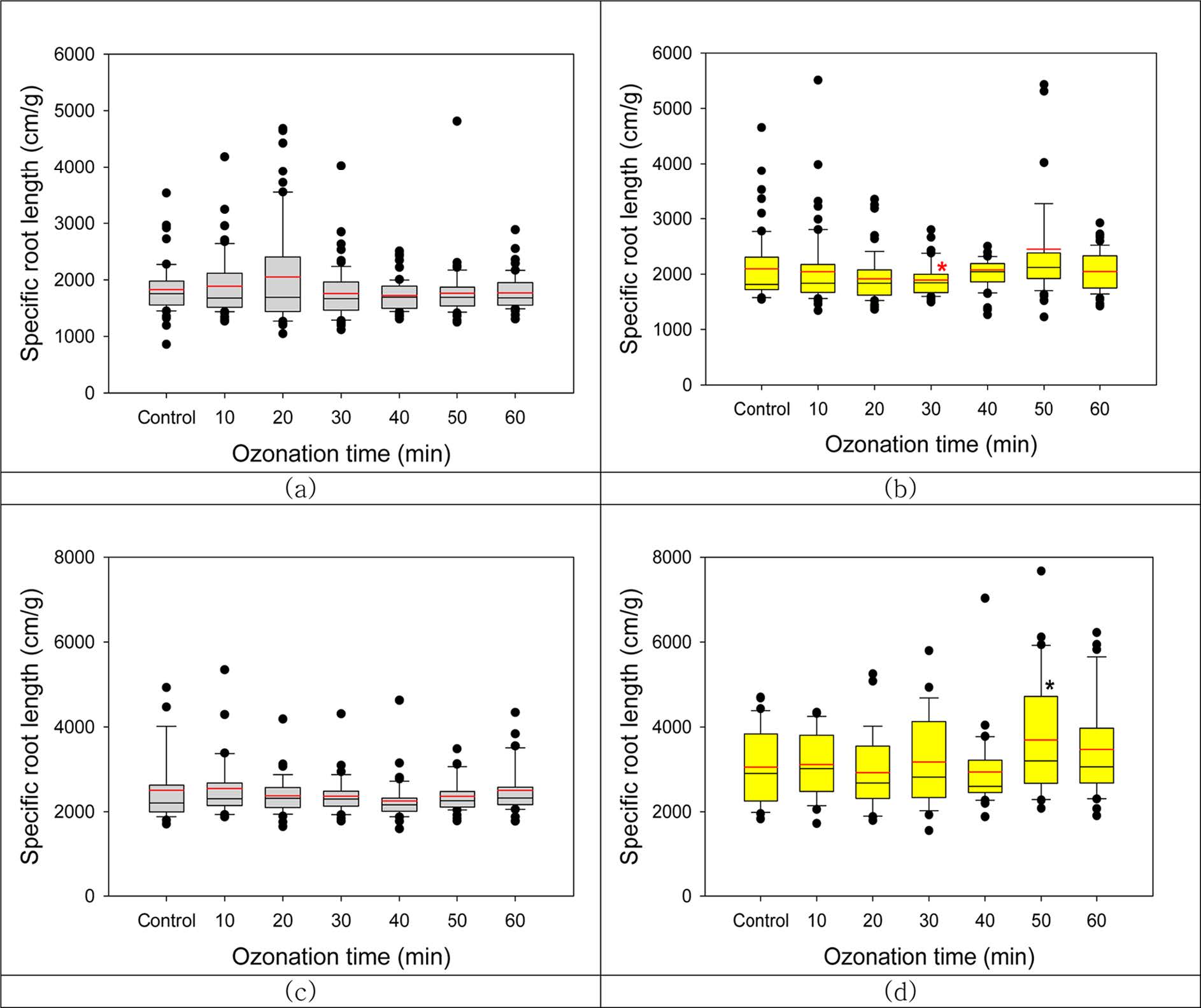
발아한 식물뿌리에 대한 SRL은 Fig. 5와 같다. 자귀풀의 SRL은 agar배지 및 Gelrite배지에서 각각 1,825 ± 113 및 2,072 ± 183 cm/g으로 Gelrite배지에서
약 12% 높았다. 어저귀의 SRL은 agar배지 및 Gelrite배지에서 각각 2,416 ± 105 및 3,195 ± 286 cm/g으로
Gelrite배지에서 24%가 높았다. 두 식물 종자를 agar배지에서 배양한 경우 오존처리로 인한 SRL의 유의적 변화는 관측되지 않았다.
Gelrite배지에서 생장하였을 때 자귀풀은 30분 오존처리한 경우 SRL이 유의적으로 감소하였고(p=0.027), 어저귀는 50분 처리한 경우
SRL이 유의적으로 증가하였다(p= 0.038). 그러나 Gelrite배지에서 성장한 유식물
뿌리길이의 CV값이 너무 크고 SRL 값은 뿌리길이에 정비례하므로, 뿌리길이 오차가 SRL에 그대로 전달될 가능성이 높다. 특히 Gelrite
배지에서 어저귀 뿌리 생장은 갑자기 일어났다. 예를 들어 대조군에서 2일차 뿌리길이가 3.75 cm이던 유식물이 24시간
후인 3일차에는 12.1 cm로 3.2배 생장하였으나, 동일 페트리 디시의 다른 식물은 0.2 cm를 넘지 않았다. 만약
아직 생장하지 않은 어저귀 뿌리가 생장시작에 실험기간(3일) 이상의 시간이 필요하다면, 뿌리생장을 관측하지 못하였을 것으로 추론할 수 있다. 그러므로
Gelrite배지 결과해석은 유보하는 것이 타당할 것으로 판단된다.
SRL은 식물 형태를 결정하는 매개변수 중에서 가장 빈번히 사용되는 값으로, 뿌리길이는 자원획득 증진(편익)에 해당하고, 뿌리중량은
뿌리생성 및 유지관리에 드는 비용으로 생각할 수 있다. 토양 내에서 길고 가는 뿌리(큰 SRL값)는 생체량 대비 영양물질의 고효율 흡수가 가능하여,
생장을 증진하고 교란 토양에 빨리 침투할 수 있다(Eissenstat, 1991). 또한 SRL은 뿌리직경에 반비례하고 토양비옥도에 비례하기에
주변 환경에 큰 영향을 받는 매개변수로 활용할 수 있다(Kramer-Walter et al., 2016). Ostonen et
al.(2007)의 연구에 의하면 SRL은 인공시비, 알루미늄 스트레스에 비례하여 크게 감소하고, 낮은 입사광, 온도 및 이산화탄소 농도 증가에
반비례하기에, 환경인자 변화지표가 된다고 하였다. 본 연구에서 오존으로 처리한 다음 agar배지에서 생장한 두 식물뿌리의 SRL이 감소하지 않은
것은 오존처리가 뿌리생장 및 유식물 초기생장에 해로운 영향을 주지 않았다는 것을 의미한다.
|
Fig. 1 Procedure for the estimation of root length and volume during seedling root growth on agar-MS medium. Column (a) Aeschynomene indica, Column (b) Abutilion avicennae; Row (1) original photograph. Row (2) conversion of file format to RGB 24 bit by ImageJ software, Row (3) root length and volume estimation using SmartRoot software. |
|
Fig. 2 Germination of two plant seeds on agar-MS or Gelrite-MS medium after ozone treatment. (a) A. indica on agar-MS medium, (b) A. indica on Gelrite-MS medium. (c) A. avicennae on agar-MS medium, (d) A. avicennae on Gelrite-MS medium (*p<0.05). |
|
Fig. 3 Effects of gelling agent on the development of seedling root after 3 days of incubation. (a) A. indica on agar-MS medium, (b) A. indica on Gelrite-MS medium. (c) A. avicennae on agar-MS medium, (d) A. avicennae on Gelrite-MS medium. |
|
Fig. 4 Effects of ozonation on root elongation of two plant seedlings (a) A. indica on agar-MS medium, (b) A. indica on Gelrite-MS medium. (c) A. avicennae on agar-MS medium, (d) A. avicennae on Gelrite-MS medium (*p<0.05). |
|
Fig. 5 Effects of ozonation on specific root length of two plant seedlings (a) A. indica on agar-MS medium, (b) A. indica on Gelrite-MS medium. (c) A. avicennae on agar-MS medium, (d) A. avicennae on Gelrite-MS medium (*p<0.05). |
|
Table 1 Percent germination of two plant seeds on each gel medium after 3 days of incubation in growth chamber (Standard deviation in parenthesis. Number of petri dish is six and each dish contains 11 seeds.) |
* p<0.05 |
|
Table 2 Average root length and corresponding coefficient of variation (unit: cm) |
* p<0.05 |
|
Table 3 Differences in average root density of two plant seedlings grown on each gel medium (The values are based on randomly selected 15 root samples of respective plant.) |
오존으로 처리한 자귀풀 및 어저귀를 실험실 배지에서 배양하면서, 오존처리가 종자 발아율, 유식물의 초기 길이성장 및 고유뿌리길이(SRL)의
변화를 비교분석하였다. 연구 결과, 오존처리는 발아율, 뿌리생장에 긍정적 영향을 주었으나. 오존처리조건(농도 80 g-O3/m3,
유량 1,5 L/min)에서 장기간(60분)
오존처리한 실험군보다 20~50분간 처리하는 것이 발아와 유식물 성장 증진에 더욱 효과적이었는데, 처리시간의 최적값이 존재하는 볼록 곡선의 형태를
가지고 있다는 점을 의미한다. 또한 고유뿌리길이(SRL)로 비교한 결과, 뿌리생장에 악영향을 주지 않았다. 이상의 실험 결과는 활성산소종(ROS)이
세포성장조절작용, 병원균 방어 및 세포 산화환원상태를 조절함으로써 종자 발아와 유식물 성장 및 식물 성장 및 발달에 긍정적인 역할을 한다는 기존
연구 결과를 재확인해 주었다.
식물 종자는 식종 전에 다양한 휴면타파방법을 사용하여 발아율을 증진시킨다. 본 연구에서 사용한 자귀풀 종자를 간척지에서 채집하고
50% 황산으로 10분 처리하였을 경우 발아율이 21~26%에 불과하였고, 90oC로 40분간 고온처리한 경우에는
발아율이 90%로 증가하였다(Oh et al., 2015). 이에 비해 종자의 오존처리는 현장에서 간편하게 실시할 수 있으며, 고온처리 등에 필요한
설비가 필요하지 않고 폐황산과 같은 폐기물을 배출하지 않아 친환경적이라 할 수 있다. 또한 휴면타파 외에도 종자표면살균도 가능하기 때문에, 파종법으로
식물정화공법을 실시할 경우 유용한 현장 휴면타파법으로 적용할 수 있을 것이라 판단된다.
다만, 적용하는 식물에 따라 오존농도(C)와 접촉시간(T)에 대한 다양한 연구가 선행되어야 할 것이며, 본 연구에서 다양하게 실시하지
못한 발아실험을 위한 배지 선정 및 응고제(젤)의 영향에 대한 연구도 동시에 진행되어야 할 것으로 판단된다. 이와 같은 실험에서 식물의 물리적
특성(뿌리길이 및 부피) 측정에, 본 연구에서 사용한 SmartRoot와 같은 사진 분석프로그램을 사용하면, 많은 실험 자료를 보다 신속정확하게
처리할 수 있을 것으로 판단된다.
본 연구는 국립생물자원관 과제번호 NIBR-201820101의 일부 지원과 가천대학교 연구비 지원으로 수행되었습니다.
- 1. Abdul-Baki, A.A., 1974, Pitfalls in using sodium hypochlorite as a seed disinfectant in 14C incorporation studies, Plant Physiol., 53, 768-771.
-

- 2. Arthur, G.D., Stirk, W.A., and van Staden, J., 2004, Screening of aqueous extracts from gelling agents (Agar and Gelrite) for root-stimulating activity, S. Afr. J. Bot., 70(4), 595-601.
-

- 3. Bae, B., Kim, S.Y., Lee, I.S., and Chang, Y.Y., 2002, Kinetics of uptake and phyto-transformation of 2,4,6-trinitrotoluene by indigenous grasses in hydroponic cultures, Kor. Chem. Eng. Res., 24, 675-687.
- 4. Bailly, C., 2004, Active oxygen species and antioxidants in seed biology, Seed Sci. Res., 14(2), 93-107.
-

- 5. Buah, J.N., Kawamitsu, Y., Sato, S., and Murayama, S., 1999, Effects of different types and concentrations of gelling agents on the physical and chemical properites of media and the growth of banana (Musa spp.) in vitro, Plant Prod. Sci., 2(2), 138-145.
-

- 6. Carl Roth GmbH Co., 2017, Gellan Gum for Microbial Applications: User Manual.
- 7. Eissenstat, D.M., 1991, On the relationship between specific root length and the rate of root proliferation : A field study using citrus rootstocks, New Phytol., 118, 63-68.
-

- 8. El-Maarouf-Bouteau, H. and Bailly, C., 2008, Oxidative signaling in seed germination and dormancy, Plant Signaling Behav., 3(3), 175-182.
-

- 9. Finkelstein, R., Reeves, W., Ariizumi, T., and Steber, C., 2008, Molecular aspects of seed dormancy, Annu. Rev. Plant Biol, 59, 387-415.
-

- 10. Ichi, T., Koda, T., Asai, I., Hatanaka, A., and Sekiya, J., 1986, Effects of gelling agents on in vitro culture of plant tissues, Agric. Biol. Chem., 50(9), 2397-2399.
-

- 11. Klimaszewska, K., Bernier-Cardou, M., Cyr, D.R., and Sutton, B.C.S., 2000, Influence of gelling agents on culture medium gel strength, water availability, tissue water potential, and maturation response in embryogenic cultures of Pinus strobus L., In Vitro Cell. Dev. Biol.-Plant, 36, 279-286.
-

- 12. Koornneef, M., Bentsink, L., and Hilhorst, H., 2002, Seed dormancy and germination, Curr. Opin. Plant Biol., 5, 33-36.
-

- 13. Korea Seed & Variety Service (KS&VS), 2017, Seed Inspection Guideline, 2017-3.
- 14. Kramer-Walter, K.R., Bellingham, P.J., Millar, T.R., Smissen, R.D., Richardson, S.J., and Laughlin, D.C., 2016, Root traits are multidimensional: specific root length is independent from root tissue density and the plant economic spectrum, J. Ecol., 104, 1299-1310.
-

- 15. Lazukin, A., Seerdukov, Y., Pinchuk, M., Stepanova, O., Krivov, S., and Lyubushkina, I., 2018, Treatment of spring wheat seeds by ozone generated from humid air and dry oxygen, Res. Agr. Eng., 64(1), 34-40.
-

- 16. Liu, Y., Fang, J., Xu, F., CHu, J., Yan, C., Schlappi, M.R., Wang, Y., and Chu, C., 2014, Expression patterns of ABA and GA metabolism genes and hormone levels during rice seed development and imbibition: A comparison of dormant and non-dormant rice cultivars, J. Genet. Genomics, 41, 327-338.
-

- 17. Lobet, G., Pages, L., and Draye, X., 2011, A novel image-analysis toolbox enabling quantitative analysis of root system architecture, Plant Physiol., 157, 29-39.
-

- 18. Maximiano, C., Carmona, R., Souza, N.O.S., de Alencar, E.R., and Blum, L.E.B., 2018, Physiological and sanitary quality of maize seeds preconditioned in ozonated water, R. Bras. Eng. Agric. Ambiental, 22(5), 360-365.
-

- 19. Murashige, T. and Skoog, F., 1962, A revised medium for rapid growth and bio assays with tobacco tissue cultures, Physiol. Plant., 15, 473-497.
-

- 20. Oh, Y.Y., Lee, S.U., Kim, Y.J., Jeong, J.T., Ryu, J.H., Kim, S., Jung, J., Bae, H.S., Lee, S.H., Kim, Y.D., Hong, H.C., and Kim, S.L., 2015, Influence of seed germination by treatment of seed dormancy in Indian Jointvetch (Aeschynomene Indica L.) seed, J. Korean Soc. Int. Agric., 27(5), 663-666.
-

- 21. O'Neill, M.A., Selvendran, R.R., and Morris, V.J., 1983, Structure of the acidic extracellular gelling polysaccharide produced by Pseudomonas elodea, Carbohydr. Res., 124(1), 123-133.
-

- 22. Oracz, K., El-Maarouf Bouteau, H., Farrant, J.M., Cooper, K., Belghazi, M., Job, C., Job, D., Corbineau, F., and Bailly, C., 2007, ROS production and protein oxidation as a novel mechanism for seed dormancy alleviation, Plant J., 50, 452-465.
-

- 23. Ostonen, I., Puttsepp, U., Biel, C., Alberton, O., Bakker, M.R., Lohmus, K., Majdi, H., Metcalfe, D., Olsthoorn, A.F.M., Pronk, A., Vanguelova, E., Weih, M., and Brunner, I., 2007, Specific root length as an indicator of environmental change, Plant Biosyst., 141(3), 426-442.
-

- 24. Rock, S.A., 2003, Vegetative Covers for Waste Containment, In Phytoremediation, Scheper, T. and Tsao, D.T. eds., Adv. Biochem. Eng./Biotechnol., 78, 157-170.
-

- 25. Sauer, D.B. and Burroughs, R., 1986, Disinfection of seed surfaces with sodium hypochlorite, J. Phytopathol., 76(7), 745-749.
-

- 26. Schneider, C.A., Rasband, W.S., and Eliceiri, K.W., 2012, NIH Image to ImageJ: 25 years of image analysis, Nat. Methods, 9(7), 671-675.
-

- 27. Sudhakar, N., Nagendra-Prasad, D., Mohan, N., Hill, B., Gunasekaran, M., and Murugesan, K., 2011, Assessing influence of ozone in tomato seed dormancy alleviation, Am. J. Plant Sci., 2, 443-448.
-

- 28. van den Dries, N., Gianni, S., Czerednik, A., Krens, F.A., and de Klerk, G.-J.M., 2013, Flooding of the apoplast is a key factor in the development of hyperhydricity, J. Exp. Bot., 64(16), 5221-5230.
-

- 29. Vazquez, M.E.M., Pena-Valdivia, C.B., Garcia, J.R., Solano, E., Cmpos, H., and Garcia, E., 2017, Chemical scarification and ozone in seed dormancy alleviation of wild and domesticated Opuntia, Cactaceae, Ozone Sci. Eng., 39, 104-114.
-

- 30. Violleau, F., Hadjeba, K., Albet, J., Cazalis, R., and Olivier S., 2008, Effect of oxadative treatment on corn seed germination kinetics, Ozone Sci. Eng., 30, 418-422.
-

- 31. Whitaker, C., Beckett, R.P., Minibayeva, F.V., and Kranner, I., 2010, Alleviation of dormancy by reactive oxygen species in Bidens pilosa L. seeds, S. Afr. J. Bot., 76, 601-605.
-

 This Article
This Article
-
2019; 24(5): 1-10
Published on Oct 31, 2019
- 10.7857/JSGE.2019.24.5.001
- Received on Jul 7, 2019
- Revised on Jul 23, 2019
- Accepted on Sep 24, 2019
 Services
Services
Shared
 Correspondence to
Correspondence to
- Bumhan Bae
-
Department of Civil & Environmental Engineering, Gachon University
- E-mail: bhbae@gachon.ac.kr





