- Selective Enrichment to Obtain an Indigenous Microbial Consortium Degrading Recalcitrant TPHs(total petroleum hydrocarbons) from Petroleum-contaminated Soil in Kuwait
Jinho Ha1·Seonghoon Kim2·Hyunsoo Lim1·Woosik Jung1·Dajung Kim1·Keumyoung Lee3·Joonhong Park1*
1School of Civil and Environmental Engineering, Yonsei University, Seoul 03722, Korea
2Hankuk Engineering Consultant Co., Ltd, Gyeonggi-Do 14056, Korea
3H-Plus Eco Ltd, Seoul 05610, Korea- 쿠웨이트 원유오염 토양 내 잔류 난분해성 유기물 분해능 지닌 토착 미생물 배양체 획득을 위한 선택적 계대배양 실험 연구
하진호1·김성훈2·임현수1·정우식1·김다정1·이금영3·박준홍1*
1연세대학교 사회환경시스템공학부
2(주)한국종합엔지니어링
3에이치플러스에코(주)This article is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
In this work, an indigenous microbial consortium was obtained by selectively cultivating microbes using a long-aged petroleum-contaminated soil (Kuwait) containing recalcitrant petroleum hydrocarbons. The obtained microbial consortium was able to grow on and degrade the remaining petroleum hydrocarbons which could not have been utilized by the indigenous microbes in the original Kuwait soil. The following microbial community analysis using 16S rRNA gene sequencing suggested that the enhanced degradation of the remaining recalcitrant petroleum hydrocarbons by the novel microbial consortium may have been attributed to the selected bacterial populations belonging to Bacillus, Burkholderia, Sphingobacterium, Lachnospiraceae, Prevotella, Haemophilus, Pseudomonas, and Neisseria
Keywords: Kuwait petroleum-contaminated soil, Bioremediation, Total petroleum hydrocarbons(TPH), Selective enrichment, Microbial community analysis
산유국인 쿠웨이트는 과거 전쟁으로 인해 유류 특히 원유에 의한 토양오염이 심각하다(Al‐Awadhi et al., 1996). 쿠웨이트의 토양 유류오염은 국제사회에서 보다 더 심각한 환경 및 외교적인 이슈로 대두되고 있다(Radwan, 2008). 이러한 국제적 상황에 대처하기 위해서 쿠웨이트 석유 공사(Kuwait Petroleum Cooperation [KPC])는 대규모의 유류오염토양 정화사업을 발주 중이라 쿠웨이트 원유오염토양 정화에 대해서는 국내뿐 아니라 해외 환경산업 분야의 관심이 높다. 원유로 오염된 지역이 광범위해서 토양세척 등의 물리/화학적 정화공법 보다는 토양경작법(land-farming), 원위치 생물학적 토양정화(in-situ soil bioremediation) 등의 미생물을 이용하는 생물학적 정화공법에 KPC가 보다 더 관심을 갖고 있는 것으로 보인다(Ali et al., 2020). 하지만 누출된 원유가 전쟁에 의한 화재에 의해서 토양에 고정화되어 잔류 polyaromatic hydrocarbons(PAHs)는 생물학적으로 분해가 매우 어려운 유기오염물질(persistent organic pollutants [POPs])로 되었다(Alshemmari, 2021). 화재와 무관한 경우도 원유오염토양 내 잔류한 유류물질들은 토착 미생물들이 분해를 하지 못하는 난분해성 유기오염물질들(POPs)일 가능성이 높다(Ashraf, 2017). 이러한 원인들로 인해서 쿠웨이트 원유오염 토양의 생물학적 정화는 기술적인 난제이다.
원유오염 토양 내 잔류 유류유기물질 분해를 촉진하기 위해서는 난분해성 유류물질을 분해할 수 있는 미생물 제재의 획득이 필요하다. 이러한 난분해성 유류물질 분해 미생물 제재 획득을 위해서 일반적으로 사용하는 미생물학적 방법은 정화 대상 오염물질을 이용하여 목표로 한 미생물 제재를 선택적 계대배양(selective enrichment)하는 것이다. 기존의 방법들을 보면 유류오염토양 내 잔존 유류물질 중 특정 대표 물질을 선정해서 이를 단일 탄소원 및 기질(primary substrate)로 이용하여 액상 배지에서 계대배양을 수행하는 것이 일반적이다(Ibrahim et al., 2013). 하지만 이러한 기존의 방법은 현장 오염토양의 복잡한 특성을 반영하지 못한다는 근본적인 한계가 있다. 우선 현장의 잔류 유류오염은 불명의 다양한 유기물질들이 혼재되어 있으나 선택된 특정 유류물질이 현장의 복합한 오염특성을 반영할 수 없다는 점이고, 액상 배지를 통한 계대배양은 현장 토양의 특성을 반영할 수 없는 한계가 있다는 점이다. 액상 배지 활용 계대배양의 한계를 극복하기 위해서 오염되지 않은 토양에 원유 등을 주입하는 방식의 실험을 통해서 유류오염분해 미생물 제재를 확보하려 하나, 현장의 풍화적 영향을 포함한 토양 및 오염 특성을 반영할 수는 없다.
이러한 한계점들을 극복하기 위해서 본 연구에서는 현장의 유류오염토양 자체를 이용해서 잔존 TPHs(total petroleum hydrocarbons [총 석유계탄화수소])를 분해하는 토착 미생물 배양체를 획득하려는 시도를 하였다. 본 연구의 목표는 쿠웨이트 원유오염토양(Raudhatain, Kuwait)에서 잔존한 TPH(농도 약 15,000 mg-TPH/kg-soil, 이하 TPH)를 분해할 수 있는 토착 미생물 배양체를 선택적 계대배양을 통해 확보하고, 획득된 미생물 배양체의 분해능과 군집 특성을 규명하는 것이었다.
2.1. 미생물 제재 획득을 위한 계대배양 방법
본 연구에서는 토착 미생물 제재를 확보하기 위해서, 쿠웨이트 오염토양 내 토착 미생물 분리를 위한 배양과 2차에 걸친 계대배양을 수행하였다. 계대배양을 위한 무탄소원 Basal Media(BM; DSMZ GmbH, Germany)의 조성은 Autoclaved 된 Distilled water(DW)에 2.5 g/L Na2HCO3, 0.25 g/L NH4Cl, 0.6 g/L NaH2PO4·H2O, 0.1 g/L KCl, 10 mL/L Vitain Mix(10 mg Biotin, 2 mg Folic acid, 10 mg Pyridoxine HCl, 5 mg Riboflavin, 5mg Thiamine, 5 mg Nicotinic acid, 5 mg Pantothenic acid, 0.1 mg Vitamin B12, 5 mg p-aminobenzoic acid, 5 mg Thioctic acid, 1 L DW), 10 mL/L Mineral Mix(1.5 g NTA, 3 g MgSO4, 0.5 g MnSO4·H2O, 1 g NaCl, 0.1 g FeSO4· 7H2O, 0.1 g CaCl2·2H2O, 0.1 g CoCl2·6H2O, 0.13 g ZnCl2, 0.01 g CuSO4·5H2O, 0.01 g AlK(SO4)2·12H2O, 0.01 g H3BO3, 0.025 g Na2MoO4, 0.024 g NiCl2·6H2O, 0.025 g Na2WO4·2H2O, 1 L DW)로 이루어졌으며, BM의 pH는 7.2-7.5로 유지하였다.
1 L 삼각플라스크에 BM 500 mL와 쿠웨이트 원유오염토양 50 g을 주입하여 토착 미생물 분리를 위한 배양을 1주간 수행하였고, 500 mL 플라스크에 1주간 배양한 배양액의 상등액 30 mL(105 CFU/mL)와 BM 270 mL에 쿠웨이트 원유오염토양 30 g을 주입하여 1차 계대배양을 1주간 수행하였다. 마지막으로 500 mL 삼각플라스크에 1주간 배양한 1차 계대배양액의 상등액 2 mL(106 CFU/mL)와 BM 198 mL에 쿠웨이트 원유오염토양 20 g을 주입하여 2차 계대배양을 1주간 수행하였다. 계대배양 시, microcosm 내 TPH 농도를 일정하게 하기 위하여 원유 오염 토양과 BM의 볼륨비를 10%(v/v)로 설정하였고, 계대배양이 진행됨에 따라 BM에서 선택적으로 배양된 미생물들을 주입 상등액 mL당 CFU(colony forming unit) 수에 비례하여 주입하였다. 배양실험은 Shaking incu- bator(WIS-20R, DAIHAN Scientific Co)에서 배양온도 30oC, 교반속도 160 rpm 조건으로 수행하였다. 1, 2차 계대배양은 쿠웨이트 원유오염토양 내 잔존한 유류물질을 분해하는 토착 미생물 제재를 획득하기 위해, 사전에 Autoclave(MaXterile 60, DAIHAN Scientific Co)로 121 oC의 온도와, 15lb psi의 압력에서 약 15분 정도 멸균된 쿠웨이트 원유오염토양을 주입하였고, 호기성 조건을 유지하기 위해 배양 삼각플라스크의 마개로 sili stoppers를 사용하였다.
2.2. 미생물 배양체 분해능 확인 방법
쿠웨이트 오염토양 내 토착 미생물 분리를 위한 배양과 2차에 걸친 선택적 계대배양을 통해 획득된 BM 내 미생물 군집인 토착 미생물 배양체(JH-1)가 토양 내 유기물이 아닌, 잔존한 유류오염물질을 기질로 생장하는지 판단하기 위해서 500 mL 삼각플라스크에 액체 배지인 BM 297 mL에 autoclave로 멸균한 쿠웨이트 원유오염토양 30 g과 유기물이 함유된 점토성토양 30 g(화단토양) 그리고 유기물이 함유된 사질토양 30 g(운동장토양)에 토착 미생물 배양체 2 mL(106 CFU/mL)를 각각 주입하여 계대배양에서 활용한 배양실험과 동일한 조건으로 6일 동안 배양을 수행하였다. 기질별 미생물의 생장 속도를 비교하기 위하여 배양되고 있는 미생물의 정량적인 변화를 측정하였다. 토착 미생물 배양체의 잔류 TPH 분해능 분석 microcosm 실험 조건은 shaking incubator를 이용하여 30oC, 교반속도 160 rpm으로 교반하였다.
2.3. TPH 정량적 분석 방법
미생물에 의해 분해된 원유오염토양 시료 내 TPH 농도 측정을 위해 토양오염공정시험기준(ES 07552. 1b)에 등재된 방법과 Flame Ionization Detector(FID)가 탑재된 Gas Chromatography(GC)를 활용하여 농도 측정을 수행하였다.
우선, 토양 샘플 10 g에 토양 내 수분 제거를 위한 무수황산나트륨 10 g과 추출용매인 디클로로메탄 100 mL를 토양 샘플에 주입하였다. 혼합된 샘플을 초음파추출기로 10분간 추출 후 Kuderna-Danish 농축기를 이용해 추출액이 10 mL가 될 때까지 농축하였다. 마지막으로, 추출한 농축액을 1 mL vial에 주입하여 GC-FID를 이용하여 TPH 농도를 측정하였다. GC-FID의 운용 조건으로는 2 μL를 Injection volume으로 하였으며 오븐의 온도는 50~300oC, Hold time 30 min, rate 10oC/min, equilibration time 2 min로 설정하였으며, Inlet의 조건으로 splitless mode로 온도는 290oC, total Flow는 7.0126 psi로 설정하였고, Detector의 온도는 300oC로 유지하였다. Column (DB-TPH, Agilent Technologies)의 flow는 1.5 mL/min로 설정하였고 Carrier gas로는 N2를 사용하였다.
2.4. 미생물 정량적 분석 방법
미생물 생장의 정량적 분석을 위하여 식품의약품안전처 식품공전에 등재된 건조필름법을 활용하였다. 건조필름법을 이용하여 미생물 생장의 정량적 분석을 하기위해, 토착 미생물 배양체 샘플 1 mL를 추출하였고, Vortex mixer를 이용하여 샘플을 혼합하였다. 건조필름배지(일반세균용 페트리필름[AC plate, 3MTM])에 시료를 1 mL 접종하여 흡수시키고 페트리필름을 20장 이내로 쌓아 35 ± 1oC에서 24시간 배양하였다. 마지막으로 생성된 CFU 수를 측정하며 희석한 경우, 희석배수를 고려하여 최종 CFU 수를 보고하였다.
2.5. 개체 확인 및 군집 특성 분석 방법
획득된 토착 미생물들의 다양성을 파악하고 군집 구조의 변화 여부를 관찰하기 위해 쿠웨이트 원유오염토양과 토착 미생물 배양체로부터 FastDNA Kit for Soil(MP biomedicals, OH, USA)를 이용하여 전체 DNA를 추출을 수행하였고, NanoDrop ND-1000(Thermo Scientific, Wilmingyon, DE, USA)을 이용하여 A260 nm/A280 nm 흡광도 비율과 농도(ng/ul)를 분석하였다(Dineen et al., 2010). 16S rRNA(16S ribosomal RNA) 유전자를 PCR (Polymerase Chain Reaction)로 증폭하였다.
본 연구에서는 forward primer Bakt_341F(5‘-CCTAC GGGNGGCWGCAG-3‘)와 reverse primer Bakt_805R (5‘-GACTACHVGGGTATCTAATCC-3‘)를 사용하여 16S rRNA 유전자를 타겟으로 진행하였다(Herlemann et al., 2011). PCR 조건은 Predenaturation을 위해 94oC에서 1 min, Denaturation을 위해 94oC에서 1 min, 30 cycles, Annealing을 위해 50oC, 1 min, 30 cycles, Extension을 위해 72oC에서 2 min, 30 cycles, Final extension을 위해 72oC에서 5 min, 그리고 Hold를 4oC에서 유지하였다. 2X Taq PCR Pre-Mix(Biofact Inc)를 사용하여 Thermal Cycler C1000TM(Bio-Rad, California, USA)로 PCR을 수행하였다. 획득된 생성물의 DNA 염기서열을 Macrogen에서 Illumina Miseq(Illumina Inc, San Diego, USA)을 활용하여 분석하였다. Miseq으로 분석된 토착 미생물 배양체의 16S rRNA data를 Mothur 분석 프로그램을 활용하여 RDP 및 Silva의 16S rRNA database와 비교하여 군집 내 주요 개체들의 OTU(Operational taxonomic unit)를 확인하였고 획득된 토착 미생물 배양체의 군집을 분석하였다(Choi et al., 2020; Lee et al., 2011). 군집 내 우점하는 세균 개체들을 속(genus) 수준까지 확인하였고, 이를 근거로 토착 미생물들의 다양성과 군집 구조의 특성을 분석하였다.
3.1. 쿠웨이트 원유오염토양 내 잔류 유류오염물질을 기질로 생장능력 확인
본 연구에서는 쿠웨이트 원유오염토양 내 잔류 난분해성 유류오염물질 분해 미생물 제재를 확보하기 위해서, 총 2차 계대배양을 수행하여 토착 미생물 배양체(JH-1)를 확보하였다. 쿠웨이트 원유오염토양 내 유기물의 대부분은 잔류 유류오염물질이나, 일부 토양 유기물을 기질로 활용하여 미생물들이 생장했을 가능성도 고려하여, 유류오염이 없는 일반토양 시료(화단토양[대조군1], 운동장토양[대조군2])들에 토착 미생물 배양체를 주입하여 대조군으로 비교실험을 수행하였다.
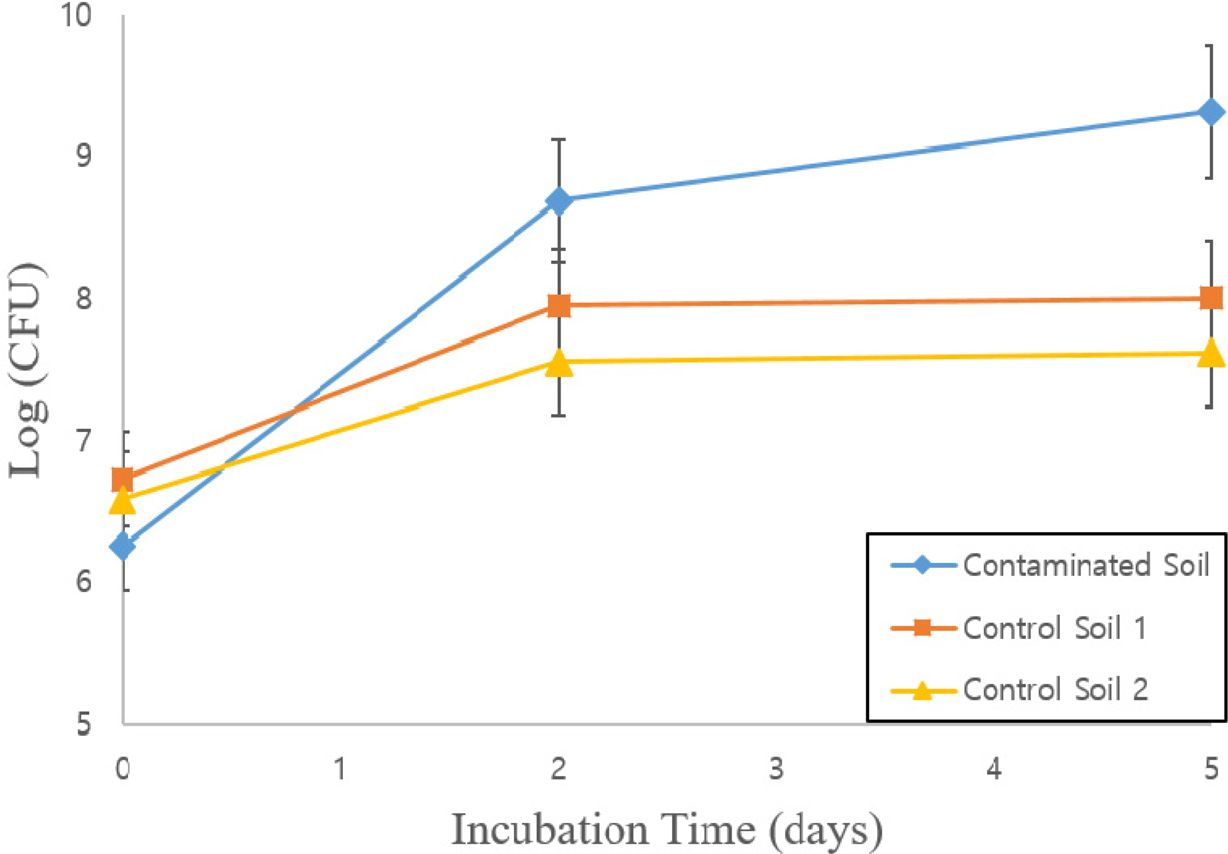
토착 미생물이 대조군의 토양 유기물을 기질로 활용하여 생장하기는 하였지만, 초기 미생물 양에 비해 약 20배 증가에 불과하여 쿠웨이트 원유오염토양 시료에서와 같은 100배 이상의 큰 생장을 보이지는 않았다. 이는 쿠웨이트 원유오염토양의 토착미생물 군집이 잔류 유류물질을 단일 탄소기질로 활용하여 선택적 계대배양을 거치면서 당초에는 분해하지 못했던 잔류 난분해성 유류오염물질들을 계대배양으로 획득된 미생물들이 생장기질로 활용하였음을 시사한다(Fig. 1). 또한, 쿠웨이트 원유오염토양에서 선택적 계대배양을 거치면서 획득된 토착 미생물 배양체는 잔류 난분해성 유류오염물질을 기질로 생장하는 능력에 특화된 것으로 판단된다. Table 1
3.2. 쿠웨이트 원유오염토양 내 잔류 유류오염물질 생분해능 확인
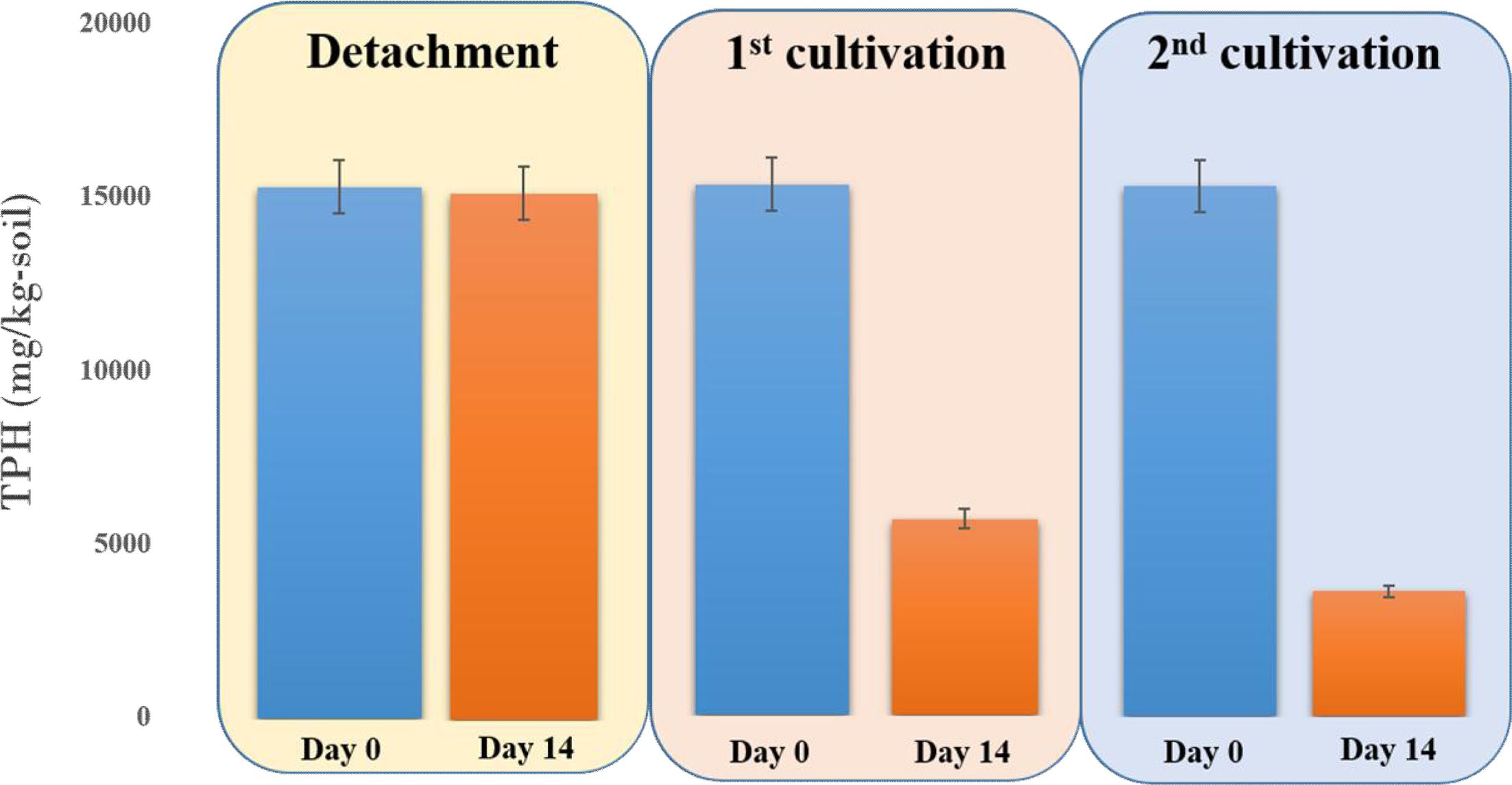
획득된 토착 미생물 배양체(JH-1)는 쿠웨이트 원유오염토양 내 잔류 난분해성 유류오염물질을 기질로 활용하여 생장함이 확인되었지만, 주입된 토착 미생물 배양체에 의해서 쿠웨이트 원유오염토양 내 잔존한 유류물질(TPH)이 실제로 분해가 되었는지에 대해서 실험적인 확인이 필요하였다. 분해된 원유오염토양 시료 내 TPH 농도 측정을 위하여 토양오염공정시험기준에 등재된 방법과 GC-FID를 활용하여 동일한 실험 조건으로 토양 샘플 10 g에 잔존한 TPH 농도를 측정하였다. 쿠웨이트 오염토양 내 토착 미생물 분리를 위한 배양과정에서는 초기 토양과 배양 14일 후 토양 내 TPH 농도의 변화가 거의 나타나지 않았으나, 1차 계대배양에서 획득된 토착 미생물 배양체를 쿠웨이트 원유오염토양에 주입한 결과, 초기 토양 내 TPH 농도(15,307 mg/kg-soil)가 14일 후 5,841 mg/kg-soil로 낮아져서 초기 TPH의 60%가 저감 되었고, 2차 계대배양 결과, 초기 토양 내 TPH 농도의 73%(3,608 mg/kg-soil)가 저감 되었다(Fig. 2). 이러한 결과에 의해서 획득된 토착 미생물 배양체의 쿠웨이트 원유오염토양 내 잔류 유류물질(TPH) 분해능이 입증되었고, TPH 분해능이 1차 계대배양을 거쳐 2차 계대배양에서 더 촉진됨을 확인하였다. 이는 잔류 TPH를 단일 탄소원으로 하는 계대배양을 통해 잔류 유류오염물질을 분해할 수 있는 토착 미생물들이 선택적으로 배양되었음을 의미한다.
3.3. 획득된 토착 미생물 배양체(JH-1) 내 개체 확인 및 군집 특성
쿠웨이트 원유오염 토양 내 잔류 난분해성 유류오염물질을 기질로 분해 및 생장할 수는 있는 토착 미생물 배양체 내 우점하는 개체 확인과 군집 특성 규명을 위해서 16S rRNA 유전자 염기서열 분석(relative abundance cut-off > 1%)을 수행하였다. 쿠웨이트 원유오염 토양 내 잔류 유류오염물질을 분해하지 못하였던 기존 토착 미생물 군집의 특성이 본 연구의 선택적 계대배양을 거치면서 어떠한 특정 토착 미생물들이 선택적으로 배양이 되었는지를 중점적으로 파악하려 하였다. 쿠웨이트 원유오염토양에 존재하는 기존 토착 미생물들의 약 50%는 원유를 분해하는 것으로 알려진 세균들(Dietzia, Bacillus, Pseu- domonas, Phenylobacterium, Sphingobacterium, Burkholderia, Azospirillum)과 속(genus) 수준(염기서열 일치도 97% 이상)에서 유사한 것으로 밝혀졌다(Guo-Liang et al., 2008; Hamzah et al., 2010; Izmalkova et al., 2018; JALILZADEH et al., 2014; Kavynifard et al., 2016; Okoh et al., 2001; Wang et al., 2010). 쿠웨이트 원유오염토양 내 잔류 유류오염물질을 이용한 선택적 계대배양으로 획득된 토착 미생물 배양체의 군집분석 결과, Bacillus, Burkholderia, Lachnospiraceae, Sphingobacterium, Prevotella, Haemophilus, Neisseria의 상대빈도가 계대배양 전과 비교하여 현격하게 증가하였다. 이들 중에서 Bacillus, Burkholderia, Sphingo- bacterium, Haemophilus 개체들은 난분해성 polycyclic aromatic hydrocarbons(PAHs) 분해능이 있는 세균들과 속 수준에서 유사한 것으로 밝혀졌다(Andreolli et al., 2013; Carmichael et al., 2001; Ejoh et al., 2012; Haritash et al., 2009; Lu et al., 2011). 이 계대배양을 통해서 상대빈도가 현격하게 증가한 유류분해 미생물 개체들이라는 점에서 쿠웨이트 원유오염토양 내 잔류하는 유류오염물질 분해에 기여한 미생물 개체들일 개연성이 높다. 반면, Lachnospiraceae, Prevotella, Neisseria 과(family) 또는 속에 속하는 세균들은 유류물질을 분해하는 것에 대해 알려진 바가 없었으므로 추가적인 연구가 필요하다.
쿠웨이트 원유오염토양에 존재하는 기존 토착 미생물 군집이 잔류 유류물질을 단일 탄소기질로 활용하여 계대배양을 거치면서 당초에는 분해하지 못했던 잔류 난분해성 유류오염물질들을 생장기질로 활용하여 효과적으로 분해할 수 있는 토착 유류물질분해 미생물 군집 배양체가 선택적으로 배양되었음이 확인하였다. 지난 수 년의 기간 동안 자연저감으로 분해가 되지 않고 잔류해 왔던 난분해성 원유오염은 토양오염정화기술 분야의 공학적 난제이지만(Raymond et al., 2001), 획득된 토착 미생물 배양체에 의해 쿠웨이트 원유오염 토양 내 잔류 유류오염물질이 분해됨을 보였다.
기존의 토착 미생물들이 더 이상 분해를 하지 못하던 잔류 유류오염물질들과 정화 대상의 토양 자체를 활용한 선택적 계대배양 과정에서 획득된 토착 미생물 배양체가 기존 토착 미생물들이 분해하지 못했던 잔류 유류오염물질들을 분해할 수 있게 된 점은 매우 흥미로운 현상이다. 미생물 군집 분석 결과, 기존 쿠웨이트 원유오염토양에 우점하는 미생물 개체들의 50% 정도가 알려진 유류물질 분해 세균들이었지만, 이들은 잔류하는 유류오염물질 분해에 기여하지 못하였다. 이는 토착 미생물 중 잔류 유류오염물질 분해를 할 수 있는 개체의 빈도가 미미하거나, 타 토착 미생물 개체들에 의한 방해 영향이 있을 수 있다(Haritash et al., 2009). 토착 미생물 군집 내에서 잔류 유류오염물질 분해를 할 수 있는 토착 미생물 개체의 상대빈도를 증대시키기 위해서 정화대상 토양 내 잔류한 난분해성 유류오염물질을 단일 탄소원 및 생장기질로 사용하여 선별적 배양이 되었다. 타 토착 미생물 개체들에 의한 방해 영향을 최소화하기 위해서 계대배양에 사용한 토양을 멸균한 것도 잔류 유류오염물질을 분해하는 토착 미생물 개체의 선별적 배양에 기여한 것 같다. 또한 사용한 BM 용액의 영양염류 및 기타 생화학적 활성도 증진 물질들이 토착 미생물들의 잔류 유류오염물질 분해를 촉진하는 역할을 했을 가능성도 배제할 수는 없다(Eto et al., 2013).
정화 대상 현장의 유류오염토양 내 잔류하는 난분해성 유류오염물질과 토양 자체를 사용한 계대배양 방법의 과학적 근거에 대한 추가적 연구는 더 필요하다. 그럼에도 불구하고, 생물학적 정화 대상의 현장 토양오염 특성을 유지한 조건에서 수행된 실험실 규모의 선택적 계대배양을 통해서 획득된 토착 미생물 배양체는 쿠웨이트 원유오염토양 조건에서 잔류 난분해성 유류오염물질 분해에 적용할 수 있는 가능성을 보이었다.
|
Fig. 1 Time-course microbial growth (log[CFU]) results in the Kuwait petroleum-contaminated soil (Contaminated Soil) and non-contaminated control soils (Control Soil 1 and Control Soil 2). Error bars represent the standard errors of duplicate samples. |
|
Fig. 2 Enhanced TPH biodegradation by the microbial consortia in the detachment, 1st and 2nd selective enrichment experiments, respectively (Day 0 indicates the initial TPH concentration, Day 14 indicates the remaining TPH concentration after 14 days incubation with the added microbial consortium). Error bars represent the standard errors of duplicate samples. |
|
Table 1 Dominant bacterial populations and their relative abundances (RAs, the numbers in the parentheses) in the microbial communities in the Kuwait petroleum contaminated soil and the microbial consortium JH-1 finally obtained after the selective enrichment (relative abundance cut-off > 1%) |

본 연구에서는 오랜 기간의 풍화작용으로 분해되지 않았던 쿠웨이트 원유오염토양 내 잔류 난분해성 유류오염물질을 분해할 수 있는 토착 미생물 배양체(JH-1)를 확보하고, 이들이 잔류 유류오염물질을 기질로 생장하면서 분해할 수 있음을 입증하였고, 이 신규 미생물 배양체 내 우점종 세균 개체들에 대한 확인이 수행되었다. 생물학적 정화의 목표가 되는 오염토양 자체를 선택적 계대배양에 활용하는 접근 방식은 선별적 미생물 제재 확보 단계에서 현장 조건을 반영하는 특성으로 인해서 현장 맞춤형 미생물 제재 확보하는 방법으로 자리매김이 가능하다. 이를 위한 체계적인 기술적 정립화를 위한 추가 연구가 필요하다. 본 연구에서 획득된 미생물 배양체를 활용하면 자연저감으로 분해가 되지 않고 잔류해 왔던 난분해성 원유오염의 생물학적 정화가 가능해 질 것으로 기대한다.
본 연구는 환경부 “지중환경오염·위해관리기술개발사업; 2020002480003"으로 지원받은 과제임.
- 1. Al‐Awadhi, N., Al‐Daher, R., EINawawy, A., and Salba, M.T., 1996, Bioremediation of oil‐contaminated soil in Kuwait. I. landfarming to remediate oil‐contaminated soil, Soil and Sediment Contamination, 5(3), 243-260.
- 2. Ali, N., Dashti, N., Khanafer, M., Al-Awadhi, H., Radwan, S., 2020, Bioremediation of soils saturated with spilled crude oil, Scientific reports, 10(1), 1-9.
-

- 3. Alshemmari, H., 2021, An overview of persistent organic pollutants along the coastal environment of Kuwait, Open Chemistry, 19(1), 149-156.
-

- 4. Andreolli, M., Lampis, S., Poli, M., Gullner, G., Biró, B., and Vallini, G., 2013, Endophytic Burkholderia fungorum DBT1 can improve phytoremediation efficiency of polycyclic aromatic hydrocarbons, Chemosphere, 92(6), 688-694.
-

- 5. Ashraf, M.A., 2017, Persistent organic pollutants (POPs): a global issue, a global challenge, Environmental Science and Pollution Research, 24, 4223-4227.
-

- 6. Carmichael, A.B. and Wong, L.L., 2001, Protein engineering of Bacillus megaterium CYP102: the oxidation of polycyclic aromatic hydrocarbons, European Journal of Biochemistry, 268 (10), 3117-3125.
-

- 7. Choi, M., Chaudhary, R., Lee, M., Kim, J., Cho, K., Chung, Y.C., Bae, H., and Park, J., 2020, Enhanced selective enrichment of partial nitritation and anammox bacteria in a novel two-stage continuous flow system using flat-type poly (vinylalcohol) cryogel films, Bioresource Technology, 300, 122546.
-

- 8. Dineen, S.M., Aranda IV, R., Anders, D.L., and Robertson, J.M., 2010, An evaluation of commercial DNA extraction kits for the isolation of bacterial spore DNA from soil, Journal of Applied Microbiology, 109(6), 1886-1896.
-

- 9. Ejoh, O.E., Adenipekun, C.O., and Ogunjobi, A.A., 2012, Effect of Pleurotus tuber-regium Singer and microorganisms on degradation of soil contaminated with spent cutting fluid, New York Science Journal, 5(10), 121-128.
- 10. Eto, D., Watanabe, K., Saeki, H., Oinuma, K.I., Otani, K.I., Nobukuni, M., Takano, H.S., Takano, H., Beppu, T., Ueda, K., 2013, Divergent effects of desferrioxamine on bacterial growth and characteristics, The Journal of Antibiotics, 66(4), 199-203.
-

- 11. Guo-Liang, Z., Yue-ting, W.U., Xin-ping, Q., and Qin, M., 2005, Biodegradation of crude oil by Pseudomonas aeruginosa in the presence of rhamnolipids, Journal of Zhejiang University Science B, 6(8), 725-730.
-

- 12. Haritash, A.K. and Kaushik, C.P., 2009, Biodegradation aspects of polycyclic aromatic hydrocarbons (PAHs): a review, Journal of Hazardous Materials, 169(1-3), 1-15.
-

- 13. Hamzah, A., Rabu, A., Azmy, R.F.H.R., and Yussoff, N.A., 2010, Isolation and characterization of bacteria degrading Sumandak and South Angsi oils, Sains Malaysiana, 39(2), 161-168.
- 14. Herlemann, D.P., Labrenz, M., Jürgens, K., Bertilsson, S., Waniek, J.J., and Andersson, A.F., 2011, Transitions in bacterial communities along the 2000 km salinity gradient of the Baltic Sea, The ISME Journal, 5(10), 1571-1579.
-

- 15. Izmalkova, T.Y., Gafarov, A.B., Sazonova, O.I., Sokolov, S.L., Kosheleva, I.A., and Boronin, A.M., 2018, Diversity of oil-degrading microorganisms in the Gulf of Finland (Baltic Sea) in spring and in summer, Microbiology, 87(2), 261-271.
-

- 16. JALILZADEH, Y.R., Sekhavatjou, M.S., Maktabi, P., ARBAB, S.N., Khadivi, S., Pourjafarian, V., 2014, The biodegradation of crude oil by Bacillus subtilis isolated from contaminated soil in hot weather areas, International Journal of Environmental Research, 8(2), 509-514.
- 17. Kavynifard, A., Ebrahimipour, G., and Ghasempour, A., 2016, Optimization of crude oil degradation by Dietzia cinnamea KA1, capable of biosurfactant production, Journal of Basic Microbiology, 56(5), 566-575.
-

- 18. Lee, J., Lee, T.K., Löffler, F.E., and Park, J., 2011, Characterization of microbial community structure and population dynamics of tetrachloroethene-dechlorinating tidal mudflat communities, Biodegradation, 22(4), 687-698.
-

- 19. Lu, X., Zhang, T., Fang, H.H.P., Leung, K.M., and Zhang, G., 2011, Biodegradation of naphthalene by enriched marine denitrifying bacteria, International Biodeterioration and Biodegradation, 65(1), 204-211.
-

- 20. Okoh, A., Ajisebutu, S., Babalola, G., and Trejo-Hernandez, M., 2001, Potential of Burkholderia cepacia RQ1 in the biodegradation of heavy crude oil, International Microbiology, 4(2), 83-87.
-

- 21. Radwan, S., 2008, Microbiology of Oil-Contaminated Desert Soils and Coastal Areas in the Arabian Gulf Region. Dion, P., and Nautiyal, C. S.,(ed.), Microbiology of Extreme Soils, Springer, Germany, p.275-298
-

- 22. Raymond, J.W., Rogers, T.N., Shonnard, D.R., Kline, A.A., 2001, A review of structure-based biodegradation estimation methods, Journal of Hazardous Materials, 84(2-3), 189-215.
-

- 23. Wang, W., Wang, L., and Shao, Z., 2010, Diversity and abundance of oil-degrading bacteria and alkane hydroxylase (alkB) genes in the subtropical seawater of Xiamen Island, Microbial Ecology, 60(2), 429-439.
-

 This Article
This Article
-
2021; 26(4): 20-26
Published on Aug 31, 2021
- 10.7857/JSGE.2021.26.4.020
- Received on Apr 6, 2021
- Revised on Apr 13, 2021
- Accepted on Aug 19, 2021
 Services
Services
Shared
 Correspondence to
Correspondence to
- Joonhong Park
-
School of Civil and Environmental Engineering, Yonsei University, Seoul 03722, Korea
- E-mail: parkj@yonsei.ac.kr





