- An Experimental Study on Denitrification Efficiency of Agricultural Byproducts for Prevention of Nitrate Contamination from LID or Groundwater Recharge Facilities
Jinwon Lee1·Thanh Huy Phung1·Byungsun Lee2·Kangjoo Kim1*·Gyusang Lee2
1Department of Environmental Engineering, Kunsan National University
2Korea Rural Community Corporation, Rural Research Institute- 지하수 함양시설 또는 LID시설에서의 질산성질소 오염방지를 위한 농업부산물의 탈질효율 실험연구
이진원1·Phung Thanh Huy1·이병선2·김강주1*·이규상2
1군산대학교 환경공학과
2한국농어촌공사 농어촌연구원This article is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Facilities for low impact development (LID) or groundwater recharge have the high potential spreading groundwater nitrate contamination because of the rapid infiltration. This study was initiated to remove nitrate from the waters using agricultural byproducts as organic sources for denitrification during infiltration. As the first step of this purpose, we experimentally tested the denitrifying efficiency of 4 organic materials (pine tree woodchips, cherry leaves, rice straws, and rice hulls) and tried to identify the key factors controlling the efficiency. For this study, we precisely investigated the change of chemical reactions during the experiment by analyzing various geochemical parameters. The result shows that the denitrification efficiency is not simply linked to the availability of the easily decomposable contents in the organic matter. It is found that avoiding the severe pH decrease due to the CO2 generation is the essence to derive the efficient denitrifying conditions when organic matters were used.
Keywords: denitrification, groundwater, nitrate, organic matter, agricultural byproducts, carbon dioxide
2020 지하수측정연보(MOE, 2020)에 의하면, 2019년 질산성질소(NO3-N)는 지하수 수질 항목 중 pH, 총대장균군, 염소이온을 제외하고 가장 흔하게 관찰되는 수질부적합항목이다. 우리나라의 질산성질소에 의한 지하수오염은 농어촌지역에서 더 심각하게 나타나고 있다(Kim and Woo, 2003; Lee et al., 2008; Jeon et al., 2011). 유아 및 소아의 경우, 위액의 pH가 중성(~7)에 가깝기 때문에 질산성질소 농도가 높은 물을 섭취할 경우, 질산성질소가 쉽게 아질산성질소로 환원된다. 아질산성질소는 발암성이 의심되는 물질로 알려져 있으며(Guadagnini and Tonelli, 2013), 헤모글로빈의 산소 운반작용을 방해하여 청색증(blue baby syndrome or methemoglobinemia)을 유발시킴으로써, 심한 경우에는 사망에 이를 수도 있는 것으로 알려져 있다(Comly, 1945; Guadagnini and Tonelli, 2013). 고농도의 질산성질소 지하수는 가축의 출산율을 저하시키거나(Chandler, 1989) 하천과 해수의 총질소 농도를 높여 부영양화를 일으키기도 한다(Fennesy and Cronk, 1997). 이와 같은 위해성으로 인하여 우리나라는 질산성질소의 먹는물수질기준을 10 mg-N/L 이하로, 생활용지하수 수질기준은 20 mg-N/L 이하로 제한하고 있다.
질산성질소를 저감하는 방법들에는 여러 가지가 있으나, 박테리아 등 미생물학적 환원반응을 통해 질산성질소를 질소기체로 탈질시키는 생물학적 처리법이 가장 광범위하게 이용되고 있다. 지하수와 토양 내에서 질산성질소를 원위치 제거할 수 있는 미생물학적 방법으로는 독립영양탈질 미생물을 이용한 방법(Koenig and Liu, 1996; Straub et al., 1996; Till et al., 1998)과 종속영양 탈질미생물을 이용한 방법(Cameron and Schipper, 2010)이 있다. 이중 종속영양탈질은 탄소원으로 외부 유기탄소를 이용하며 유기물의 산화환원반응을 통하여 에너지를 얻는다. 지금까지 톱밥(Carmichael, 1994; Schipper and Vojvodiæ-Vukoviæ, 2000; Healy et al., 2006), 우드칩(Vogan, 1993; Kim et al., 2003; Gibert et al., 2008; Greenan et al., 2009), 액상당밀(Lee et al., 2013; Smyk and Ignato- wicz, 2017), 메탄올/에탄올(Monteith et al., 1980; Skrinde and Bhagat, 1982; Lee et al., 2001), 나뭇잎(Kim et al., 2003; Gibert et al., 2008) 등과 볏짚, 왕겨 등과 같은 농업부산물(Soares and Abeliovich, 1998; Shao et al., 2009; Schipper et al., 2010)을 활용하여 종속영양탈질을 유도하는 다양한 연구들이 진행되어 왔다.
농업부산물은 우리나라 전국 각지에서 발생되고 있으나 그 발생량과 처리현황에 대한 정확한 수치는 집계되고 있지 못하는 실정이다(Suh et al., 2017). 국내에서 발생된 농업부산물은 일부 가공되어 식용, 사료, 퇴비로 사용되기도 하나, 상당부분은 농경지에 그대로 방치되고 있다. 농경지에 방치된 농업부산물의 일부는 소각처리되기도 하는데 이는 미세먼지를 발생시켜 또 다른 환경문제를 야기하기도 한다.
일반적으로 질산성질소 농도가 높은 지하수는 지표의 투수성이 높은 지역에서 높게 나타난다(Min et al., 2003). 지표투수성이 높은 지역에서는 왕성한 빗물함양으로 침투수에 포함된 질산성질소가 그대로 대수층에 공급되기 때문이다. 이러한 측면에서 집중적인 지표수의 침투가 이루어지는 저영향개발(Low Impact Development; LID)시설 또는 지하수 함양시설들은 질산성질소에 의한 지하수오염이 확산시키는 진원지가 될 수도 있다. 본 연구는 농업부산물을 탈질을 위한 유기물 공급원으로 활용하여 지표수가 이들 시설을 통하여 침투되는 동안, 질산성질소농도를 제거함으로써 지하수의 질산성질소 오염확산 방지를 도모하고, 농업부산물의 처리에도 기여하고자 하는 목적으로 진행되었다. 이를 위한 첫 단계로써 흔히 볼 수 있는 우드칩(woodchips), 벚나뭇잎(cherry leaves), 볏짚(rice straws), 왕겨(rice hulls) 등 4가지 재료를 선정하였다. 이 재료들에 대하여 탈질능력을 비교 평가하고 탈질에 영향을 주는 핵심인자들을 규명하는 연구를 수행하였다. 특히, 본 연구는 다양한 지구화학적 항목들의 분석을 통하여 탈질과정 중에 일어나는 화학반응들을 면밀히 파악함으로써, 재료별 탈질능력의 차이가 발생하는 구체적인 원인들을 규명하였다는 점에서 의의가 있다.
본 연구에는 우드칩(woodchips), 벚나뭇잎(cherry leaves), 볏짚(rice straws), 왕겨(rice hulls)가 사용되었다(Fig. 1). 여기서, 우드칩은 소나무 우드칩이며 볏짚은 경기도 고성, 왕겨는 전라남도 장성에서 채집된 것을 구매하였다. 벚나뭇잎은 군산대학교 교정에서 채집한 것들이다. 우드칩과 볏짚은 3-5 cm 정도의 크기로 잘라 사용하였으며, 벚나뭇잎과 왕겨는 그대로 사용하였다.
본 실험에 사용된 농업부산물 재료의 셀룰로스(cell- ulose), 헤미셀룰로스(hemicellulose), 리그닌(lignin) 등의 함량은 국립식량과학원 바이오에너지작물 연구소에 의뢰하여 분석하였고, 알칼리(토)금속(Ca2+, Mg2+, Na+, K+)과 Fe 및 Mn의 함량은 질산으로 가열분해한 다음, 유도결합플라즈마 분광분석기(ICP-OES, Perkinelmer 4300DV)를 이용하여 분석하였다.
실험에 사용한 반응조들은 2 L 유리광구병을 사용하여 제작하였다. 본 실험을 위하여 1 cm 크기의 작은 구멍 2개가 뚫려 있는 고무마개로 광구병의 입구를 막았고, 각각의 작은 구멍에는 플라스틱 관을 끼운 다음, 얇은 고무마개(reverse thread cap rubber plug)로 다시 밀봉하였다(Fig. 2). 이들 중 한 고무마개에 주사기를 찔러서 반응조 내부의 수질시료를 채수할 수 있도록 하였다. 다른 고무마개는 반응 도중 발생하는 CO2 가스로 인하여 내부 압력이 증가되거나 수질시료채취에 따른 부피 수축으로 내부가 음압상태가 되는 것을 완충하여 주기 위하여 테들라백(Tedlar bag)에 주사기바늘을 연결하여 줌으로써 내부의 압력을 대기압과 같게 되도록 하였다(Fig. 2). 반응조의 상부공간과 테들라백(Tedlar bag)은 초순수질소로 채우고 반응실험을 시작하였다.
본 연구를 위하여 이와 같은 반응조 5개(A~E)를 준비하였고, 반응조 B~E에는 농업부산물 재료 50 g을 취하여 넣고(B: 우드칩, C: 벚나뭇잎, D: 볏짚, E: 왕겨) 1.5 L의 KNO3(20 mg-N/L) 용액과 반응시켰다. 반응조 A는 대조군으로 사용하기 위하여 유기물없이 1.5 L의 KNO3(20 mg-N/L) 용액만을 사용하였다(Table 1). 반응에 따른 수질변화는 반응시작 후 4, 10, 16, 24, 36, 48, 72, 96, 144, 216, 264 hr 시점에서 시료를 채취하여 관찰하였다. 본 실험에서는 반응조 내부의 pH를 조절하지 않음으로써, 유기물과의 반응에 의해 용액의 pH가 변화되도록 하였다. 각 반응조들은 25oC로 고정된 인큐베이터에 넣고 실험을 수행하였다.
반응조 내의 물 시료는 뚜껑에 설치된 작은 관에 설치된 고무스토퍼를 통하여 20 cm 길이의 바늘(20 G)을 이용하여 주사기로 채취하였다. 시료 채취는 1회 60(±1) mL를 하였다. 채취한 시료 중 10 mL는 pH, DO(dissolved oxygen), EC(electrical conductivity) 및 Eh를 측정하는데 사용하였으며, 나머지 시료는 0.45 mm 막여과지로 여과한 후 10 mL는 산처리(질산)하여 양이온 분석에 사용하였으며, 40 mL는 음이온 및 수질분석 시료로 사용하였다.
시료의 pH, Eh, EC, DO는 전극을 사용하여 채취 직후 측정하였다. pH, 산화환원전위(Eh), 전기전도도(EC) 전극들은 표준용액을 이용하여 보정하였으며, DO는 형광전극(Orion 087010MD)을 이용하여 측정하였으며, 수증기로 포화된 공기에 대하여 온도를 고려하여 보정하였다. 알칼리도(Alkalinity)는 묽은 염산(약 0.05 N)을 사용하여 그랜적정법(Gran titration)으로 분석하였다(Kim et al., 2019). 알칼리도 분석에 사용된 염산용액의 농도는 NaHCO3 1 meq/L 표준용액을 분석하는 방법으로 정확히 보정하여 사용하였다. 주요 양이온(Ca2+, Mg2+, Na+, K+, NH4+)과 음이온(Cl-, NO3-, SO42- NO2-) 분석은 이온크로마토그래프(Dionex DX500)을 이용하였으며, 총용존무기질소(TDIN; total dissolved inorganic nitrogen)은 분석된 NO3-N, NH4-N 및 NO2-N을 더하여 산출하였다. Fe, Mn은 ICP-OES(Perkinelmer 4300DV)를 이용하여 분석하였으며, 이산화탄소분압(pCO2 = log [partial pressure of dissolved CO2])과 광물 포화지수(Saturation index; SI = log IAP/Ksp, here, IAP = ion activity product, Ksp = solubility product), 그리고 용존무기탄소(DIC, dissolved inorganic carbon)는 PHREEQC(Parkhurst and Appelo, 1999)를 이용하여 산출하였다. 용존유기탄소(DOC, dissolved organic carbon)는 TOC analyzer(GE Analytical Instruments, Sievers InnovOx TOC)를 이용하여 분석하였다.

|
Fig. 1 Agricultural by-products used for this study. |

|
Fig. 2 Photos of the reactor (left) and the syringe with a 20 cm long, 20 G needle (right) used for the experiments of this study. |
3.1. 유기물 재료 분석 결과
목재는 셀룰로스(cellulose), 헤미셀룰로스(hemicellulose), 리그닌(lignin)으로 구성되어 있으며 이들은 비교적 분해가 어렵다(Hosoya et al., 2007). 셀룰로스(cellulose)는 식물 세포벽을 이루는 기본구조이며, 모든 식물성 물질의 30% 이상을 차지하는 것으로 알려져 있다(Kumar et al., 2009). 헤미셀룰로스(hemicellulose)는 세포벽을 구성하는 다당류 중에서 셀룰로스(cellulose)를 제외한 것을 말한다. 리그닌(lignin)은 나무의 단단함을 제공하는 성분으로 가장 분해가 어려운 성분이다. 이들은 토양 속에서 매우 느리게 분해되기 때문에 토양층 내 환원환경을 반영구적으로 만들어주는데 유용한 것으로 알려져 있다(Partheeban et al., 2014).
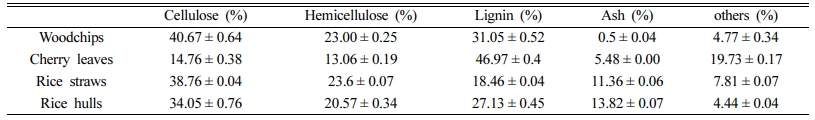
실험에 사용된 농업부산물들에 대한 셀룰로스, 헤미셀룰로스 및 리그닌의 분석 결과(Table 2), 셀룰로스, 헤미셀룰로스는 우드칩과 볏짚에서 비교적 높은 함량을 보였다. 리그닌은 벚나뭇잎에서 함량이 가장 높았으며, 볏짚은 가장 작은 함량을 보였다. Ash의 함량은 볏짚과 왕겨에서 높았으며, 그 외 기타성분은 벚나뭇잎에서 가장 많이 관찰되었다. Ash성분은 태웠을 때 잔류하는 부분으로써 Ca2+, Mg2+, Na+, K+, Fe, Mn, Si, Al 등이 주 구성성분이다. 기타 항목들은 셀룰로스, 헤미셀룰로스와 리그닌이 아닌 유기성분으로 주로 수지, 정유, 유지, 타닌 등이 여기에 해당한다.
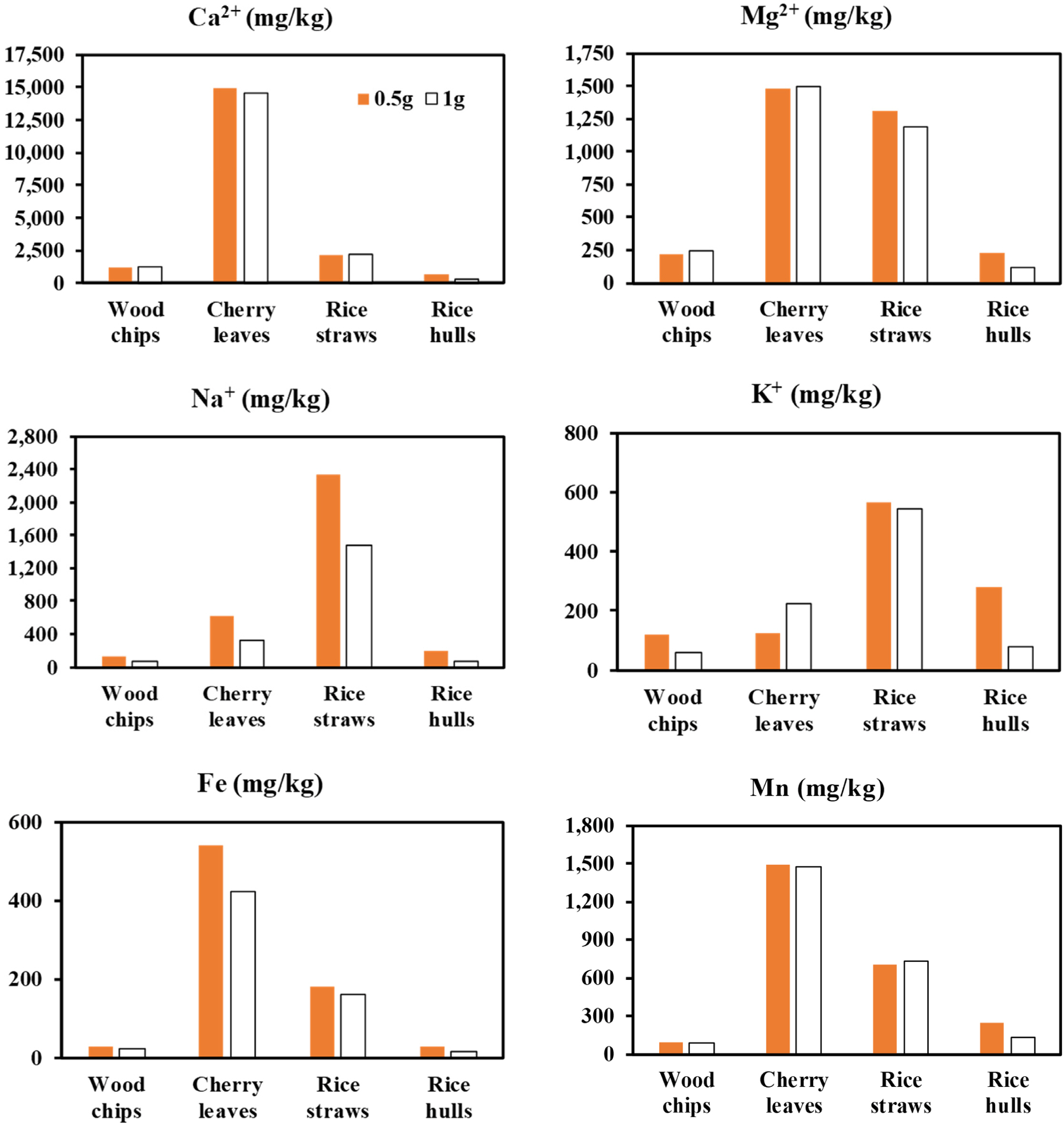
금속성분 분석결과(Fig. 3), 벚나뭇잎은 다른 재료들 보다 5~6배 높은 Ca2+함량을 보였고 Mg2+, Fe, Mn 등도 다른 재료들에 비하여 높은 함량을 보였다. 볏짚은 Na+와 K+의 함량이 다른 재료들에 비하여 매우 높았고, Mg2+는 벚나뭇잎과 대등하게 높은 값을 보였다. 왕겨와 우드칩은 모든 항목에서 상대적으로 매우 낮은 함량을 보였다. 왕겨와 우드칩만을 비교할 때, Ca2+ 함량은 우드칩이 다소 높았으나 K+, Mn의 함량은 왕겨가 높았고, 나머지 항목(Mg2+, Na+, Fe)은 서로 대등한 함량을 보였다.
3.2. 재료별 탈질 속도와 시간에 따른 질소화학종의 농도변화
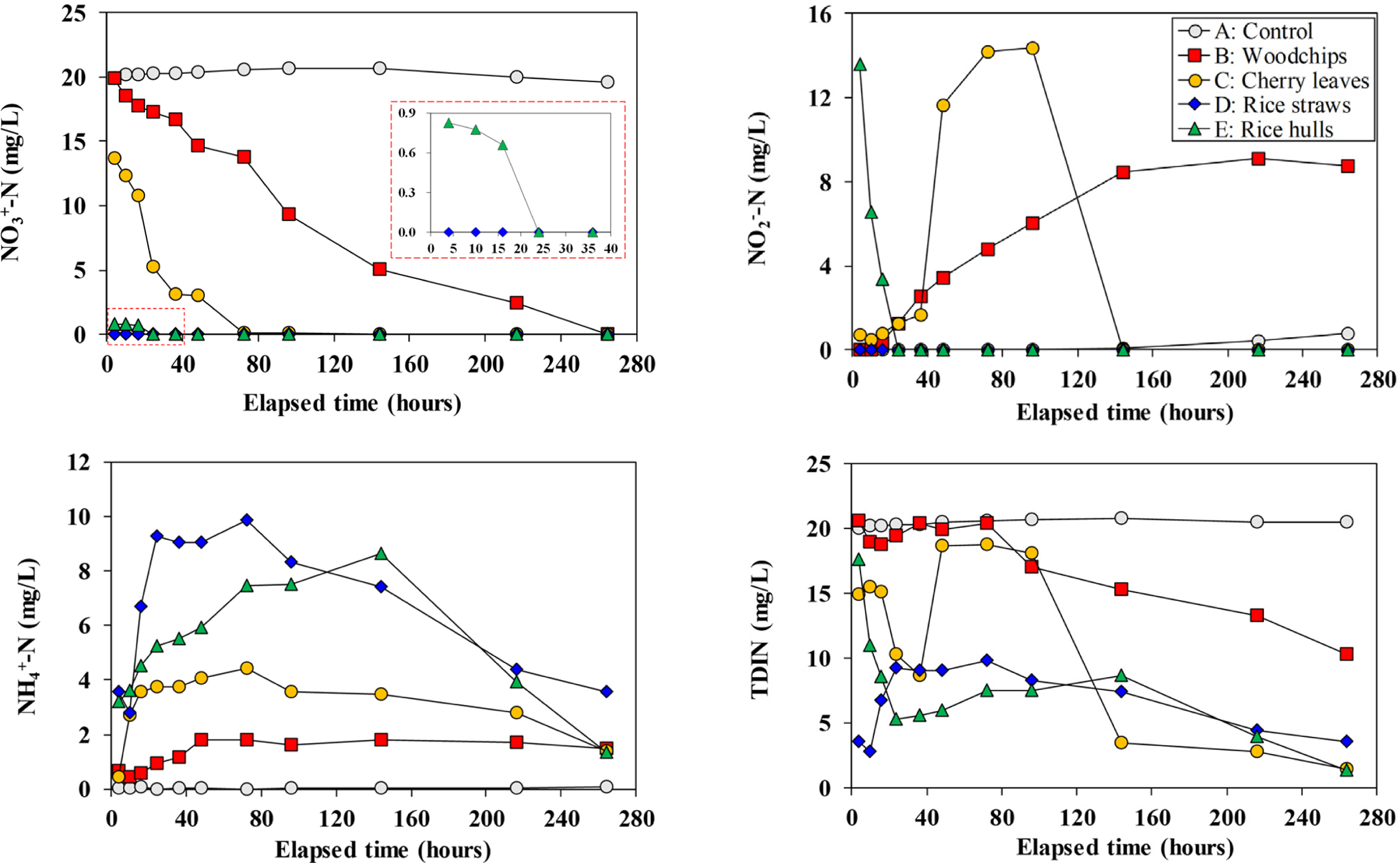
질산성질소는 약한 환원환경에서 쉽게 탈질, 제거되며 탈질과정 중 아질산성질소로 전환되었다가 최종적으로 질소(N2) 가스로 전환된다. 암모니아성질소는 유기물의 분해로 발생되기 때문에(Knowles, 1982), 암모니아성질소의 농도는 분해된 유기물의 양을 대략적으로 지시한다고 볼 수 있다. 그러나, 용존 암모니아성질소는 일반적인 pH 조건(<9)에서 대부분 양이온(NH4+)으로 존재하기 때문에 (-) 표면전하를 띠는 점토광물에 쉽게 흡착되며(Xie et al., 2017), 질산성질소와 반응하여 N2로 전환되는 ANAMMOX 과정에 의하여 제거되기도 한다(Mulder et al., 1995; van de Graaf et al., 1995).
볏짚을 이용한 실험(D)에서 질산성질소의 농도는 4시간 만에 검출한계 이하로 줄어듦으로써, 다른 재료들에 비해 빠른 제거 속도를 보였다(Fig. 4). 볏짚을 이용한 실험에서는 반응 4시간 시점에서 아질산성질소도 관찰되지 않았다. 왕겨를 이용한 실험(E)에서도 질산성질소는 16시간 만에 모두 제거되는 결과를 보였으나, 4시간 시점에서는 상당히 높은 아질산성질소 농도(13mg/L 이상)를 보였으며, 16시간 후에 완전히 제거됨으로써, 볏짚에 비해 상대적으로 느리게 탈질반응이 종료되었다.
볏짚과 왕겨 다음으로 빠른 탈질속도를 보인 재료는 벚나뭇잎(C)이었으며, 우드칩을 이용한 실험(B)에서는 관찰기간동안 질산염은 완전히 제거되었으나, 아질산염은 관찰종료시점에서도 상당히 높은 농도를 보였다. 벚나뭇잎(C)은 아질산염의 농도가 144시간 이후에 완전히 제거되었으며, 우드칩(B)은 본 실험의 마지막 관찰시점인 264시간 이후에도 여전히 남아있었다.
암모니아성질소의 시간별 농도변화 양상은 질산성질소의 저감양상과는 반대로 나타났다. 즉, 가장 빠른 탈질속도를 보인 볏짚을 이용한 실험(D)에서 암모니아성질소가 가장 급격히 증가하여 가장 높은 첨두농도(peak con- centration)를 보였고, 탈질속도가 느렸던 우드칩(B)은 가장 느리게 증가하여 가장 낮은 첨두농도를 보였다. 이렇게 증가된 암모니아성질소의 농도는 대부분의 실험에서 반응후반부로 갈수록 낮아지는 경향을 보였다. 질산성질소가 더 이상 존재하지 않은 반응 후반에 암모니아성질소의 농도가 감소되는 경향을 보인 것은 황산염의 환원에 의한 ANAMMOX 현상(Jin et al., 2013)과 관련이 있을 것으로 추측된다.
TDIN은 탈질과 유기물분해에 따른 암모니아성질소 발생으로 농도의 변동이 관찰되었으나, 전반적으로는 반응이 진행됨에 따라 감소되는 양상을 보였다.
대조군(A)은 관찰기간 내내 비교적 일정한 질산성질소농도를 보였으나, 200시간 이후부터 질산성질소의 농도가 미세하게 감소되고 아질산성질소의 농도도 미세하게 증가되는 양상을 보였다. 이는 대조군 반응조에도 미세하게 미생물반응이 일어나고 있으며, 이러한 현상은 대조군에 이용된 재료와 용기들을 완전히 멸균하지 않았던 것과 관련이 있는 것으로 판단된다.
3.3. 시간에 따른 반응조의 색 변화와 DOC 함량과의 관계
유기물이 포함된 모든 반응조는 용액의 색이 반응시간이 진행됨에 따라 진해지는 경향을 보였다(Fig. 5). 우드칩(B)과 왕겨(E)가 포함된 반응조의 용액은 밝은 색을 보였고, 벚나뭇잎(C)은 가장 어두운 색을 보였다. DOC 분석결과와 비교해볼 때, 용액 색의 밝고 어둡기가 용존된 유기물의 총량과는 직접적인 관련이 없어 보인다. DOC는 전체적으로 반응 초기에 매우 높았고, 이후 급격히 감소 후에 증가되었다가 반응시간이 진행될수록 서서히 감소되는 경향을 보였다(Fig. 6). 일반적으로 분자량이 작은 유기물(예, 펄빅산)들은 색이 밝은 반면, 분자량이 큰 유기물(예, 휴믹산)은 어두운 색을 띠는 것으로 알려져 있다(Gautam et al., 2021). 이러한 점과 DOC의 함량변화를 고려해 볼 때, 반응초반에는 주로 밝은 계통의 유기물이 용출되고, 이들은 이후 곧바로 분해되는 반면, 반응 후반에는 상대적으로 분해되기 힘들고 어두운 고분자 유기물이 농집되면서 용액의 색이 진해지는 것으로 판단된다.
3.4. 시간별 수질변화
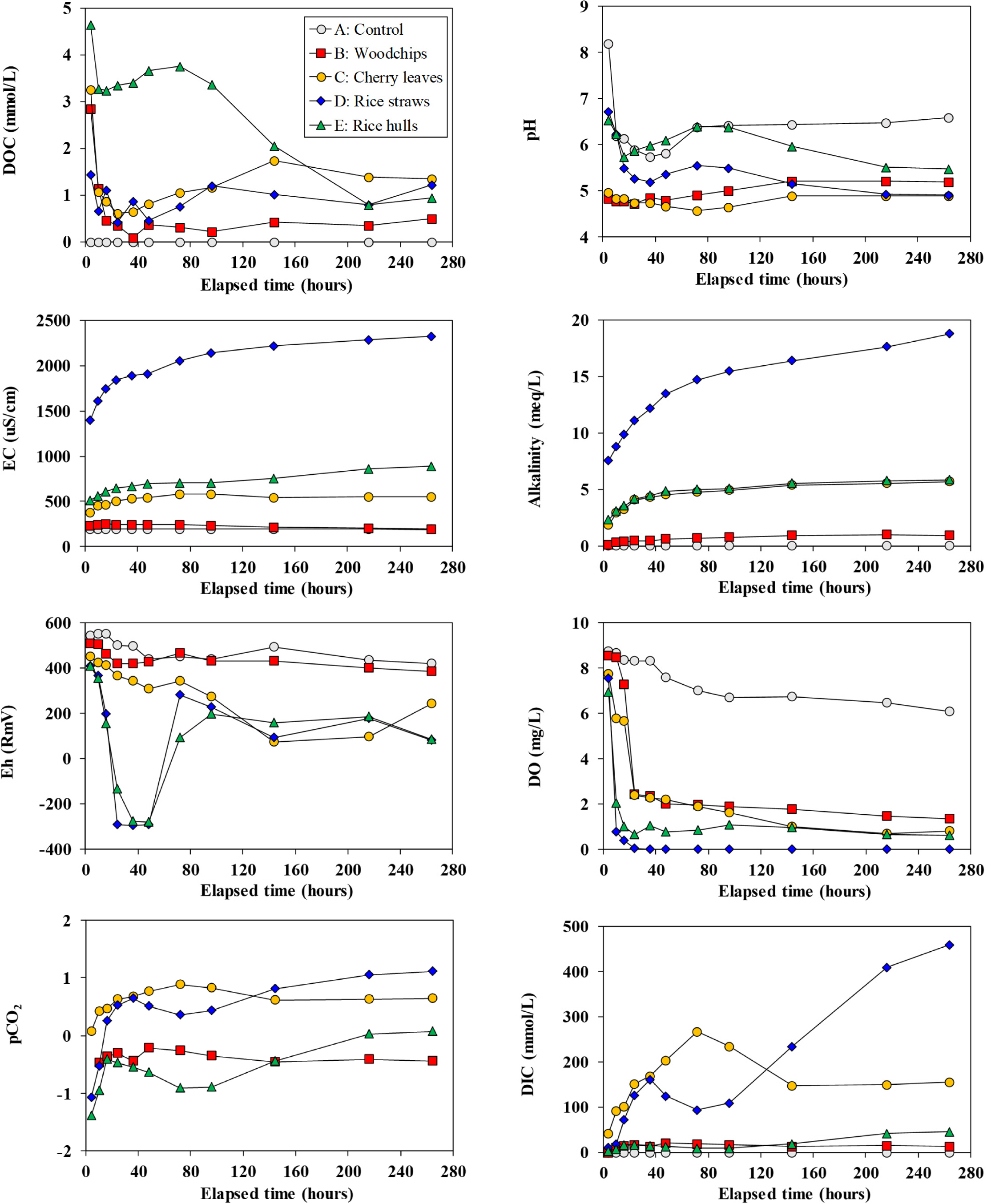
상대적으로 빠른 탈질속도를 보인 볏짚(D)과 왕겨(E)를 포함한 반응조들은 반응 초반에 가장 높은 pH 값(>6.5)을 보이다가 급격히 감소된 후 증가했다가 서서히 감소되는 양상을 보였다(Fig. 6). 반면, 느린 탈질속도를 보였던 우드칩(B)과 벚나뭇잎(C)을 포함한 반응조는 처음부터 5 이하의 낮은 pH 값을 보였고, 반응 후반부에서도 낮은 pH 값(우드칩 5.2 내외, 벚나뭇잎 4.8 내외)이 유지되었다. 대조군은 5.74~8.20로 비교적 높았다.
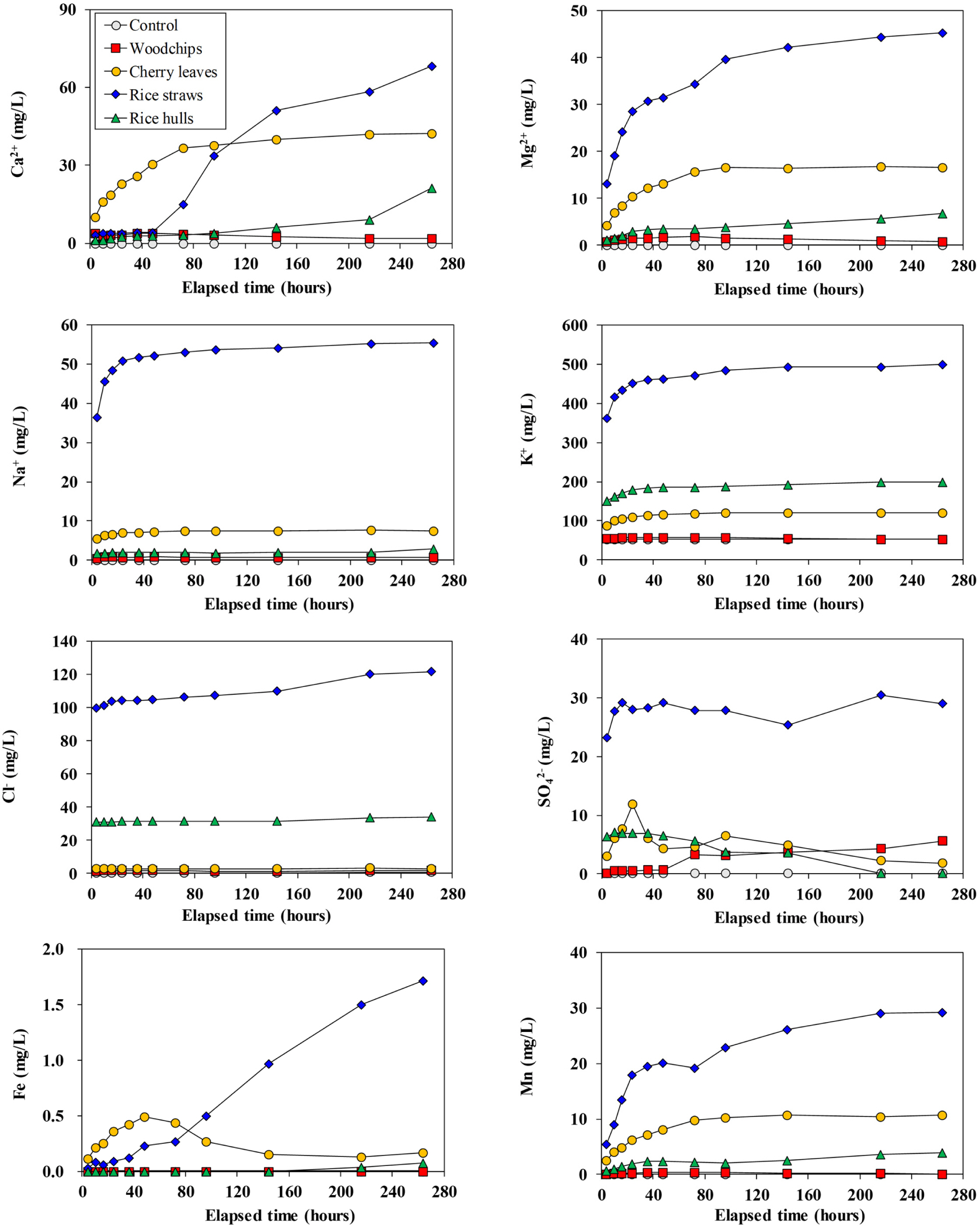
EC는 가장 빠른 탈질 속도를 보인 볏짚(D)에서 가장 빠르게 증가되었고, 반응시간 동안 타 재료들에 비하여 현격히 높은 값을 보였다. 볏짚(D)의 높은 EC는 마찬가지로 높았던 알칼리도 값과 비교할 때, 볏짚에 포함된 알칼리(토)금속 양이온(Ca2+, Mg2+, Na+, K+)들이 급격히 용출된 것과 관련이 있어 보인다(Figs. 6, 7). Alkalinity는 산성중화능력을 의미하며, 알칼리(토)금속 양이온의 농도가 높아질수록 값이 증가된다(Kim et al., 2018). 일반적으로 지하수에서는 알칼리(토)금속 양이온이 대수층을 구성하는 광물의 풍화에 의해 공급된다(Kim, 2003). 본 실험에서는 광물질이 재료로 사용하지 않았기 때문에, 농도가 증가된 알칼리(토)금속 양이온들은 모두 유기물재료 자체에서 공급되었다고 볼 수 있다.
볏짚을 포함한 반응조(D)에서는 이처럼 알칼리(토)금속 양이온의 용출이 왕성한 관계로 상대적으로 높은 pH를 보였던 것으로 판단된다(Figs. 6, 7). 두 번째로 빠른 탈질속도를 보인 왕겨(E)가 볏짚 다음으로 높은 EC값을 보였으나, 볏짚처럼 현저히 높지는 않았고, 벚나뭇잎을 이용한 실험(C)에서와 비슷한 수준이었다. 관찰된 각 반응조들의 EC 값들은 전반적으로 탈질속도가 빠를수록 높은 값을 보였다.
Eh는 볏짚(D)과 왕겨(E)를 포함한 반응조에서는 반응 초반부에 급격히 감소되는 양상을 보였고, 40hr 전후에서는 –300mV로 매우 낮은 값을 보인 다음, 다시 급상승하였다가 0~200mV 구간에서 변화되는 양상을 보였다(Fig. 6). DO는 모든 반응조에서 반응 초반에 급격히 감소되는 경향을 보였으며, 볏짚(D)에서는 30시간 이후에는 0.05mg/L 이하의 값을 보였다. 각 반응조 DO 값의 감소속도와 최종 안정농도는 탈질속도의 역순으로 관찰되었다(Fig. 6).
환원환경 하에 있는 대수층의 지하수는 대수층에 포함된 철, 망간 광물의 환원으로 인하여 매우 높은 철, 망간 농도를 보이는 경우가 흔하게 관찰된다(Kim et al., 2008; Ha et al., 2019). 이에 따라, 본 연구에서는 반응 진행에 따른 철, 망간의 농도변화를 같이 관찰하였다(Fig. 7). 볏짚을 이용한 실험(D)에서 철 농도는 반응 후반부에 가장 높은 농도로 증가된 양상을 보였으며, 벚나뭇잎을 이용한 실험(C)에서는 반응 초반에 다른 재료들을 이용한 실험에서보다 빠르게 증가되는 양상을 보이다가 후반부에는 감소되는 양상을 보였다. 반면, 망간은 볏짚을 이용한 실험(D)에서 가장 빠르게 용출되는 양상을 보였고, 가장 높은 농도가 반응시간 동안 유지되었다. 벚나뭇잎을 이용한 실험(C)에서는 볏짚을 이용한 실험 다음으로 높은 농도를 유지하였으며, 왕겨를 이용한 실험(E)에서도 망간의 먹는물기준치(0.3mg/L)를 초과하기는 하였으나, 벚나뭇잎을 이용한 실험보다는 매우 낮은 농도를 보였다. 반면, 우드칩을 이용한 실험(B)에서의 철, 망간 농도증가는 매우 미미하게 나타났다.
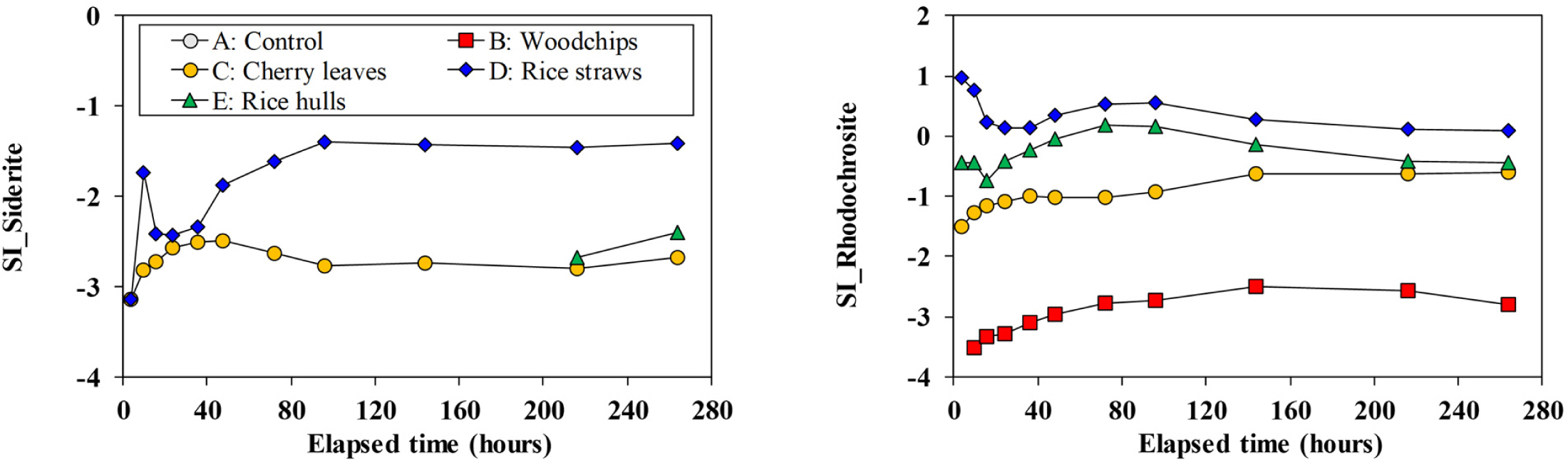
환원환경 하에 있는 지하수라고 해도 철, 망간의 농도가 끊임없이 증가하지는 않는다. 다양한 화학반응에 의해 이들의 농도가 결정되기 때문이다. 즉, 철 농도는 황화철의 침전과 능철석(siderite, FeCO3)의 침전에 의해서, 망간 농도는 능망간석(rhodochrosite, MnCO3)의 침전에 의하여 주로 결정된다(Appelo and Postma, 1993). 능철석에 대한 포화지수를 계산한 결과, 모든 물 시료는 능철석에 대하여 불포화되어 있었다(Fig. 8). 이는 본 실험에서는 능철석의 침전이 철 농도의 증가를 억제할 수 있는 역할을 하지는 못한 것을 의미한다.
벚나뭇잎 실험(C)에서는 반응 후반부에 황산염의 농도가 감소되는 양상을 보였고, 이는 황산염의 환원이 일어나고 있었음을 지시한다(Fig. 7). 이러한 상황을 고려할 때 반응 초반부에는 가장 빠른 철의 용출을 보였음에도 후반부에는 철 농도가 감소되는 양상을 보인 것은 황산염의 환원에 따른 황화철의 침전에 의한 것으로 판단된다. 반면, 볏짚 실험(D)에서는 반응 후반부에서도 철 농도가 지속적으로 증가되었고, 최종적으로는 가장 높은 농도를 보였다.
볏짚 실험(D)에서는 관찰기간 동안 비교적 일정한 황산염의 농도를 유지하였다. 그런데, 실험 D의 반응후반부 Eh 값은 황산염의 감소현상이 뚜렷했던 벚나뭇잎이나 왕겨와 비슷한 수준을 보였고, 아울러 황화수소 냄새도 강하게 방출하였다. 이로부터 판단할 때, 실험 D에서도 황산염의 환원이 일어나는 것으로 볼 수 있으며, 이러한 상황에서 황산염의 농도가 크게 줄어드는 것처럼 보이지 않는 것은 반응 후반부에서도 황산염의 용출이 황산염의 환원에 의한 저감분을 상쇄한 것이라고 판단된다. 황산염의 환원이 일어나는 상황에서도 실험 D에서 철 농도가 지속적으로 증가된 이유는 아직 확실하지 않다.
가장 높은 망간농도를 보였던 볏짚을 이용한 실험(D)에서는 반응 초반부에서부터 능망간석에 대하여 과포화상태를 보였다(Fig. 8). 그럼에도 불구하고 망간의 농도가 지속적으로 증가될 수 있었던 것은 유기물의 왕성한 분해로 발생되는 이산화탄소가 pH를 지속적으로 낮추어 주었기 때문으로 판단된다. 벚나뭇잎을 이용한 실험(C)에서는 능망간석에 대한 포화지수가 증가되기는 하였으나, 불포화상태를 유지하였으며, 바로 이러한 이유로 볏짚을 이용한 실험(D)만큼은 아니지만 비교적 높은 망간 농도를 보인 것으로 판단된다. 반면, 왕겨를 이용한 실험(E)에서는 실험 C보다 매우 낮은 망간 농도를 보였고, 이는 해당 실험에서는 비교적 높은 pH를 유지함으로써 용액들이 쉽게 능망간석에 대하여 포화상태에 이를 수 있었고, 이로 인하여 낮은 망간 농도가 유지되었던 것으로 판단된다.
3.5. 탈질 속도와 유기물의 분해속도
유기물이 분해되면 CO2 가스가 발생되고 이는 물에 녹아 CO2(aq)로 존재하거나, 물과 결합하여 H2CO3가 된다. 이는 pH가 높아짐에 따라 해리되어 HCO3-와 CO32-의 형태로 전환된다. 낮은 pH에서 용존된 이산화탄소는 보통 CO2(aq)로 존재하고 이산화탄소의 분압(pCO2)은 높아진다(Drever, 1997). CO2(aq), HCO3-, CO32- 등 용존된 이산화탄소 화학종을 모두 합한 것을 용존유기탄소(DIC)라고 한다. 본 연구에서는 다른 무기탄소의 공급원이 따로 없었기 때문에 DIC는 분해된 유기물의 양을 반영한다. 이로부터 판단할 때, 가장 높은 DIC 값을 보인 벚나뭇잎을 이용한 실험(C)과 볏짚을 이용한 실험(D)에서 가장 왕성한 유기물의 분해가 있었다고 할 수 있다(Fig. 6). DOC는 실험 E에서 반응 초반에 가장 높은 값을 보이고 이후 감소되는 양상을 보였으나, DIC는 상대적으로 작았다.
실험 C와 D에서는 시간이 지남에 따라 DIC가 감소되는 양상을 보이기도 하였다(Fig. 6). 이는 용존된 이산화탄소가 줄어들기도 하였음을 의미하는 것인데, 실험 C와 D의 pCO2 값이 0을 넘어섰던 점(즉, 분압이 1 기압을 넘어섬)을 고려하면 용존된 이산화탄소의 일부가 탈기되었음을 의미한다. 실험 C와 D 모두에서 매우 왕성한 유기물의 분해가 있었던 것은 명백한 것으로 판단된다. 그러나, 실험 C는 실험 D보다 현저하게 느린 탈질 속도를 보였다. 더구나, 실험 C의 탈질 속도는 상대적으로 매우 낮은 DIC 값을 보였던 실험 E에 비하여도 매우 느렸다. 이러한 결과는 분해된 유기물의 양이 탈질속도와는 직접적인 관련이 없음을 지시한다.
이러한 탈질의 속도차이는 분해가능한(또는 분해된) 유기물의 양보다는 탈질에 적합한 pH 조건을 유지하는 것과 더 관련이 있음을 지시한다. 일반적으로 탈질미생물은 pH 7.5~8.5 정도에서 가장 왕성한 활성을 보이는 것으로 알려져 있다(Claus and Kutzner, 1985; Imek and Cooper, 2002; Pan et al., 2012). 볏짚을 이용한 실험(D)과 왕겨를 이용한 실험(E)에서는 반응 초반(10 hr이내)에 6 이상의 pH 값을 보였던 것이 빠른 탈질을 유도하였던 것으로 판단된다.
벚나뭇잎을 이용한 실험(C)에서는 반응 초기에서부터 왕성한 유기물의 분해가 일어남으로써 다량의 CO2가 발생되었고, 이는 지나치게 낮은 pH(<5)유도하여 탈질이 상당부분 억제되었다. 더구나 벚나뭇잎은 본 연구에 이용된 재료들 중 가장 높은 알칼리(토)금속의 함량을 가지고 있었음에도(Fig. 3) 이들의 용출도 왕성하지 못하여 pH를 완충해주는 역할을 제대로 해주지 못한 것으로 판단된다. 반면, 볏짚을 이용한 실험(D)에서는 유기물의 분해가 왕성했음에도 볏짚이 분해되면서 다량의 알칼리(토)금속 양이온들이 같이 공급됨으로써(Fig. 7) 반응초반 pH가 지나치게 낮아지는 것을 막아줄 수 있었고, 이때 질산성질소의 탈질이 완료될 수 있었다.
왕겨를 이용한 실험(E)에서는 유기물의 분해가 실험 C, D에서 만큼 왕성하지는 않았지만, 바로 이 때문에 왕겨 자체에서 발생된 알칼리(토)금속 양이온이 pH를 완충시켜주는 역할을 적절하게 해줄 수 있게 된 것으로 보인다. 실제로 실험 E가 반응기간 동안 가장 높은 pH를 보였다(Fig. 6). 그러나, 실험 D와 E도 반응 후반부에는 지속적인 유기물 분해로 인하여 낮아진 pH 값을 보였고, 이로 인하여 질산성질소가 남아있었다면 이들의 탈질효율은 pH가 높았던 초기에 비하여 크게 저감되었을 것으로 예상된다. 우드칩을 이용한 실험에서는 유기물의 분해가 왕성하지 못하여 가장 적은 양의 CO2가 발생하였으나, 알칼리(토)금속의 용출도 매우 미미하여 매우 낮은 pH를 보였고, 이로 인하여 매우 느린 탈질효율을 보였다.
|
Fig. 3 Ca2+, Mg2+, Na+ , K+ , Fe, and Mn contents in the organic matters, which were measured using HNO3 digestion method. |
|
Fig. 4 Temporal variations of NO3-N, NO2-N, NH4-N, and TDIN (total dissolved inorganic nitrogen) during the reaction. |

|
Fig. 5 Changes of colors during the reaction (A: control, B: woodchips, C: cherry leaves, D: rice straws, E: rice hulls). |
|
Fig. 6 Variations of DOC, pH, EC, alkalinity, Eh, DO, pCO2, and DIC as a function of time. |
|
Fig. 7 Variations of dissolved species as a function of time. |
|
Fig. 8 Temporal variations of saturation indices for siderite and rhodochrosite during the reaction. No data for siderite saturation indices are the results of undetected Fe concentrations. |
|
Table 2 Simulated freshwater volume by SEAWAT for groundwater recharge scenarios |
본 연구에서는 다양한 농업부산물 재료들의 탈질 유용성을 실험을 통하여 평가하였다. 본 연구를 통하여 각 유기물 재료들의 탈질효과는 재료 자체의 분해용이성보다는 이들의 분해로 발생되는 CO2로 인한 pH 저하를 효율적으로 막아주는 것이 매우 중요함을 확인할 수 있었다. 본 연구에서 가장 높은 알칼리(토)금속함량을 가진 벚나뭇잎은 반응실험에서도 가장 왕성하게 분해되었으나, 이로 인하여 많은 CO2가 발생된 반면, 알칼리(토)금속의 용출은 지나친 pH 저하를 억제할 수 있을 만큼 많지도 않음으로써, 상당히 늦은 탈질속도를 보였다. 반면, 볏짚은 가장 빠른 탈질속도를 보였는데, 이는 반응 초반부터 자체에서 알칼리(토)금속이온들이 왕성하게 용출됨으로써, 왕성한 유기물 분해에도 불구하고 pH가 지나치게 낮아지는 것을 막아줄 수 있었음을 확인할 수 있었다. 이러한 결과들은 유기물재료를 이용한 탈질에서는 유기물 분해로 발생되는 CO2로 인한 pH 저하가 탈질효율을 좌우하는 인자임을 지시한다. 아울러, CO2 발생으로 인한 지나친 pH 저하를 막아줄 수 있도록 처리해 줄 수 있다면 작은 양의 유기물 분해만으로도 충분히 빠른 탈질효율을 얻어 낼 수 있음을 시사한다.
본 연구는 농림축산식품부 농업기반 및 재해대응기술개발 사업 '농업부산물을 이용한 농어촌형 저영향개발(LID) 기술 개발(과제번호 320052-3)' 과제의 연구비 지원에 의해 이루어졌습니다.
- 1. Appelo, C.A.J. and Postma, D., 1993, Geochemistry, Groundwater and Pollution. Rotterdam, Netherlands, A.A. Balkema.
- 2. Cameron, S.G. and Schipper, L.A., 2010, Nitrate removal and hydraulic performance of organic carbon for use in denitrification beds, Ecol. Eng., 36(11), 1588-1595.
-

- 3. Carmichael, P.A., 1994, Using Wood Chips as a Source of Organic Carbon in Denitrification: A Column Experiment and Field study Implementing the Funnel and gate Design, MS Thesis. Dept. of Earth Sci., University of Waterloo.
- 4. Chandler, J., 1989, Nitrate in water, Water Well Jour., 43, 45-47.
- 5. Claus, G. and Kutzner, H.J., 1985, Physiology and kinetics of autotrophic denitrification by Thiobacillus denitrificans, Appl. Microbiol. Biotechnol., 22, 283-288.
-

- 6. Comly, H.H., 1945, Cyanosis in infants caused by nitrates in well water, JAMA., 129(2), 112-116.
-

- 7. Drever, J.I., 1997, The Geochemistry of Natural Waters. Prentice Hall, Englewood Cliffs, New Jersey.
- 8. Fennessy, M.S. and Cronk, J.K., 1997, The effectiveness and restoration potential of riparian ecotones for the management of nonpoint source pollution, particularly nitrate, Crit. Rev. Environ. Sci. Technol., 27, 285-317.
-

- 9. Gautam, R.K., Navaratna, D., Muthukumaran, S., Singh, A., Islamuddin, and More, N., 2021, Humic Substances: Its Toxicology, Chemistry and Biology Associated with Soil, Plants and Environment, In A. Makan (Ed.), Humic Substance.
- 10. Gibert, O., Pomierny, S., Rowe, I., and Kalin, R.M., 2008, Selection of organic substrates as potential reactive materials for use in a denitrification permeable reactive barrier (PRB), Bioresour. Technol., 99(16), 7587-7596.
-

- 11. Greenan, C.M., Moorman, T.B., Parkin T.B., Kaspar, T.C., and Jaynes, D.B., 2009, Denitrification in wood chip bioreactors at different water flows, J. Environ. Qual., 38(4), 1664-1671.
- 12. Guadagnini, L. and Tonelli, D., 2013, Carbon electrodes unmodified and decorated with silver nanoparticles for the determination of nitrite, nitrate and iodate, Sens. Actuators B Chem., 188, 806-814.
-

- 13. Ha, Q.K., Choi, S.H., Phan, N.L., Kim, K., Phan, C.N., Nguyen, V.K., and Ko, K.S., 2019, Occurrence of metal-rich acidic groundwaters around the Mekong Delta (Vietnam): A phenomenon linked to well installation, Sci. Total Environ., 654, 1100-1109.
-

- 14. Healy, M.G., Rodgers, M., and Mulqueen, J., 2006, Denitrification of a nitrate-Rich synthetic wastewater using various wood-based media materials, J. Environ. Sci. Health-Toxic/Hazard. Subst. Environ. Eng., 41(5), 779-788.
-

- 15. Hosoya, T., Kawamoto, H., and Saka, S., 2007, Cellulose–hemicellulose and cellulose–lignin interactions in wood pyrolysis at gasification temperature, J. Anal. Appl. Pyrolysis, 80(1), 118-125.
-

- 16. Jeon, S.R., Park, S.J., Kim, H.S., Jung, S.K., Lee, Y.U., and Chung, J.I, 2011, Hydrogeochemical characteristics and estimation of nitrate contamination sources of groundwater in the Sunchang area, Korea, J. Geol. Soc. Korea, 47(2), 185-197.
- 17. Jin, R.C., Yang, G.F., Zhang, Q.Q., Ma, C., Yu, J.J., and Xing, B.S., 2013, The effect of sulfide inhibition on the ANAMMOX process. Water Res., 47(3), 1459-1469.
-

- 18. Kim, H., Seagren, E.A., and Davis, A.P., 2003, Engineered bioretention for removal of nitrate from stormwater runoff, Water Environment Research, 75(4), 355-367.
-

- 19. Kim, K., 2003, Long term disturbance of groundwater chemistry following well installation, Ground Water, 41(6), 780-789.
-

- 20. Kim, K., Hamm, S.Y., Kim, H.R., and Kim, H., 2018, A review on alkalinity analysis methods suitable for Korean groundwater, Econ. Environ. Geol., 51(6), 509-520.
- 21. Kim, K., Kim, H.J., Choi, B.Y., Kim, S.H., Park, K.H., Park, E., Koh, D.C., and Yun, S.T., 2008, Fe and Mn levels regulated by agricultural activities in alluvial groundwaters underneath a flooded paddy field, J. Appl. Geochem., 23(1), 44-57.
-

- 22. Kim, K., Lee, J.W., Choi, S.H., Kim, S.H., Kim, H., Hamm, S.Y., and Kim, R.H., 2019, Alkalinity measurement of groundwater using gran titration method, J. Soil Groundwater Environ., 24(1), 10-16.
-

- 23. Kim, Y.T. and Woo, N.C., 2003, Nitrate contamination of shallow groundwater in an agricultural area having intensive livestock facilities, J. Soil Groundwater Environ., 8(1), 57-67.
- 24. Knowles, R., 1982, Denitrification, Microbial. Rev., 46, 43-70.
- 25. Koenig, A. and Liu, L.H., 1996, Autotrophic denitrification of landfill leachate using elemental sulphur, Water Sci. Technol., 34(5-6), 469-476.
-

- 26. Kumar, P., Barrett, D.M., Delwiche, M.J., and Stroeve, P., 2009, Methods for pretreatment of lignocellulosic biomass for efficient hydrolysis and biofuel production, Ind. Eng. Chem. Res., 48(8), 3713-3729.
-

- 27. Lee, D., Lee, I., Choi, Y., and Bae, J., 2001, Effects of external carbon source and empty bed contact time on simultaneous heterotrophic and sulfur-utilizing autotrophic denitrification, Proc. Biochem., 36(12), 1215-1224.
-

- 28. Lee, E.J., Woo, N.C., Lee, B.S., and Kim, Y.B., 2008, Variation in nitrate contamination of shallow groundwater in a farmland in Gyeonggi-do, Korea, Econ. Environ. Geol., 41(4), 393-403.
- 29. Lee, K., Lee, B.S., Shin, D., Choi, Y., and Nam, K., 2013, Enhancement of denitrification capacity of pseudomonas sp. KY1 through the optimization of C/N ratio of liquid molasses and nitrate, J. Kor. Soc. Environ. Eng., 35(9), 654-659.
-

- 30. Min, J.H., Yun, S.T., Kim, K., Kim, H.S., and Kim, D.J., 2003, Geologic controls on the chemical behaviour of nitrate in riverside alluvial aquifers, Korea, Hydrol. Process, 17(6), 1197-1211.
-

- 31. Ministry of Environment, 2020, National Ground Water Monitoring Network In Korea Annual Report.
- 32. Monteith, H.D., Bridle, T.R., and Sutton, P.M., 1980, Industrial waste carbon sources for biological denitrification, Prog. Water Technol., 12, 127-141.
-

- 33. Mulder, A., van de Graaf, A.A., Robertson. L.A., and Kuenen, J.G., 1995, Anaerobic ammonium oxidation discovered in a denitrifying fluidized-bed reactor, FEMS Microbiol. Ecol., 16(3), 177-183.
-

- 34. Pan, Y., Ye, L., Ni, B.J., and Yuan, Z., 2012, Effect of pH on N2O reduction and accumulation during denitrification by methanol utilizing denitrifiers, Water Res., 46(15), 4832-4840.
-

- 35. Parkhurst, D.L. and Appelo, C.A.J., 1999, User¡¯s guide to PHREEQC (version 2) - a computer program for speciation, batch-reaction, one-dimensional transport, and inverse geochemical calculations, USGS Water-Resources Investigations Report 99-4259.
- 36. Partheeban, C., Kjaersgaard, J., Hay, C., and Trooien, T., 2014, A Review of the factors controlling the performance of denitrifying woodchip bioreactors, ASABE, SD14-029.
- 37. Schipper, L.A. and Vojvodić-Vuković, M., 2000, Nitrate removal from groundwater and denitrification rates in a porous treatment wall amended with sawdust. Ecol. Eng., 14(3), 269-278.
-

- 38. Schipper, L.A., Robertson, W.D., Gold, A.J., Jaynes, D.B., and Cameron, S.C., 2010, Denitrifying bioreactors-An approach for reducing nitrate loads to receiving waters, Ecol. Eng., 36(11), 1532-1543.
-

- 39. Shao, L., Xu, Z.X., Jin, W., and Yin, H.L., 2009, Rice husk as carbon source and biofilm carrier for water denitrification, Polish J. of Environ. Stud., 18(4), 693-699.
- 40. ŠImek, M. and Cooper, J.E., 2002, The influence of soil pH on denitrification: progress towards the understanding of this interaction over the last 50 years, Eur. J. Soil Sci., 53(3), 345-354.
-

- 41. Skrinde, J.R. and Bhagat, S.K., 1982, Industrial wastes as carbon sources in biological denitrification, J. Water Pollut. Control Fed., 54(4), 370-377.
- 42. Smyk, J. and Ignatowicz, K., 2017, The influence of molasses on nitrogen removal in wastewater treatment with activated sludge, Ecol. Eng., 18(4), 199-203.
- 43. Soares, M.I.M. and Abeliovich, A., 1998, Wheat straw as a substrate for water denitrification, Water Res., 32(12), 3790-3794.
-

- 44. Straub, K.L., Benz, M., and Schink, B., 1996, Anaerobic, nitrate-dependent microbial oxidation of ferrous iron, Appl. Environ. Microbiol., 62(4), 1458-1460.
-

- 45. Suh, D., Kang, C., Kim, W., Choe, J., 2017, A Study on Efficient Recycling of Agricultural and Livestock Wastes as Resources (Year 2 of 2).
- 46. Till, B.A., Weathers, L.J., and Alvarez, P.J., 1998, Fe(0)-supported autotrophic denitrification, Environ. Sci. Technol., 32(5), 634-639.
-

- 47. Van de Graaf, A.A., Mulder, A., De Bruijn, P., Jetten, M.S.M., Robertson, L.A., and Kuenen, J.G., 1995, Anaerobic oxidation of ammonium is a biologically mediated process, Appl. Environ. Microbiol., 61, 1246-1251.
-

- 48. Vogan, J.L., 1993, The use of Emplaced Denitrifying Layers to Promote Nitrate Removal from Septic Effluent, MS Thesis. Dept. of Earth Sci., University of Waterloo.
- 49. Xie, H., Wang, S., Qiu, Z., and Jiang, J., 2017, Adsorption of NH4+-N on Chinese loess: Non-equilibrium and equilibrium investigations, J. Environ. Manage., 202(1), 46-54.
-

 This Article
This Article
-
2021; 26(6): 82-94
Published on Dec 31, 2021
- 10.7857/JSGE.2021.26.6.082
- Received on Nov 28, 2021
- Revised on Dec 6, 2021
- Accepted on Dec 13, 2021
 Services
Services
Shared
 Correspondence to
Correspondence to
- Kangjoo Kim
-
Department of Environmental Engineering, Kunsan National University
- E-mail: kangjoo@kunsan.ac.kr






