- Mechanistic Study of FeS Reacted with Arsenate under Various pH Conditions
Han Young-Soo1*·Lee Mu Yeol1·Seong Hye Jin2
1Department of Environmental Engineering, Chungnam National University, Daejeon 34134 Korea
2Research and Development Center, CITYLABS Co., Ltd, Gyeonggi-Do 13911, Korea- FeS 수용액 내 pH에 따른 5가비소의 반응 메커니즘 연구
한영수1*·이무열1·성혜진2
1충남대학교 환경공학부
2주식회사 시티랩스 기술연구소This article is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Mackinawite (FeS), as a ubiquitous reduced iron mineral, is known as a key controller of redox reactions in anaerobic subsurface environment. The reaction of FeS with redox-sensitive toxic element such as arsenic is substantially affected by pH conditions of the given environments. In this study, the interaction of As(V) with FeS was studied under strict anaerobic conditions with various pH conditions. The pH-dependent arsenic removal tests were conducted under wide ranges of pH conditions and X-ray absorption spectroscopy (XAS) was applied to investigate the reaction mechanisms under pH 5, 7, and 9. The removal efficiency of FeS for As(V) showed the higher removal of As(V) under low pH conditions and its removal efficiency decreased with increasing pH, and no As(V) reduction was observed in 1 g/L FeS solution. However, XAS analysis indicated the reduction of As(V) to As(III) occurred during reaction between FeS and As(V). The reduced form of As(III) was particularly identified as an arsenic sulfide mineral (As2S3) in all pH conditions (pH 5, 7, and 9). As2S3 precipitation was more pronounced in pH 5 where the solubility of FeS is higher than in other pH conditions. The linear combination fitting results of XAS demonstrated that As(V) removal mechanism is concerted processes of As2S3 precipitation and surface complexation of both arsenic species..
Keywords: Mackinawite, Arsenic, X-ray absorption spectroscopy
자연계의 지중환경에는 다양한 산화환원 조건이 존재하는데, 특히 철, 황 및 망간 등의 주요 지구구성 원소들은 산화환원 조건에 민감하게 그 화학종이 달라지며, 그러한 화학종의 구성은 지중환경에 존재하는 다양한 종류의 오염물질의 거동에 영향을 미친다(Borch et al., 2010). 특별히 산화환원 조건에 따라 다른 종류의 화학종으로 변화하며 존재하는 비소, 안티모니, 크롬 등의 거동과 독성 영향에는 토양 내에 존재하는 산화성 광물 혹은 환원성 광물과의 반응이 중요한 역할을 한다(Park et al., 2018, Shaheen et al., 2014). 특히 지질학적인 원인 및 인위적인 오염원에 의해 토양 및 지하수 환경에서 인간 및 생태계의 건강성에 중요한 영향을 미치는 비소는 환원환경에서 주로 As(III), 산화환경에서 주로 As(V)의 형태로 존재한다고 알려져 있다. 그러나 토양의 산화환원 상태는 토양의 습윤상태 및 유기물 오염 등 다양한 요인에 의해 주기적으로 변화하며 이에 따라 산화환경에서 존재하던 As(V)가 환원환경에 노출되기도 하고, 반대의 경우가 발생하기도 한다. 그러므로 산화환경에서 As(V)의 반응거동 뿐만 아니라 환원환경에서 As(V)의 반응 거동 역시 토양환경 내에서 비소의 거동을 이해하는데 중요한 시나리오의 하나가 될 수 있다.
황화철(mackinawite, FeS)은 환원성 지중환경에서 광범위하게 존재하는 철광물로써 2가철과 황화이온이 반응하여 침전된 검은색의 광물이다. FeS는 다른 종류의 철광물에 비하여 결정도가 낮고 입자크기가 나노미터 수준의 작은 크기로 존재하므로 반응성이 큰 광물이다. 특히 FeS와 비소의 반응은 pH, 이온세기, 경쟁이온 작용, 산화환원 조건 변화 등을 변수로 하여 다양한 연구가 수행되어왔다(Farquhar et al., 2002; Han et al., 2015). 특별히 그러한 연구들은 As(III)에 대하여 집중적으로 수행되었는데, 이는 As(III)가 As(V)에 비하여 독성이 높고 이동성이 높기 때문이며, FeS가 존재하는 환원성 환경에서는 환원된 형태의 As(III)가 존재할 개연성이 높다는 예측 때문이다. As(III)는 낮은 pH에서 FeS이 용해에 따른 황화비소(orpiment, As2S3)의 형태로 제거될 수 있으며, 높은 pH 조건에서는 surface complexation에 의한 흡착/공침 등의 형태로 제거된다고 보고되었다(Gallegos et al., 2008; Han et al., 2011). 그러나 환원환경에서 비소는 As(V)의 형태로도 존재할 수 있으며, As(V)의 FeS와의 반응기작을 이해하는 것은 산화환원 환경이 변화할 수 있는 지중 환경에서 비소의 거동을 이해하기 위해 필요하다.
본 연구에서는 FeS 현탁액에서 As(V)의 제거효율을 pH 조건에 따라 시험하였으며, 산성, 중성, 염기성을 대표하는 pH 조건으로서 pH 5, 7, 9에서 As(V)-FeS 간의 반응기작을 방사광가속기 X-ray absorption spectroscopy (XAS)를 이용하여 해석하였다. 본 연구의 결과는 환원성 지중환경 내에 유입된 산화된 형태의 As(V)의 토양 환경 내 거동을 이해하기 위한 반응 메커니즘을 제공하는 기초자료로 활용될 수 있을 것이다.
2.1. FeS의 합성
본 연구에서 사용한 FeS의 합성은 2.0 L의 0.57 M FeCl2용액과 1.2 L의 1.1 M Na2S용액을 4%의 H2/95% N2의 내부공기로 조절된 글러브박스 안에서 합성을 진행하였다(Butler and Hayes, 1998). 두 물질이 혼합되자 검은색의 입자가 작은 FeS 현탁액을 얻을 수 있었다. 3일간 FeS를 교반하고 원심분리를 통하여 입자를 침전시킨 후 침전된 입자를 증류수로 세척하여 원심분리하는 방식으로 염과 잉여의 황화이온을 제거하는 작업을 5회 진행하였다. 세척 후 얻은 FeS는 동결건조기를 이용하여 건조시켜 파우더형태의 FeS를 얻었으며, 산소와의 접촉이 없는 글러브 박스 내에 질소 퍼징한 gas-tight 용기 내에 보관하며 필요에 따라 사용하였다.
2.2. 배치실험
모든 배치실험은 산소가 제거된 초순수를 이용하여 혐기성 글러브박스 내부에서 수행하였으며, 산소와의 접촉은 실험의 모든 과정에서 철저하게 배제되었다. As(V) stock solution은 HAsNa2O47H2O(sodium arsenate dibasic heptahydrate) 10,000 mg As/L의 농도로 제조하여 목적하는 농도로 희석하여 사용하였다. As(V)의 pH 조건별 FeS에 의한 제거효율을 알아보기 위해, pH 3에서 12 사이로 pH를 조정한 1 g/L FeS의 용액에 As(V)의 비소 stock solution을 50 mg As/L의 농도가 되도록 투입하여 반응시켰다. 준비된 시료는 수직교반기을 이용하여 3일(72시간) 반응시켰다. 3일간 반응된 시료의 반을 0.1 μm 나일론 필터를 사용하여 여과하고 묽은 HNO3 용액을 이용하여 희석한 후 Inductively coupled plasma-optical emission spectrometer(ICP-OES, Ultima 2, Horiba)를 사용하여 총 비소의 농도를 측정하였다. 나머지 반절의 시료는 용액상 비소의 화학종을 분석하는 데 사용하였는데, 화학종 분석은 Bond Elut C18 카트리지(Agilent Tech- nology)를 사용하여 As(III)와 As(V)의 농도를 분리하여 측정하였다. Bond Elut C18 카트리지는 메탄올 2 mL, 물 2 mL를 사용하여 전처리하였다. 적당량의 측정 샘플과 1% Ammonium pyrrolidine dithiocarbamate 1 mL 용액을 넣고 pH 5.5 acetate buffer 용액을 희석액으로 하여 혼합한 샘플용액을 카트리지를 통과시키면 무극성의 As(III)는 카트리지에 남고, 극성인 As(V)는 통과하는 기작으로 As(III)와 As(V)를 분리한다. 카트리지를 통과한 As(V) 용액의 농도를 ICP-OES를 사용하여 측정한 뒤, 앞서 분석한 총 농도에서 측정된 As(V)이 농도를 차감하여 As(III)의 농도를 계산하였다.
2.3. 분광학적 실험
배치실험 후 FeS와 반응대상 원소의 반응 메커니즘을 알아보기 위하여 분광학적 분석을 위한 시료를 5 g/L FeS와 1 g/L As(V) 혼합 현탁액을 이용하여 세가지 pH 조건인 pH 5, 7, 9에서 3일간 반응시킨 후, 필터링하여 고체상의 시료를 준비하였다. 현탁액의 pH를 조정하기 위한 버퍼용액으로 pH 5 0.1N sodium acetate, pH 7의 0.1N 3-(N-morpholino)propanesulfonic acid(MOPS) 및 pH 9의 0.1N N-cyclohexyl-2-aminoethanesulfonic acid(CHES)를 사용하였다. As(V)과 3일 동안 반응시킨 FeS 현탁액은 필터링하여 고액상을 분리한 후 혐기조건의 글로브박스 내부에서 건조시킨 뒤 분광학적 분석을 위한 시료로 사용하였으며, 실험 시작 전까지 질소로 퍼징한 gas-tight 용기 내에 보관하여 산소와의 접촉을 배제하였다.
제조된 샘플은 혐기성 글러브박스 내부에서 Kapton테이프 사이에 고정되어 포항가속기 연구소에서 분석하였다. As K-edge X-ray absorption fine structure(XAFS)분석을 위하여 8C-나노 엑스선 흡수 분광 빔라인을 사용하였으며, 작업하는 동안 샘플이 산소와 접촉하는 것을 방지하기 위하여 샘플을 넣은 챔버를 헬륨가스로 퍼징하면서 작업하였다. 에너지 값 보정을 위한 레퍼런스 물질로는 As(0)-파우더(11865.8 eV)를 사용하였다. 이때 사용한 As(0)의 edge 값은 Au-foil L3-edge(11919 eV)를 기준으로 보정된 값으로 일반적인 문헌의 값인 11867 eV와 약간의 차이가 있음을 명시하는 바이다. 분석의 비교 기준이 되는 모델컴파운드로 As(III), As(V) 수용액과 As(0), As2S3 파우더를 사용하였으며, Athena 소프트웨어를 활용하여 XAS데이터 피팅 분석을 진행하였다(Ravel and Newville, 2005). 본 연구에 사용한 XAS 실험결과는 방사광가속기의 강한 X-ray 빔에 의하여 비소의 화학종이 변화하는 현상을 리포트한 실험결과에 일부 사용되었으며 재해석하여 본 논문에 게재하였음을 밝혀둔다(Han et al., 2018a).
3.1. pH 조건 별 비소제거 배치실험
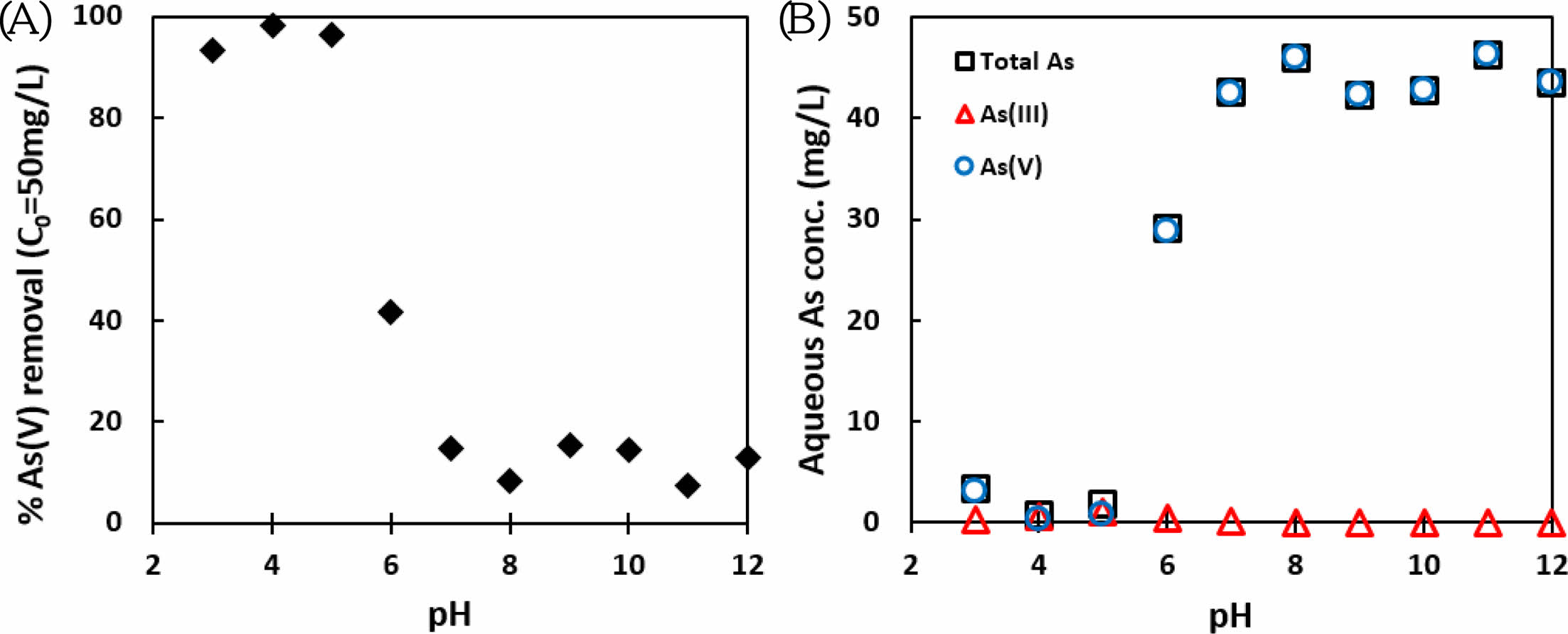
FeS 현탁액의 pH 조건에 따른 As(V)의 제거효율을 알아보기 위해 pH 3-12 사이의 범위에서 1 g/L FeS 용액에 주입한 50 mg/L As(V)에 대한 반응 후 비소의 제거효율을 측정하고 용액에서 제거되지 않고 남은 용액 상의 비소 화학종의 농도를 측정하여 Fig. 1(A)와 (B)에 나타내었다. 용액 내에 주입한 As(V)는 pH 5 이하의 산성 pH에서는 100%에 가까운 매우 높은 제거효율을 나타냈다. 그러나 FeS 용액의 pH가 6 이상으로 증가함에 따라 비소의 제거 효율은 감소하여 pH 7 이상에서는 20% 이하의 낮은 값을 나타냈다. 이러한 결과는 본 연구팀의 이전 연구를 통해 시험한 As(III)의 FeS 용액 내에서의 제거효율에 비교하였을 때, 상당히 낮은 효율임을 알 수 있다(Han et al., 2018b). Han et al.(2018b)의 연구에서는 유사한 pH 조건별 배치실험에서 본 연구에서 적용한 초기 비소 농도보다 3배 높은 150 mg/L의 As(III) 용액에 대한 실험을 수행하였으며, 유사한 pH 조건 별 제거 효율의 차이를 확인하였으나, 염기성 pH 범위에서 본 실험에 비교하면 비교적 높은 값인 30 mg/L 이상의 비소가 FeS와 반응하여 제거되었다. 이를 통해 FeS 표면에서 비소의 반응은 As(III)보다 As(V)의 경우 제거율이 낮음을 알 수 있다. 그 뿐만 아니라 As(V)로 주입한 초기 비소의 화학종은 용액상에서 전량 As(V)로 남아있음을 확인할 수 있다. 따라서 FeS 용액에 의한 As(V)의 환원은 일어나지 않았거나, 혹은 환원된 As(III)는 빠른 시간 내에 고체상 FeS와 어떤 종류의 반응이 일어나 용액 상에서 제거된 것으로 예상할 수 있다. 두 가지 가정 중 어떠한 반응이 본 배치시스템을 잘 설명하는가에 대한 고찰은 분광학적 방법을 이용한 X-ray absorption fine structure(XAFS) 분석을 통하여 알아볼 수 있다.
3.2. 분광학적 실험 결과: XANES 영역
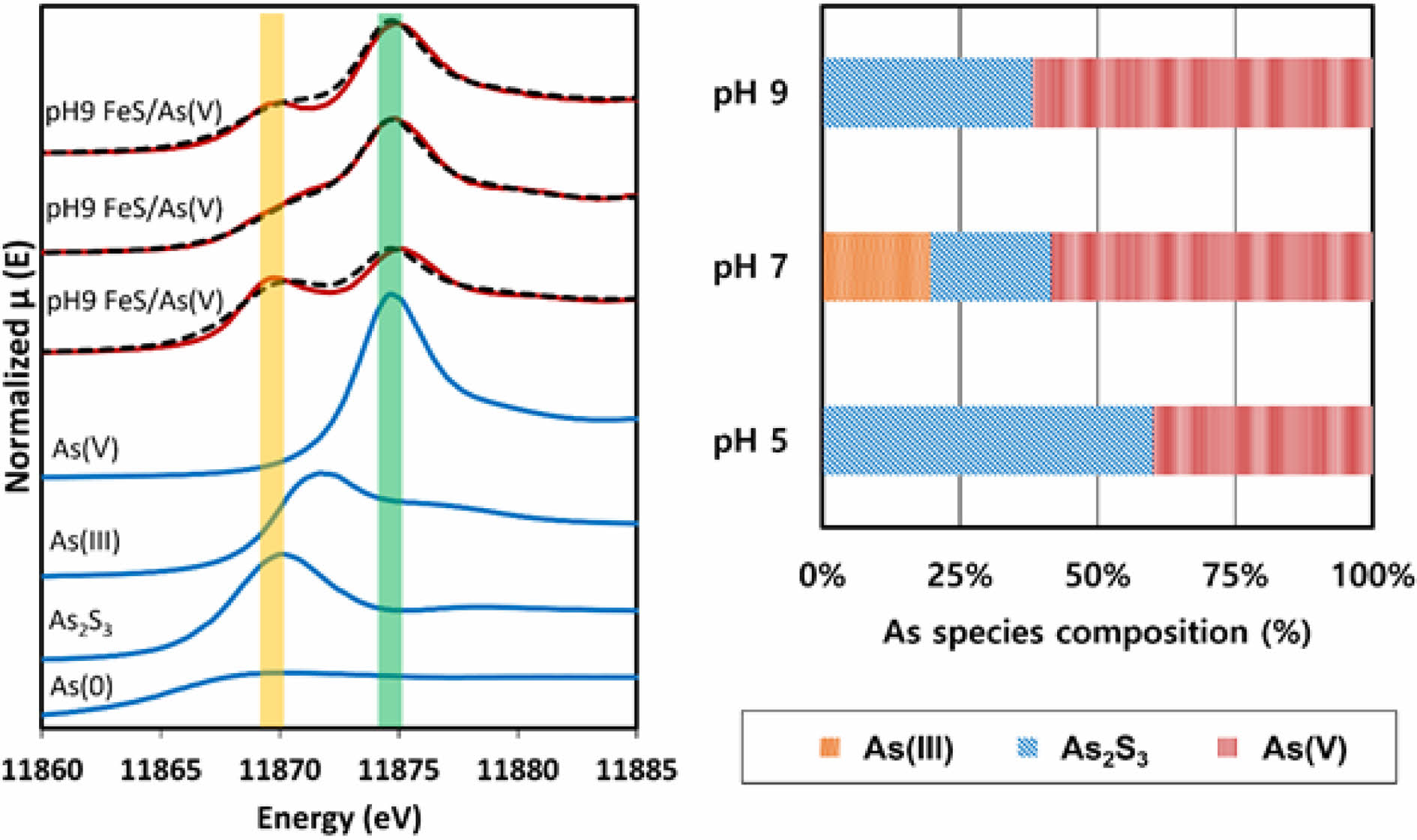
Fig. 2는 As K-edge X-ray absorption near-edge struc- ture(XANES)결과를 모델 화합물의 edge energy 값과 비교하여 나타낸 결과이다. XANES 영역의 흡수 edge-energy 비교를 통하여 비소의 산화환원 상태 혹은 황화광물로의 침전 여부를 알 수 있다. 또한 얻어진 XANES 영역의 결과를 As(V) 용액, As(III) 용액, As2S3 및 As(0) (영가비소)의 결과와 비교하여 linear combination fitting (LCF)를 수행하면 각 화학종의 분율로 샘플의 구성 비율을 피팅 할 수 있다. 이러한 LCF 방법은 물리화학적 성질의 고려 없이 피크의 모양을 맞추어 구성요소의 비율을 구하는 방법으로 절대적인 결과라고 보기는 어려우나, 합리적인 표준물질의 선정을 통하여 비교적 정확한 화학종의 혼합비를 제공할 수 있는 방법으로 용인되어왔다. LCF 결과에 따르면 고체상에 존재하는 비소의 화학종은 pH 5에서는 60% 이상이 As2S3로 나타나 황화비소의 침전이 활발하게 일어난 것으로 확인되다. As2S3는 As(III)가 황화이온(sulfide ion)과 결합한 형태의 광물질로 As2S3의 침전은 침전 이전에 As(V)의 환원반응이 일어났다는 사실을 지시한다(Gallegos et al., 2008). 분광학적 실험을 위한 샘플은 Fig. 1(A)의 경우에 비하여 매우 높은 농도의 As(V) 농도(As:FeS의 비율이 약 4배 높음)로 적용되어 FeS의 환원력이 비소 전체를 모두 As(III)로 환원시키지 못한 것으로 보인다(Han et al., 2018b). 이에 따라 환원되지 않고 남은 As(V)는 FeS 표면에 흡착되어 존재하는 것으로 예상된다. 침전된 As2S3의 양은 pH가 증가함에 따라 다소 감소하는 경향을 보이는데 이는 FeS의 용해성이 pH의 증가에 따라 감소하기 때문일 것으로 사료된다. 특이한 점은 pH 7에서는 pH 5와 pH 9에서와 달리 As(III)의 화학종이 약 20% 정도 존재하는 것으로 예측되었는데, pH 7에서 다른 제거 기작이 나타나는 원인에 대하여는 추가적인 연구가 필요할 것으로 생각된다.
3.2. 분광학적 실험 결과: EXAFS 영역
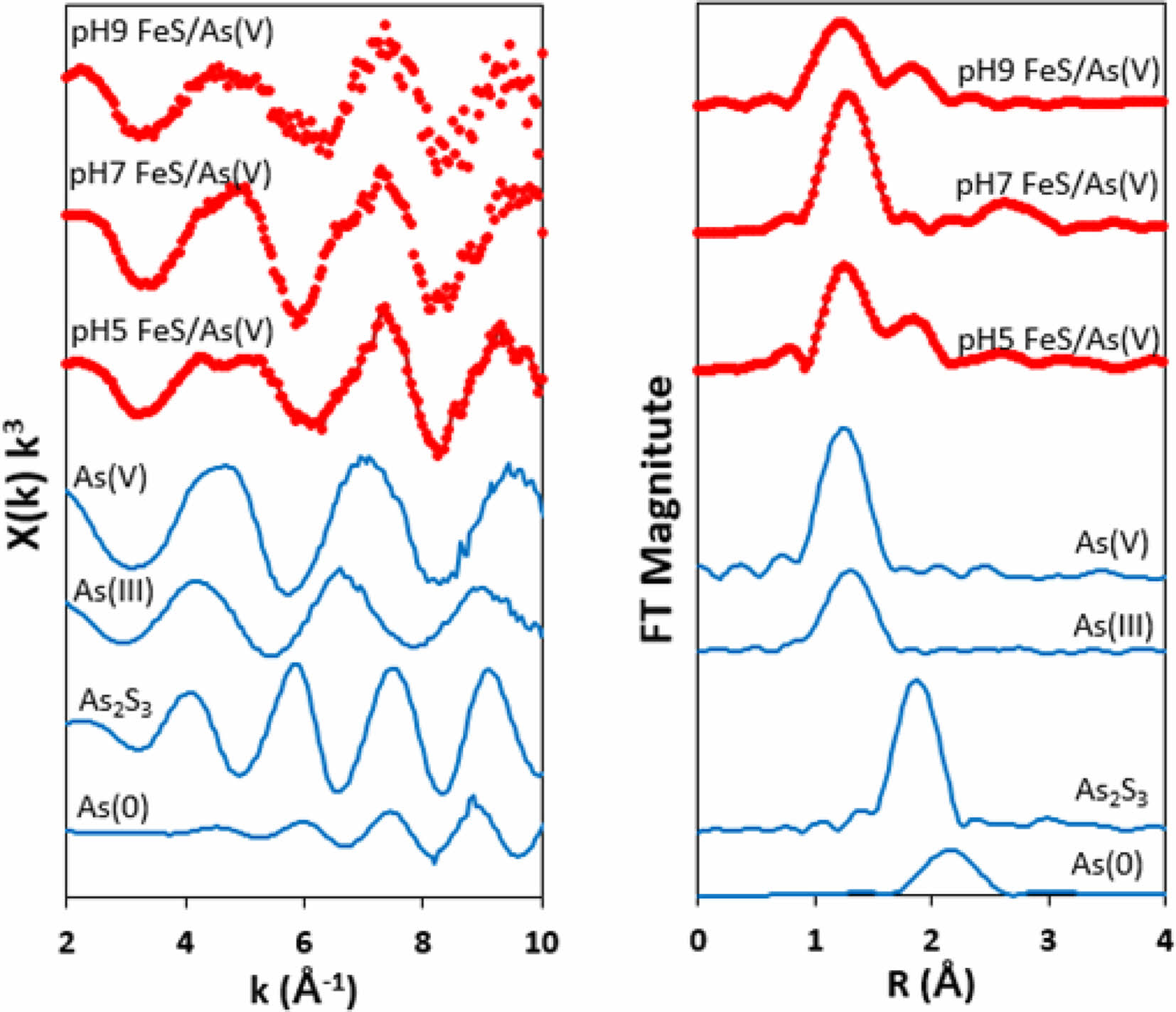
Fig. 3의 As K-edge EXAFS 스펙트럼 역시 XANES 스펙트럼의 결과와 동일한 비소의 반응 결과를 보여주고 있다. FeS와 반응한 As(V)의 일부는 원자 간 거리가 As-O를 지시하는 피크와 유사한 위치에서 나타나 FeS이 표면에서 As(V)의 형태로 흡착된 것으로 보인다. 또한 비소의 일부는 As2S3와 유사한 As-S 피크의 위치에 나타난다. 이러한 As-S 피크는 pH 5와 pH 9의 조건에서 높게 나타났으며, 이러한 피크를 통한 반응 메커니즘의 해석은 pH 구간에 따라 다르게 해석할 수 있다. 황화비소의 침전반응은 이에 앞서 As(V)의 As(III)로의 환원반응과 FeS의 dissolution에 의한 황화이온의 발생이 선행되어야 한다. FeS는 pH에 따라 용해도의 차이가 크게 나타나는 광물인데 pH 6 이하에서는 비교적 높은 농도(수 밀리몰에서 수 몰의 농도)로 나타나며, pH 6 이상에서는 비교적 용해도가 낮다고 알려져 있다(Rickard and Morse, 2005). 그러므로 pH 5에서는 명백하게 As2S3의 침전이 발생하여 고체상 비소로 측정되었다고 해석할 수 있으며, 이는 문헌을 통해서도 확인할 수 있다(Gallegos et al., 2008; Han et al., 2011). 그러나 pH 9에서의 반응은 해석에 좀 더 주의를 요한다. FeS의 용해도가 높은 pH 조건에서 낮다는 것이 일반적으로 알려진 사실이나, 문헌에 의하면 황화이온의 농도는 pH가 높아질수록 높게 나타나고 있으며, As2S3의 용해도는 전반적인 pH 구간을 통해 매우 낮으므로 pH 9에서 As2S3의 침전이 일어났을 가능성이 여전히 존재한다(Rickard, 2006). 또한 비소는 황화이온과 결합하여 황화비소종(thionated arsenic species)을 형성하는데 이러한 황화비소종의 형성은 높은 pH 조건에서 유리하게 일어난다(Suess and Planer-Friedrich, 2012). 그러므로 pH 9의 As-S 피크는 황화비소종의 표면 결합 반응이 섞여서 나타났을 가능성도 매우 크다. 특별히 본 연구에서 XAS 분석을 위해 준비한 시료의 FeS와 As(V) 농도는 5 g/L FeS와 50 mg/L As(V)로 적용되어 용존성 HS-의 농도가 높게 나타났을 것으로 예상되므로, pH 9에서 두가지 반응이 동시에 일어났을 것으로 예상된다. 반면, pH 5와 pH 9의 조건에서와는 달리 pH 7의 조건에서는 As-S이 피크가 거의 나타나지 않았다. 이는 pH 7 조건에서는 FeS의 용해도가 pH 5에 비하여 충분히 높지 않으며, HS-의 용존 농도도 충분히 높지 않은 이유로 As-S의 피크가 거의 나타나지 않고, 주로 As(V)-O의 표면 흡착 형태로 반응이 일어난 것으로 사료된다.
|
Fig. 1 Results of batch tests of 50 mg/L As(V) reacted with 1 g/L FeS suspension under pH 3 to 12 (A) Percent As(V) removal and (B) aqueous As speciation conducted using a Bond Elut C18 cartridge. |
|
Fig. 2 K-edge XANES results of (A) FeS reacted with As(V) under pH 5, 7, and 9 conditions and model compounds and (B) their results of linear combination fitting. |
|
Fig. 3 As K-edge EXAFS spectra of FeS reacted with As(V) and model compounds (data reproduced from Han et al. 2018b): (A) k3 - weighed EXAFS results and (B) corresponding Fourier transform. |
본 연구에서는 엄격한 혐기성 환경 하에서 합성된 FeS와 As(V)가 다양한 pH 조건에서 어떠한 반응을 일으키는가를 알아보고자 산성(pH 5), 중성(pH 7), 염기성(pH 9)의 조건을 고려한 연구를 수행하였다. 실험 결과 FeS와 비소의 반응에는 pH 및 광물의 용해도 등이 반응 결과에 큰 영향을 미침을 확인할 수 있었다. 산성 조건에서는 FeS의 용해 반응이 주요 반응기작이 되어 용해된 FeS로부터 배출된 황화이온과 FeS의 환원력으로 인하여 환원된 As(III)의 침전이 As2S3의 형태로 침전되는 것을 확인하였다. 이러한 반응은 FeS 표면의 흡착능력과 관계가 적으므로 pH 5에서는 매우 높은 As(V) 제거 효율을 가질 수 있음을 pH 별 반응실험을 통해 알 수 있었다. 이에 비해 중성 및 염기성 pH에서는 훨씬 낮은 양의 As(V)가 제거되었는데, 이때 As(V)의 반응기작은 표면흡착 반응이 주요 반응기작임을 분광학적 분석 결과를 통해 알 수 있었다. 산소가 닿지 않는 깊은 토층이나, 포화대층, 유기물이 많은 호소의 저질층 등의 자연계에서 환원 환경이 쉽게 형성된다. 또한 산화환원 조건은 홍수 및 지하수위 변화, 유기물 유입 등의 영향에 의해 변화될 수 있다. 본 연구는 산화된 비소가 환원된 토양 환경에서 어떠한 지구화학적 거동을 하는가에 대한 예측을 할 수 있는 시나리오에서 수행되었으며, 그 결과를 통해 다양한 지구화학적 조건에서 비소의 거동은 매우 복합적인 반응의 형태로 일어나고 있음을 확인할 수 있었다.
본 연구는 이 논문은 2021년도 정부(교육부)의 재원으로 한국연구재단의 지원을 받아 수행된 기초연구사업입니다(과제번호:NRF-2021R1I1A3051995). 방사광가속기를 이용한 실험은 포항가속기연구소의 시설을 이용하였습니다.
- 1. Borch, T., Kretzschmar, R., Kappler, A., Van Cappellen, P., Ginder-Vogel, M., Voegelin, A., and Campbell, K, 2010, Biogeochemical redox processes and their impact on contaminant dynamics, Environ. Sci. Technol., 44(1), 15-23.
-

- 2. Butler, E.C. and Hayes, K.F., 1998, Effects of solution composition and pH on the reductive dechlorination of hexachloroethane by iron sulfide, Environ. Sci. Technol., 32(9), 1276-1284.
-

- 3. Farquhar, M.L., Charnock, J.M., Livens, F.R., and Vaughan, D.J., 2002, Mechanisms of arsenic uptake from aqueous solution by interaction with goethite, lepidocrocite, mackinawite, and pyrite: an X-ray absorption spectroscopy study, Environ. Sci. Technol., 36(8), 1757-1762.
-

- 4. Gallegos, T.J., Han, Y.-S. and Hayes, K.F., 2008, Model predictions of realgar precipitation by reaction of As(III) with synthetic mackinawite under anoxic conditions, Environ. Sci. Technol., 42(24), 9338-9343.
-

- 5. Han, Y.S., Jeong, H.Y., Demond, A.H., and Hayes, K.F., 2011, X-ray absorption and photoelectron spectroscopic study of the association of As(III) with nanoparticulate FeS and FeS-coated sand, Water Research, 45(17), 5727-5735.
-

- 6. Han, Y.-S., Demond, A.H., Gallegos, T.J., and Hayes, K.F., 2015, Dependence of particle concentration effect on pH and redox for arsenic removal by FeS-coated sand under anoxic conditions, Chemosphere, 134, 499-503.
-

- 7. Han, Y.-S., Jeong, H.Y., Hyun, S.P., Hayes, K.F., and Chon, C.-M., 2018a, Beam-induced redox transformation of arsenic during As K-edge XAS measurements: availability of reducing or oxidizing agents and As speciation, J. Synchrotron Rad., 25, 763-770.
-

- 8. Han, Y.-S., Seong, H.J., Chon, C.-M., Park, J.H., Nam, I.-H., Yoo, K., and Ahn, J.S., 2018b, Interaction of Sb(III) with iron sulfide under anoxic conditions: Similarities and differences compared to As(III) interactions, Chemosphere, 195, 762-770.
-

- 9. Park, J.-H., Kim, S.-J., Ahn, J.S., Lim, D.-H., and Han, Y.-S., 2018, Mobility of multiple heavy metalloids in contaminated soil under various redox conditions: Effects of iron sulfide presence and phosphate competition, Chemosphere, 197, 344-352.
-

- 10. Suess, E. and Planer-Friedrich, B., 2012, Thioarsenate formation upon dissolution of orpiment and arsenopyrite, Chemosphere, 89(11), 1390-1398.
-

- 11. Ravel B. and Newville, M., 2005, ATHENA, ARTEMIS, HEPHAESTUS: data analysis for X-ray absorption spectroscopy using IFEFFIT, J. Synchrotron Rad., 12, 537-541.
-

- 12. Rickard, D. and Morse, J.W., 2005, Acid volatile sulfide (AVS), Marine Chemistry, 97(3-4), 141-197.
-

- 13. Rickard, D., 2006, The solubility of FeS, Geochimica et Cosmochimica Acta, 70(23), 5779-5789.
-

- 14. Shaheen, S.M., Rinklebe, J., Rupp, H., and Meissner, R., 2014, Lysimeter trials to assess the impact of different flood-dry-cycles on the dynamics of pore water concentrations of As, Cr, Mo and V in a contaminated floodplain soil, Geoderma, 228-229, 5-13.
-

- 15. Suess, E. and Planer-Friedrich, B., 2012, Thioarsenate formation upon dissolution of orpiment and arsenopyrite, Chemosphere, 89(11), 1390-1398.
-

 This Article
This Article
-
2022; 27(1): 25-30
Published on Feb 28, 2022
- 10.7857/JSGE.2022.27.1.025
- Received on Dec 1, 2021
- Revised on Dec 6, 2021
- Accepted on Jan 25, 2022
 Services
Services
Shared
 Correspondence to
Correspondence to
- Han Young-Soo
-
Department of Environmental Engineering, Chungnam National University, Daejeon 34134 Korea
- E-mail: hanyoungsoo@cnu.ac.kr





