- Fabrication of Metal-biochar Composite through CO2 Assisted Co-pyrolysis of Chlorella and Red Mud and Its Application for Persulfate Activation
Jang Hee-Jin1·Gihoon Kwon1·Kwangsuk Yoon·Hocheol Song1*
1Department of Environment and Energy, Sejong University, Seoul 05006, South Korea
- 녹조류와 적니의 이산화탄소환경 공동열분해를 통한 탄소-철 복합체 생성 및 과황산염 활성화를 통한 수중 염료 제거
장희진1·권기훈1·윤광석1·송호철1*
1세종대학교 환경에너지융합학과
This article is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
The common algae and industrial waste, chlorella and red mud, were co-pyrolyzed in carbon dioxide condition to fabricate iron-biochar composite. In order to investigate the direct effect of chlorella and red mud in the syngas generation and the property of biochar, experiments were performed using mixture samples of chlorella and red mud. The evolution of flammable gasses (H2, CH4, CO) was monitored during pyrolysis. The produced biochar composite was employed as a catalyst for persulfate activation for methylene blue removal. BET analysis indicated that the iron-biochar composite mainly possessed meso- and macropores. The XRD analysis revealed that hematite (Fe2O3) contained in red mud was transformed to Fe3O4 during co-pyrolysis. The composite effectively activated persulfate and removed methylene blue. Among the composite samples, the composite fabricated from the mixture composed of 1:2 chlorella:red mud showed the best performance in syngas generation and methylene blue removal.
Keywords: Co-pyrolysis, Biochar, Algae, Red Mud, Persulfate Activation
급격한 산업화와 세계인구 증가에 따라 염료, 농약, 의약품, 휴믹 물질 등의 다양한 유기오염물질이 함유된 폐수의 배출 또한 증가하고 있다(Wen et al., 2017), (Saxena et al., 2020). 이를 해결하기 위하여 연구자들은 고도산화처리, 막 여과, 광분해와 같은 수중 오염물질 저감기술을 발전시켜왔다(Raza et al., 2019). 이러한 기술들 중 고도산화처리 공정은 높은 효율성, 짧은 반응시간과 같은 장점으로 인해 실제 공정에 흔히 사용하는 기술이다(Garrido-Cardenas et al., 2020). 이 기술은 과산화수소나 과황산염과 같은 산화제를 활성화하여 유기분자를 빠르게 분해할 수 있는 라디칼(예: 황산염, 히드록실, 일중항 산소 라디칼 등)을 생성하는 기술로서 주로 과산화수소와 철염 사이의 전기화학 반응을 통해 히드록실 라디칼(OH•)을 생성하는 펜톤반응을 기반으로 한다(Zhao et al., 2021). 하지만 펜톤반응 기반 고도산화처리 공정은 폐수의 pH에 민감하고 라디칼의 용액 잔류시간이 짧으며 산화제의 가격이 비싸다는 단점이 있다(López-Vinent et al., 2020). 반면 과황산염 활성화를 통한 고도산화처리는 펜톤반응에 비하여 pH의존도가 낮고 화학적 안정성이 높으며 라디칼의 반감기가 보다 길기 때문에 최근 널리 연구되고 있다(Sun et al., 2021), (Xiong et al., 2021). 과황산염 활성화를 통한 고도산화처리는 자외선, 초음파, 열, 이종 활성제(heterogeneous activators)를 통해 HSO5- 혹은 S2O82-를 활성화하여 SO4•-와 OH• 등의 라디칼을 생성하는 공정이다(Wang et al., 2018), (Zheng et al., 2022). 특히 이종 활성제를 사용한 방법은 주로 고체 촉매를 이용하는 방법으로 다른 방법보다 요구되는 에너지가 적기 때문에 유지비용이 절감되는 장점이 있다. 이에 따라 고체 촉매를 이용한 과황산염 활성화를 통한 고도산화처리가 최근 많이 연구되고 있다. 예를 들어 이전 연구들 에서는 코발트나 철과 같은 비귀금속 촉매로 빛이나 열을 주사하지 않고 과황산염 활성화를 통한 고도산화처리를 수행한 바 있다(Li et al., 2021), (Pu et al., 2020), (Pi et al., 2019). 기존의 고체 촉매는 주로 활성탄과 같은 다공성 물질에 금속염을 분사한 후 고온, 고압 환경에서 제조하며 공정 비용이 높아 촉매 단가가 높고 다량의 폐수를 배출한다는 단점이 있다(Kwon et al., 2020b).
이를 해결하기 위하여 최근 바이오매스와 산업폐기물을 사용하여 촉매를 제조하려는 연구들이 수행되고 있다. 특히 이전 연구들은 금속-바이오차 복합체가 과황산염을 활성화하는 촉매로서 잠재력이 뛰어나다는 것을 입증했다(Wu et al., 2021). 금속-바이오차 복합체는 바이오매스와 금속 전구체로 구성된 공급 원료를 공동열분해하여 생산된다. 금속-바이오차 복합체의 촉매 능력은 작용기인 금속성분과 전자전달 능력이 뛰어난 흑연구조 탄소의 병용효과로 인하여 발달하는 것으로 알려져 있다(Yu et al., 2019). 또한 금속-바이오차 복합체는 다공성 구조 및 풍부한 표면 작용기 등 유리한 특성을 가지고 있다. 우리의 이전 연구에서는 플라스틱을 무기성 광물인 고타이트와 공동열분해하여 제작한 촉매를 고도산화처리공정에 사용한 바 있다(Kwon et al., 2021). 해당 연구는 제작한 촉매의 특성을 분석하고 이를 과황산염 활성화를 통한 고도산화처리공정에 적용하는 것을 목적으로 수행되었다. 하지만 폐기물의 열분해는 높은 온도에서 수행되는 흡열반응으로서 공정을 운영하는 비용이 필요하기 때문에 공정 중 생성되는 합성가스(H2, CO)와 같은 부산물에 대한 분석 또한 이루어져야 한다. 최근 일부 연구에서는 열분해공정에 이산화탄소를 사용하여 합성가스 생산량을 증대할 수 있다는 것을 증명하였다(Déparrois et al., 2019). 합성가스는 가연성을 띄는 가스로 연료로 사용 가능하고 필수 산업 화학물질(메탄올, 암모니아) 생산의 전구물질로도 사용하는 매우 가치 있는 물질이다. 따라서 합성가스 생산량을 증대하여 전체 공정의 효율 또한 제고할 수 있다.
따라서, 본 연구는 흔히 찾을 수 있고 대량생산이 쉬운 녹조류인 Chlorella와 대표적인 무기성 산업페기물인 적니(Red mud, RM)를 이산화탄소 환경에서 공동열분해하는 연구를 수행하였다. RM는 알루미나 정제공정의 부산물로서 철산화물이 다량 함유되어 있다. 이와 같이 금속을 다량 함유한 폐기물은 처리하는데 비용이 많이 들고 그 과정에서 화학약품을 사용하기 때문에 2차적인 환경오염을 유발할 수 있다(Wang and Liu, 2021). 그렇기에 RM를 공동열분해를 통해 촉매로 전환하는 기술은 폐기물 관리와 수처리를 동시에 수행할 수 있는 기술이라 할 수 있다. 한편 열분해 중 생성된 가연성 가스(H2, CH4, CO)의 농도를 측정하였으며 두 원료(녹조류, RM)의 비율별로 생성된 가스의 양을 정확히 비교하기 위하여 농도그래프의 적분 값을 계산하였다. 최종적으로 제작한 촉매는 X선 회절분석(XRD), 표면적분석(BET)을 통해 특성을 분석하였으며 과황산염을 활성화하여 수중 메틸렌 블루를 저감하는 촉매로 사용하였다.
2.1. 실험재료 및 방법
2.1.1. 실험재료
녹조류(Chlorella)는 ㈜아쿠아넷(한국), 적니(Red mud, RM)는 한국지질자원연구원(KIGAM)에서 인수했다. 두 시료는 섭씨 80oC에서 오븐에서 24시간동안 건조 후 ball mill(PULVERISETTE 0, Fritsch, Germany)을 사용하여 고운 분말로 분쇄하였다. 이 분말은 200메시 체(0.07 nm)를 통해 그 크기를 균일화한 후 실온(20 ± 5oC)의 건조기에 저장하였다. 이산화탄소(CO2, ³99.9%))가스는 ㈜그린가스(한국)에서 구매하였다. 메틸렌 블루(Methylene blue, MB, C16H18ClN3S, Lot # MKBR8923V), 과황산나트륨(Sodium peroxydisulfate, SPS, ³98%, Na2S2O8, Lot # BCBR6712V)은 Sigma-Aldrich(미국)에서, 에탄올(Ethanol, EtOH, ³99.9%, C2H5OH, Lot # E1719TH1)은 대정화학(한국)에서 구매하였다.
녹조류와 RM의 혼합시료는 두 시료를 1:0.5, 1:1 및 1:2의 질량비로 혼합하여 준비하였으며 이를 각각 C1R0.5, C1R1, C1R2로 명명하였다.
2.1.2. 열 중량분석(TGA)
녹조류와 녹조류/RM의 혼합물(C1R2)의 열분해 특성을 조사하기 위해 Thermo-gravimetric analyzer STA449 F5 Jupiter(NETZSCH, Germany)를 사용하여 열 중량분석(TGA) 테스트를 실시하였다. 녹조류(10 ± 0.01 mg)와 C1R2 혼합물(30 ± 0.01 mg)은 열 중량분석계에 내장된 알루미나 용기에 적재하였다. 녹조류의 열 중량 분석은 공기(air)와 이산화탄소 환경에서 각각 실시하였으며 C1R2 혼합물의 열 중량분석은 이산화탄소 환경에서만 실시하였다. 공기와 이산화탄소는 유량 조절기(MFCs)를 통해 50 mL min−1의 유량으로 공급되었으며 10oC min−1로 35oC에서 900oC까지 승온하였다.
2.1.3. 열분해 실험
녹조류에서 생성되는 가스의 양을 정확히 비교하기 위하여 열분해 실험에서 모든 시료의 녹조류의 양은 1 g으로 통일하였다. 알루미나 재질의 도가니에 적재된 시료는 석영관(지름*길이= 2.4 cm × 60 cm)의 중앙에 위치한 울트라 토르를 이용하여 이산화탄소 가스통과 연결하였다. 이산화탄소를 100 mL min−1의 유량으로 충분히 주입하여 관 내부의 공기를 제거한 후 전기로에 위치하였다. 열분해는 210-700oC의 온도에서 진행되었으며 온도는 10oC min−1의 속도로 승온하였다. 열분해 중 생성된 가스(즉,H2, CH4, CO)는 튜브를 따라 3000 micro-GC(INFICON, Switzerland)에 연결되어 실시간으로 분석하였다. 녹조류, C1R0.5, C1R1, C1R2를 열분해하여 얻은 바이오차를 각각 CBC, C1R0.5B, C1R1B, C1R2B로 명명하였다.
2.1.4 바이오차 특성분석
바이오차의 표면적은 BELSORP-max II 표면 분석기(MicrotracBEL, Japan)를 사용하여 분석하였으며 저온에서 질소의 흡,탈착 곡선과 공극 크기분포(BJH 곡선)를 도시하였다. 바이오차의 X선 회절 분석(XRD analysis)는 철의 상변화를 관찰하기 위하여 측정하였으며 X선 회절분석기(D8 Advance, Bruker-AXS, USA)를 사용하여 분석하였다.
2.1.5. 과황산염 활성화 실험
모든 용액은 탈이온 증류수(DI water)를 이용하여 제조하였다. 과황산염 활성화 실험은 용액의 초기pH를 1 N HNO3 및 NaOH 용액을 사용하여 pH 3으로 조정 후 실시하였다. 실험에서 MB의 초기농도는 5 mg L-1, SPS 농도는 2 mM, 바이오차는 0.1 g L-1로 설정하였다. MB의 저감이 바이오차의 흡착능력에 의한 것인지 과황산염 활성화에 의한 라디칼 기반의 반응에 의한 것인지 확인하기 위하여 SPS 없이 바이오차에 의한 MB의 농도변화 또한 측정하였다. MB 농도는 UV/VIS 분광계에 의해 465 nm 파장에서 측정되었다. Kinetic 데이터는 유사 1차 반응 방정식 [ln(At/A0) = -kobs ∙ t]로 계산하였다.
2.2. 결과 및 고찰
2.2.1. TGA/DTG
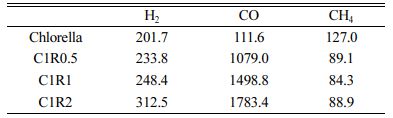
공기와 이산화탄소를 주입하는 조건에서 온도 증가에 따른 시료(녹조류와 C1R2)의 질량 변화(TG)와 그 변화율(DTG)을 Fig. 1에 도시하였다. 공기를 주입하는 조건에서 녹조류의 DTG 곡선은 3개의 피크를 나타내었다(Fig. 1a). 이는 세 개의 온도 구간에서 시료의 질량 감소가 일어났다는 것을 의미한다. 각 피크는 온도 구간 80-200, 200-500, 500-700oC에서 나타났다. 1차 질량 감소 구간(80-200oC)에서는 약 5% 정도의 질량 감소가 관찰되었다. 이는 일반적으로 수분이 증발하는 구간이며 건조한 녹조류에 잔류된 수분이 증발하여 나타난 결과라고 할 수 있다. 2차 질량 감소 구간(200-500oC)에서는 약 63%의 질량이 감소하였으며 녹조류 내에 존재하는 휘발성 물질(volatile matter)이 휘발되어 나타난 결과로 보인다(Chen et al., 2012). 2차 질량 감소를 나타내는 DTG 곡선은 400oC에서 기울기의 변화를 나타냈다. 이는 녹조류 내 휘발성 셀룰로오스와 헤미셀룰로오스 사이의 휘발 온도 차이로 인해 나타난 결과로 보인다. 3차 질량 감소 구간(500-700oC)에서는 약 23%의 질량 감소가 관측되었으며 이는 녹조류 내 고정 탄소(fixed carbon)의 연소를 나타낸다. 700oC 보다 높은 온도에서는 약 9% 정도의 질량이 남아있으며 실험이 진행된 900oC까지 추가적인 질량 감소가 관측되지 않았다. 이는 녹조류 내 열 적으로 분해할 수 없는 무기물질(칼슘, 마그네슘, 철, 등)을 나타낸다. 따라서 녹조류는 5%의 수분, 63%의 휘발성 물질, 23%의 고정 탄소, 그리고 9%의 무기물을 함유하고 있는 것으로 보인다.
이산화탄소 환경 녹조류의 DTG 곡선에서 3개의 피크를 관측하였다(Fig. 1b). 각 피크는 80-200, 200-500, >720oC에서 관측되었다. 1차 질량 감소는 Fig. 1a의 결과와 같은 정도로 나타났으며 이는 녹조류 내 수분 증발에 의해 나타난 결과로 보인다. 2차 질량 감소를 나타내는 DTG 곡선의 모양 또한 Fig. 1a와 유사한 경향을 보인다. 이는 녹조류 내 휘발성 물질 휘발이 연소와 비슷한 온도 구간에서 일어난다는 것을 의미한다. 2차 질량 감소의 정도 또한 Fig. 1a의 연소 결과와 유사한 정도(65%)를 보였다. 이는 녹조류 내 고정 탄소 성분이 이산화탄소 환경 열분해에서 잔류한다는 것을 보여준다. 2차 질량 감소가 완료된 500oC에서 720oC까지 일정한 속도로 무게가 감소하였다. 이전 연구결과들에 따르면 이는 탄소 성분이 2중결합과 고리 형태를 형성하며 수소를 배출하는 탈 수소화 반응(dehydrogenation)에 기인하는 것으로 보인다(Cho et al., 2017). 3차 질량 감소는 720oC 이상에서 관측되었다. 기존 이산화탄소 환경 열분해를 연구한 논문에서는 이를 부다드 반응(Boudouard reaction)에 의한 것으로 보고하고 있으며 이는 이산화탄소가 고체 탄소와 반응하여 두 개의 일산화탄소를 생성하는 반응(C + CO2 → 2CO)이다(Lahijani et al., 2015). 이산화탄소 환경에서 C1R2의 결과는 질량 감소의 정도가 줄어들었으나 녹조류의 결과(Fig. 1b)와 유사한 경향을 나타냈다(Fig. 1c). 이는 이산화탄소 열분해에서 시료에 포함된 RM가 녹조류의 물리적 분해에 크게 영향을 미치지 않음을 나타낸다.
2.2.2. 공동열분해 중 합성가스 생성
시료(녹조류, C1R0.5, C1R1, C1R2)의 열분해 공정 중 생성되는 주요 가스 종(H2, CO, CH4)의 온도 별 생산량이 측정되었으며 온도 증가에 따른 해당 가스의 농도를 적분하여 얻은 값을 Table 1에 나타냈다. 부다드 반응에 의한 가스 생산 외의 이산화탄소와 RM의 영향을 판단하기 위하여 열분해의 최종 온도는 부다드 반응이 일어나기 전인 700oC로 설정하였다. 녹조류의 열분해에서 얻은 H2, CO, CH4의 농도 그래프를 적분하여 얻은 값은 각각 111.6, 201.7, 127.0으로 나타났다. C1R0.5의 열분해에서 H2, CO, CH4농도 그래프의 적분 값은 1079.0, 233.8, 89.1로 나타났다. 이 결과에서는 RM를 녹조류와 공동 열분해했을 때 녹조류를 단일 열분해했을 때 보다 일산화탄소의 생산량이 크게 증가한다는 것을 확인할 수 있다. 수소 또한 소량 증가하였으나 메탄의 생산량은 감소하는 것으로 나타났다. 이는 RM와 녹조류의 공동 열분해로 합성가스(H2, CO)의 생산량을 크게 증대할 수 있으며 메탄의 일부가 탄소와 수소를 공여한다는 것을 보인다. 하지만 메탄 생산량이 소량 감소하였다는 사실로는 일산화탄소가 9.7배 증가한 것을 모두 설명할 수는 없다. Fig. 1에서 두 시료의 공동열분해가 물질의 물리적인 분해에 영향을 미치지 않았다는 사실을 미루어 볼 때 이는 증발한 휘발성 탄소가 이산화탄소에 의해 분해되면서 일산화탄소를 형성한 것으로 보인다(Kwon et al., 2020a).
C1R1와 C1R2을 열분해하여 얻은 H2, CO, CH4 농도 프로 그래프의 적분 값은 각각 1498.8, 248.4, 84.3 그리고 1783.4, 312.5, 88.9로 확인되었다. 이는 혼합물에서 RM의 비율이 증가할수록 CO와 H2의 생산량이 증가함을 나타낸다. 바이오매스의 열분해에서 철 종이 합성가스 생산에 미치는 영향은 이전 연구들에서 확인한 바 있다. 예를 들어 한 논문에서는 질소 환경 열분해에서 철을 담지시킨 커피박(spent coffee ground)을 열분해 하였을 경우 수소의 생산량이 증가하였으며, 이산화탄소환경 열분해에서는 수소와 일산화탄소 생산량이 모두 크게 증가한다는 것을 증명하였다(Cho et al., 2016). 본 연구에서 RM와 녹조류의 공동열분해가 합성가스 생산에 미친 영향 또한 RM 내에 함유된 철 종이 촉매역할을 수행한 결과로 보인다. 결과적으로 RM와 녹조류를 공동열분해하여 합성가스 생산을 크게 증가할 수 있다는 것을 확인하였다.
2.2.3. 금속-바이오차 복합체의 특성
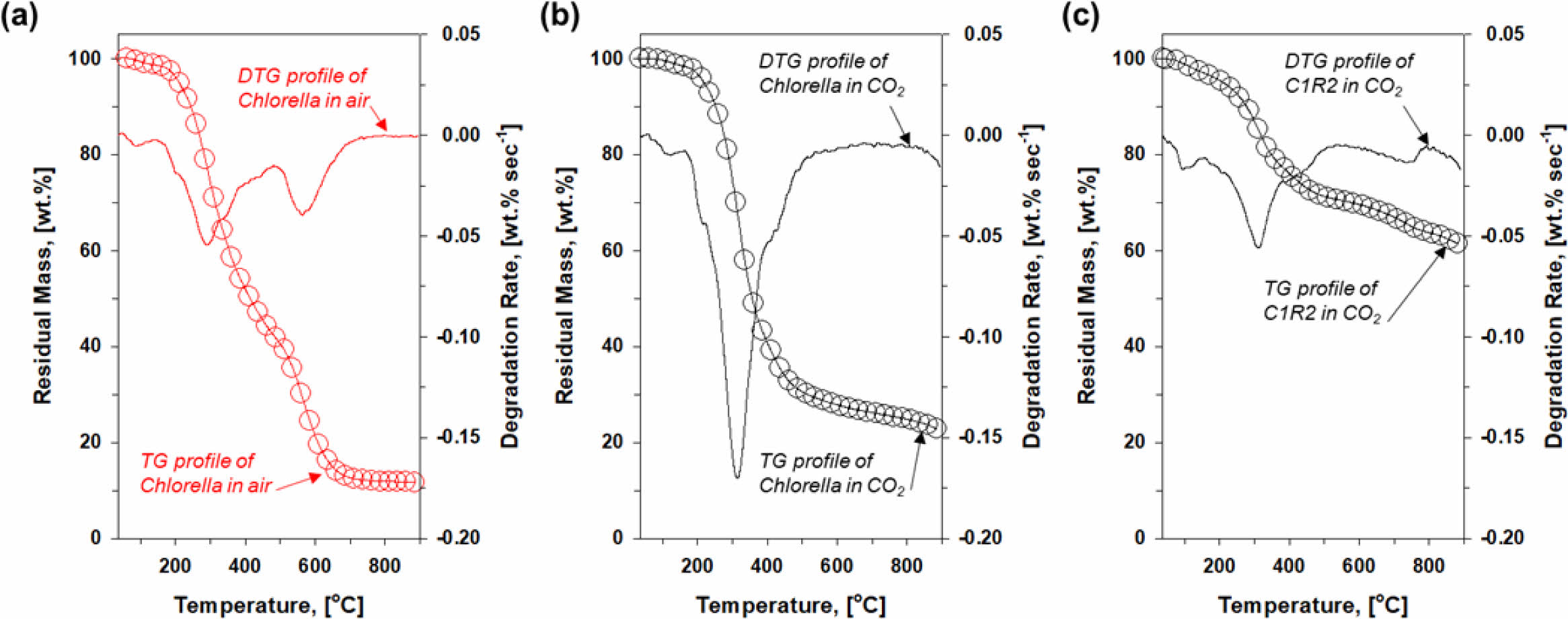
Fig. 1에서 수행한 가스분석에서 가장 우수한 결과를 도출한 C1R2를 열분해 하여 제작한 바이오차(C1R2B)의 BET 분석결과를 Fig. 2에 도시하였다. Fig. 2a에 나타낸 그래프는 저온에서 기압에 증감에 따른 질소의 흡착(검정), 탈착(빨강) 경향을 나타낸다. 이 그래프는 주로 물질내 세공 특성에 대한 정보를 제공하여 다공성 물질의 특성 분석에 주로 사용한다(Khalfaoui et al., 2003). Fig. 2a에서 나타난 C1R2B의 그래프는 type H3의 양상을 나타낸다. 상대 압력(relative pressure)가 0에 가까운 부분에서 질소 흡착 량이 증가하는 것은 주로 세공 지름 2 nm 이하인 마이크로 세공(micropore)의 영향으로 알려져 있다. 본 연구에서 나타난 결과에서는 매우 적은 량이 상대 압력 0 부근에서 증가하였으므로 C1R2B 시료에는 마이크로 세공이 소량 존재한다고 추정할 수 있다. 상대 압력 0.4-0.8 부근에서는 질소 흡착 곡선과 탈착 곡선 사이에 간극이 나타나는 것을 확인할 수 있다. 이는 세공 지름 2-50 nm 사이의 메조 세공(mesopore)의 강한 질소 흡착 능력에 의해 탈착이 지연된 결과라 알려져 있다. 흡착과 탈착 그래프 사이의 간극의 모양으로 메조 세공의 모양을 추정하기도 하는데 Fig. 2a에 나타난 형상에서는 간극이 크게 벌어지지 않았으며 패턴이 유사한 것으로 보아 양쪽이 개통되었거나 입구가 넓은 모양의 메조 세공이 주로 형성되었다고 추정할 수 있다. 상대 압력 0.8 이상에서 그래프가 급격히 증가하는 것을 볼 수 있는데 이것은 C1R2B에 세공 지름 50 nm 이상의 매크로 세공(macropore)이 다량 존재한다는 것을 의미한다. 이러한 질소 흡,탈착 경향을 통해 추정한 내용은 Fig. 2b의 세공 크기 분포(BJH plot)에서 확인할 수 있다. Fig. 2b에서 세공 지름 10 nm 이상 크기를 가진 세공이 주로 존재함을 알 수 있다. BET 분석을 통해 계산한 C1R2B의 표면적, 총 공극 부피, 평균 세공 직경은 각각 36.7 m2 g-1, 0.1 cm3 g-1, 12.6 nm로 나타났다.
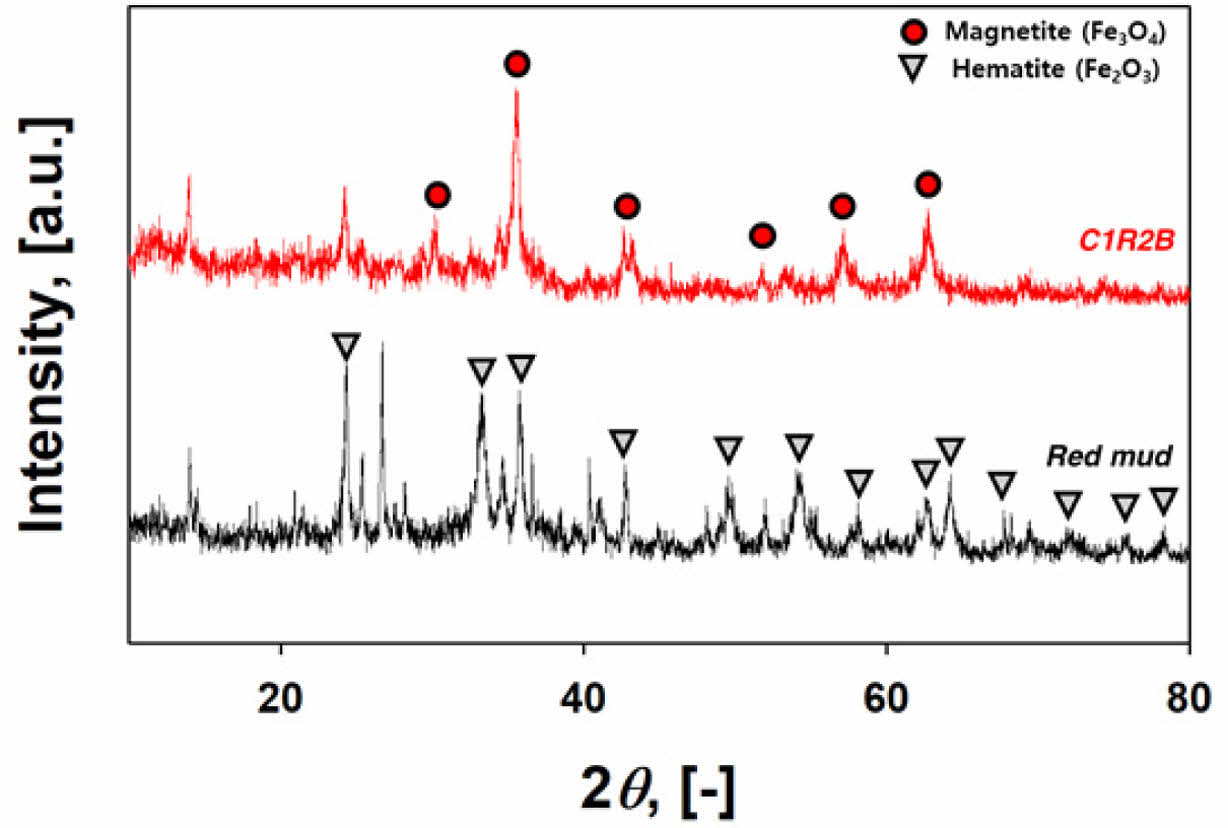
RM와 C1R2B의 XRD 분석결과를 Fig. 3에 도시하였다.
RM의 XRD 결과에서는 RM 내 철의 주요 성상이 적철석(Fe2O3, JCPDS # 33-0664, 2θ = 24.1, 33.1, 35.6, 40.8, 49.4, 54.1, 57.6, 62.4, 64.0, 70.0, 72.0, 75.4, 77.8)로 이루어져 있음을 볼 수 있다(Sahoo et al., 2021). 이 외에도 Sodalite(Na8(Al6Si6O24)Cl2, JCPDS # 81-0704), Boehmite(γ-AlO(OH)), JCPDS # 21-1307)의 피크가 관측되었다. 반면 C1R2B의 XRD그래프에서는 자철석(Fe3O4)를 나타내는 피크(JCPDS # 19-0629, 2θ = 30.2, 35.4, 43.0, 57.1, 62.6o)를 확인하였다(Marghaki et al., 2020). 이는 녹조류와의 공동 열분해가 진행됨에 따라 RM 내 Fe2O3가 자철석(Fe3O4)으로 상전이 됨을 나타낸다. Fe2O3가 열분해 과정에서 Fe3O4로 환원되는 것은 공정 중 발생하는 가스에 의한 것으로 추정된다. 자세히 말하면 열분해 과정에서 발생하는 H2와 CO가스는 대표적인 환원제로서 금속을 환원시킬 때 주로 사용하는 가스이다. 이전 연구에서는 이러한 반응을 이용하여 무기물과 플라스틱 시료의 공동 열분해로 Fe2O3를 영가철(Fe0)까지 환원시킨 바 있다(Kwon et al., 2021). 본 연구에서 Fe2O3의 환원이 Fe0까지 진행되지 않은 것은 반응에 사용한 이산화탄소가 철의 환원반응을 억제하였기 때문으로 추정된다.
2.2.4. 수중 MB 저감
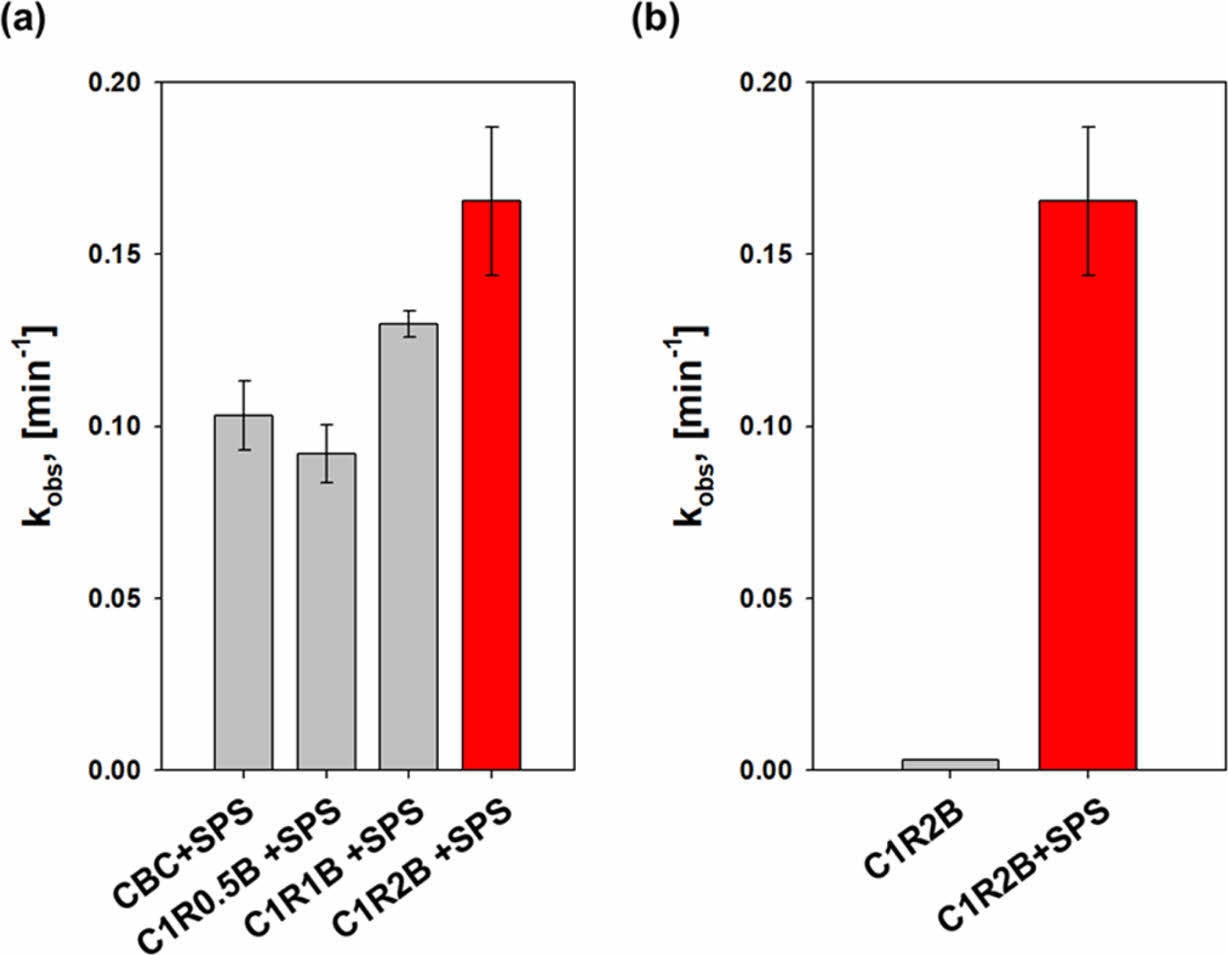
수중 MB 저감의 주요 반응 경로를 확인하고 시료 중 RM의 함량에 따른 반응 정도를 확인하기 위하여 일련의 실험을 수행하였고 반응 속도를 유사1차반응식으로 계산하여 Fig. 4에 도시하였다. 사전 Fe3O4-탄소 기반의 복합체를 이용한 수중 유기오염물질 저감 실험에서 낮은 pH에서 반응이 활발히 일어나는 것을 확인하였으며 따라서 본 실험은 pH3에서 수행되었다(Kwon et al., 2020c). Fig. 4a에서 녹조류의 열분해로 제조한 바이오차(CBC)와 SPS 존재 하에서 MB 저감 속도는 C1R0.5B와 비교하여 높은 수준으로 나타났다. CBC와 SPS 존재 하에서 MB의 저감은 주로 흡착 반응에 기인하기 때문에 이는 음극을 띄는 녹조류 유래 바이오차 표면과 MB의 정전기적 흡착이 주로 나타났기 때문으로 보인다. 반면 C1R0.5B는 CBC에 비해 양극을 띄는 Fe3O4가 MB와의 반발력을 형성하였으며 SPS를 충분히 활성화시키기에는 충분하지 않은 것으로 보인다. C1R1B와 C1R2B를 SPS와 함께 사용하였을 때 MB 저감 속도는 크게 증가하였으며 이는 바이오차 내 Fe3O4 함량이 증가함에 따라 SPS를 라디칼로 활성화하는 반응이 증가하였음을 나타낸다. 최종적으로 C1R2B가 가장 높은 MB 저감 속도를 나타내는 것을 확인할 수 있다. 이는 바이오차 내의 Fe3O4가 SPS를 활성화하여 SO4•−와 OH• 라디칼을 생성한 이전 연구의 결과와 부합하였다(Kwon et al., 2020c). 이에 따르면 Fe3O4에 의한 SPS 활성화의 반응식은 다음과 같다.
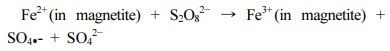
Fig. 4b은 MB 저감의 주요 반응 경로를 확인하기 위하여 MB +C1R2B와 MB + C1R2B + SPS 조건에서 실험한 결과를 나타냈다. 그 결과 MB + C1R2B에서는 MB가 거의 줄어들지 않은 것을 확인하였다. MB와 C1R2B가 존재하는 환경에서 MB 저감의 반응 경로는 주로 흡착 반응에 기인하기 때문에 이 결과는 흡착으로 인한 MB 저감이 거의 일어나지 않는 다는 것을 의미한다. 수중에서 MB는 양이온 성질을 띄고 있기 때문에 같은 양극을 띄는 C1R2B 내 Fe3O4와의 반발력으로 흡착이 거의 이루어지지 않은 것으로 보인다(Ahmad et al., 2020). 일반적으로 바이오매스의 열분해로 얻은 바이오차의 표면은 음극을 띄는 것으로 알려져 있으며 소량 제거된 MB는 C1R2B 내 녹조류에서 유래된 탄소 표면에 흡착된 것으로 보인다(Tan et al., 2020). 반면 MB + C1R2B + SPS 조건에서는 MB 제거 속도가 크게 증가한 것을 확인하였다. 이는 C1R2B와 SPS가 공존하는 환경에서 MB 저감은 대부분 SPS 활성화로 발생한 라디칼에 의한 반응이라는 것을 나타낸다.
|
Fig. 1 TG (line and symbol) and DTG (line) profiles of (a) chlorella in air, (b) chlorella in CO2, and (c) C1R2 in CO2. |
|
Fig. 2 (a) N2 adsorption and desorption profile and (b) pore size distribution plot obtained from BET analysis of C1R2B |
|
Fig. 3 XRD spectra of virgin red mud and C1R2B |
|
Fig. 4 MB removal under different conditions (a) changing red mud ratio in samples (initial pH = 3, SPS concentration = 2 mM, MB concentration = 5 mg L-1 , biochar dose = 0.1 g L-1) and (b) with and without oxidant (initial pH = 3, SPS concentration = 0 or 2 mM, MB concentration = 5 mg L-1 , biochar dose = 0.1 g L-1). |
본 연구에서는 대표적인 녹조류와 산업폐기물인 Chlorella와 적니를 이산화탄소환경에서 공동열분해하여 금속-바이오차 복합체를 제조하였으며 이를 과황산염 활성화를 통한 고도산화처리의 촉매로 사용하였다. 열분해 중 주요 가스(H2, CO, CH4)의 생산량을 측정하였으며 두 시료의 혼합비율이 가스생산에 미치는 영향을 조사하였다. 녹조류와 혼합시료의 열 중량분석에서 녹조류의 열분해가 200-500oC 부근에서 발생하였으며 시료 중 고정탄소가 바이오차 형태로 잔류하는 것을 확인하였다. 500oC 이상의 온도에서는 수소의 생성반응인 탈수소화 반응이 일어났으며 720oC 이상에서는 부다드 반응이 관찰되었다. 녹조류와 적니의 공동열분해는 수소와 일산화탄소의 생산을 증대하는 효과가 있었으며 두 시료를 1:2의 질량비로 혼합한 시료에서 가장 많은 합성가스가 생산되었다. 생산된 금속-바이오차 복합체의 표면적은 36.7 m2 g-1이었으며 메조 세공와 매크로 세공이 주를 이루는 것으로 추정되었다. 적니의 주요 성분인 Fe2O3는 열분해 중 생성된 수소와 일산화탄소에 의해 Fe3O4로 환원되었다. Fe3O4와 바이오차의 복합체는 과황산염을 활성화하여 SO4•-와 OH•을 생성하는 촉매로서 효능을 보였으며 이러한 반응을 통해 수중 MB 저감에 사용될 수 있을 것으로 판단되었다.
이 성과는 정부(과학기술정보통신부)의 재원으로 한국연구재단의 지원을 받아 수행된 연구임(No. 2021R1A2C 1010564).
- 1. Ahmad, A., Khan, N., Giri, B.S., Chowdhary, P., and Chaturvedi, P., 2020, Removal of methylene blue dye using rice husk, cow dung and sludge biochar: Characterization, application, and kinetic studies, Bioresour. Technol., 306, 123202.
-

- 2. Chen, C., Ma, X., and He, Y., 2012, Co-pyrolysis characteristics of microalgae Chlorella vulgaris and coal through TGA, Bioresour. Technol., 117, 264-273.
-

- 3. Cho, D.-W., Kwon, G., Ok, Y.S., Kwon, E.E., and Song, H., 2017, Reduction of Bromate by Cobalt-Impregnated Biochar Fabricated via Pyrolysis of Lignin Using CO2 as a Reaction Medium, ACS Appl. Mater. Interfaces, 9(15), 13142-13150.
-

- 4. Cho, D.-W., Lee, J., Yoon, K., Ok, Y.S., Kwon, E.E., and Song, H., 2016, Pyrolysis of FeCl3-pretreated spent coffee grounds using CO2 as a reaction medium, Energy Conv. Manag., 127, 437-442.
-

- 5. Déparrois, N., Singh, P., Burra, K.G., and Gupta, A.K., 2019, Syngas production from co-pyrolysis and co-gasification of polystyrene and paper with CO2, Appl. Energy, 246, 1-10.
-

- 6. Garrido-Cardenas, J.A., Esteban-García, B., Agüera, A., Sánchez-Pérez, J.A., and Manzano-Agugliaro, F., 2020, Wastewater Treatment by Advanced Oxidation Process and Their Worldwide Research Trends, Int. J. Environ. Res. Public Health, 17(1), 170.
-

- 7. Khalfaoui, M., Knani, S., Hachicha, M.A., and Lamine, A.B., 2003, New theoretical expressions for the five adsorption type isotherms classified by BET based on statistical physics treatment, J. Colloid Interface Sci., 263(2), 350-356.
-

- 8. Kwon, D., Lee, S.S., Jung, S., Park, Y.-K., Tsang, Y.F., and Kwon, E.E., 2020a, CO2 to fuel via pyrolysis of banana peel, Chem. Eng. J., 392, 123774.
-

- 9. Kwon, G., Bhatnagar, A., Wang, H., Kwon, E.E., and Song, H., 2020b, A review of recent advancements in utilization of biomass and industrial wastes into engineered biochar, J. Hazard. Mater., 400, 123242.
-

- 10. Kwon, G., Cho, D.-W., Wang, H., Bhatnagar, A., and Song, H., 2020c, Valorization of plastics and paper mill sludge into carbon composite and its catalytic performance for acarbon material consisted of the multi-layerzo dye oxidation, J. Hazard. Mater., 398, 123173.
-

- 11. Kwon, G., Cho, D.-W., Yoon, K., and Song, H., 2021, Valorization of plastics and goethite into iron-carbon composite as persulfate activator for amaranth oxidation, Chem. Eng. J., 407, 127188.
-

- 12. Lahijani, P., Zainal, Z.A., Mohammadi, M., and Mohamed, A.R., 2015, Conversion of the greenhouse gas CO2 to the fuel gas CO via the Boudouard reaction: A review, Renew. Sust. Energ. Rev., 41, 615-632.
-

- 13. Li, B., Wang, Y.-F., Zhang, L., and Xu, H.-Y., 2022, Enhancement strategies for efficient activation of persulfate by heterogeneous cobalt-containing catalysts: A review, Chemosphere, 291(2), 132954.
-

- 14. López-Vinent, N., Cruz-Alcalde, A., Gutiérrez, C., Marco, P., Giménez, J., and Esplugas, S., 2020, Micropollutant removal in real WW by photo-Fenton (circumneutral and acid pH) with BLB and LED lamps, Chem. Eng. J., 379, 122416.
-

- 15. Marghaki, N.S., Jonoush, Z.A., and Rezaee, A., 2020, Improving the performance of Cr (VI) removal by electrochemical process using microbial cellulose/magnetic nanoparticles electrode, J. Clean Prod., 277, 123195.
-

- 16. Pi, Z., Li, X., Wang, D., Xu, Q., Tao, Z., Huang, X., Yao, F., Wu, Y., He, L., and Yang, Q., 2019, Persulfate activation by oxidation biochar supported magnetite particles for tetracycline removal: Performance and degradation pathway, J. Clean Prod., 235, 1103-1115.
-

- 17. Pu, M., Niu, J., Brusseau, M.L., Sun, Y., Zhou, C., Deng, S., and Wan, J., 2020, Ferrous metal-organic frameworks with strong electron-donating properties for persulfate activation to effectively degrade aqueous sulfamethoxazole, Chem. Eng. J., 394, 125044.
-

- 18. Raza, W., Lee, J., Raza, N., Luo, Y., Kim, K.-H., and Yang, J., 2019, Removal of phenolic compounds from industrial waste water based on membrane-based technologies, J. Ind. Eng. Chem., 71, 1-18.
-

- 19. Sahoo, R.K., Manna, A.K., Das, A., Mitra, A., Mohapatra, M., Nath Sarangi, S., Garg, P., Deshpande, U., and Varma, S., 2022, Facile synthesis of Super-paramagnetic Au @¥á-Fe2O3 hybrid nanoparticle and its assembly on graphene substrate for visible light Photo-catalysis, Appl. Surf. Sci., 151954.
- 20. Saxena, R., Saxena, M., and Lochab, A., 2020, Recent Progress in Nanomaterials for Adsorptive Removal of Organic Contaminants from Wastewater, ChemistrySelect, 5(1), 335-353.
-

- 21. Sun, H., Guo, F., Pan, J., Huang, W., Wang, K., and Shi, W., 2021, One-pot thermal polymerization route to prepare N-deficient modified g-C3N4 for the degradation of tetracycline by the synergistic effect of photocatalysis and persulfate-based advanced oxidation process, Chem. Eng. J., 406, 126844.
-

- 22. Tan, Z., Yuan, S., Hong, M., Zhang, L., and Huang, Q., 2020, Mechanism of negative surface charge formation on biochar and its effect on the fixation of soil Cd, J. Hazard. Mater., 384, 121370.
-

- 23. Wang, M. and Liu, X., 2021, Applications of red mud as an environmental remediation material: A review, J. Hazard. Mater., 408, 124420.
-

- 24. Wang, Z., Shao, Y., Gao, N., and An, N., 2018, Degradation kinetic of dibutyl phthalate (DBP) by sulfate radical- and hydroxyl radical-based advanced oxidation process in UV/persulfate system, Sep. Purif. Technol., 195, 92-100.
-

- 25. Wen, T., Wang, J., Yu, S., Chen, Z., Hayat, T., and Wang, X., 2017, Magnetic Porous Carbonaceous Material Produced from Tea Waste for Efficient Removal of As(V), Cr(VI), Humic Acid, and Dyes, ACS Sustain. Chem. Eng., 5(5), 4371-4380.
-

- 26. Wu, W., Zhu, S., Huang, X., Wei, W., and Ni, B.-J., 2021, Mechanisms of persulfate activation on biochar derived from two different sludges: Dominance of their intrinsic compositions, J. Hazard. Mater., 408, 124454.
-

- 27. Xiong, Z., Jiang, Y., Wu, Z., Yao, G., and Lai, B., 2021, Synthesis strategies and emerging mechanisms of metal-organic frameworks for sulfate radical-based advanced oxidation process: A review, Chem. Eng. J., 421(2), 127863.
-

- 28. Yu, J., Tang, L., Pang, Y., Zeng, G., Wang, J., Deng, Y., Liu, Y., Feng, H., Chen, S., and Ren, X., 2019, Magnetic nitrogen-doped sludge-derived biochar catalysts for persulfate activation: Internal electron transfer mechanism, Chem. Eng. J., 364, 146-159.
-

- 29. Zhao, G., Zou, J., Chen, X., Liu, L., Wang, Y., Zhou, S., Long, X., Yu, J., and Jiao, F., 2021, Iron-based catalysts for persulfate-based advanced oxidation process: Microstructure, property and tailoring, Chem. Eng. J., 421(2), 127845.
-

- 30. Zheng, X., Niu, X., Zhang, D., Lv, M., Ye, X., Ma, J., Lin, Z., and Fu, M., 2022, Metal-based catalysts for persulfate and peroxymonosulfate activation in heterogeneous ways: A review, Chem. Eng. J., 429, 132323.
-

 This Article
This Article
-
2022; 27(1): 31-38
Published on Feb 28, 2022
- 10.7857/JSGE.2022.27.1.031
- Received on Dec 1, 2021
- Revised on Dec 6, 2021
- Accepted on Feb 17, 2022
 Services
Services
Shared
 Correspondence to
Correspondence to
- Hocheol Song
-
Department of Environment and Energy, Sejong University, Seoul 05006, South Korea
- E-mail: hcsong@sejong.ac.kr