- Hydrogeochemistry and Microbial Community Structure of Groundwater in an Agricultural Area
Dong-Hun Kim1*·Yong Hwa Oh2·Bong-Joo Lee1·Jung-Yun Lee1
1Groundwater Environment Research Center, Climate Change Response Division, Korea Institute of Geoscience and Mineral Resources, Daejeon 34132, Republic of Korea
2Department of Convergence Study on the Ocean Science and Technology, Korea Maritime and Ocean University, Busan 49112, Republic of Korea- 농업지역 지하수의 수리지화학 및 미생물 군집 구조 분석
김동훈1*·오용화2·이봉주1·이정윤1
1한국지질자원연구원 기후변화대응연구본부 지하수환경연구센터
2한국해양대학교 해양과학기술전문대학원 해양과학기술융합학과This article is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
This study evaluated the potential threat of agricultural and human activities to groundwater in the Noseong stream watershed, a typical agricultural area, through hydrogeochemical characteristics and microbial community analyses. The groundwater in the study area was Ca-SO4 and Ca-HCO3 types alluvial aquifer mainly used for agricultural and living purposes, and contained high levels of NO3- and Cl- ions generated from anthropogenic sources such as fertilizer, livestock wastewater, and domestic sewage. Proteobacteria was most abundant in all samples with an average of 46.1% while Actinobacteria, Bacteroidetes, and Cyanobacteria were dominant on an occasional basis. The prevalence of aerobic bacteria such as the genus Mycobacterium, Flavobacterium, and Sphingomonas suggests that groundwater was well connected with the surface layer. The potential pathogen Mycobacterium was detected in most samples, and other pathogenic bacteria were also widely distributed, indicating the vulnerability to contamination. Therefore, an integrated management system is required to secure the sustainable use of groundwater in agricultural areas with high groundwater dependence.
Keywords: Groundwater, Hydrogeochemistry, Microbial community, Pathogenic bacteria, Agricultural area
최근 발생되는 이상기후의 영향으로 세계적으로 물 부족현상이 대두되고 있으며, 우리나라 또한 물 스트레스 국가로 분류되고 있다(UN Water, 2018). 지하수는 인간이 사용 가능한 담수 중 그 양이 가장 많은 규모를 차지하고 있으며 전 세계적으로 식수의 50%, 관개용수의 40%, 산업용수의 30%를 담당하고 있다(Lall et al., 2020). 그러나 물 사용에 대한 경쟁이 심화되고 물 부족이 증가됨에 따라 전 세계적으로 많은 지역에서 식량 생산을 위한 물이 비효율적으로 사용되고 있다. 특히, 광역상수도가 공급되지 않는 농촌지역에서는 농업용수, 공업용수 및 생활용수의 대부분을 지하수에 의존하고 있어 향후 기후변화로 인한 극단적인 가뭄과 농업형태의 변화 등 지하수의 의존도는 가속화될 전망이다(Lall et al., 2020).
지하수 의존도가 높은 농촌지역에서는 주로 비용부담이 적은 천부관정을 설치하여 사용하고 있으며, 이러한 천부지하수는 강우 등 지표수 함양에 의해 지하수가 잘 보충되지만 동시에 수질 오염에도 민감한 특성을 가지므로 인간활동에 의해 수질 오염이 용수 공급에 큰 문제가 되고 있다. 농촌지역 지하수 오염의 주 원인은 농업활동, 축산업, 산업활동 등 인간 활동에 의해 생성된 오염원에 의한 것이 대부분이며 이러한 인간활동에 의해 생성된 다양한 오염원의 영향이 지하수 내에 복합적으로 나타나고 있는 것으로 알려져 있다(Ko et al., 2008). 농촌지역의 지하수 오염은 주로 질산성 질소에 의해 일어나며 이러한 오염원의 배출원으로는 화학비료, 시비, 축산폐수의 유출, 정화조 시스템으로부터의 유출, 토양의 유기질소 등이 있다(Lee et al., 2017; Yoon et al., 2020). 연구지역인 논산시의 경우 마을상수도 13 - 21%가 먹는 물 수질기준을 초과한 것으로 나타났으며 주요 오염성분은 질산성 질소, 탁도, 총대장균, 일반세균 등으로 조사되었다(Ko et al., 2008).
지하수를 포함하고 있는 지층인 대수층의 생태에 대한 정보는 생지화학적 순환, 지하수 수질의 결정, 그리고 오염된 대수층의 수질을 회복하는 수단으로써 매우 중요하다. 최근 지하수 수질에 대한 관심의 증가로 인해 지하수 내 미생물에 대한 인식이 증가하였고 현장의 지하수 또는 환경 조건을 반영하는 microcosm 연구를 통해 미생물 군집과 오염 물질의 농도, 지화학적 변수의 상관관계를 조사하는 연구가 활발히 수행되고 있다(De Vet et al., 2011; GRIEBLER and LUEDERS, 2009; Hassan et al., 2015; Kim et al., 2020; Korbel et al., 2017; Lee et al., 2018; Sang et al., 2018; Spanevello and Patel, 2004; Zeng et al., 2017; Zhang et al., 2016). 농업지역 지하수에서 질산염과 황산염 오염 발생원을 판단하기 위하여 수리지화학적 및 미생물학적 접근을 통해 질산염과 황산염 농도가 높은 시료에서 탈질과 황산염 환원 관련 세균이 많이 발견되었으며(Kim et al., 2015), 소규모 농업 집수 구역에서 제초제와 질산염의 확산에 따른 미생물 군집이 지하수 시료의 이온 조성과 유형이 유사하더라도 수직적/수평적 규모에서 상당한 변화가 있다는 연구도 보고되었다(Janniche et al., 2012).
최근 관개 용수와 관련된 식중독과 같은 수인성 질환이 급격히 발생하고 있다. 농산물의 식중독 세균 오염 경로는 가축 분뇨, 미부숙 퇴비, 오염된 토양, 농업용수, 작업자 등으로 알려져 있으며, 이 중 농업용수는 농산물의 재배 과정 중에 작물의 가식부위에 직접 닿을 수 있기 때문에 식중독 세균의 교차 오염원이 될 수 있다(Van Der Linden et al., 2014). 대표적인 농업용수로 인한 농산물의 식중독 세균 오염 사례로 미국 로메인 상추와 토마토, 스웨덴에서 발생한 양상추의 장출혈성 대장균(E. coli O157) 오염 등이 있으며(Allende and Monaghan, 2015; Pagadala et al., 2015), 국내의 경우 식중독 사고 중 67%가 채소류에 의한 것으로 보고되었다(식품의약안전처, 2021). 따라서 미국, 캐나다, 호주 등의 국가에서는 농산물의 안전성 향상을 위해 농업용수의 미생물 안전기준을 설정하여 유해미생물 관리를 강화하고 있지만(Uyttendaele et al., 2015), 국내의 경우 농업용수의 유해미생물 오염에 대한 조사는 미비한 실정이다. 따라서 농산물의 안전성 확보를 위해 지속적인 농업용수 유해미생물 오염실태 파악과 미생물학적 위해성 연구가 필요하다.
농촌지역에서는 상수원, 생활용수 및 농업용수원으로써 지하수에 대한 의존도가 매우 크다. 따라서 인간 활동에 의한 지하수 오염 특성을 파악하고 오염 가능성을 예측하여 사전에 오염을 예방할 수 있는 통합적인 관리 방안이 반드시 필요하다. 이러한 관점에서 본 연구는 농업활동이 활발하고 음용수, 생활 용수 및 농업용수로 이용되고 있는 노성천 유역 지하수의 잠재적 위험성을 평가하기 위해 수질 및 미생물학적 특성 분석을 수행하였다.
2.1. 연구지역
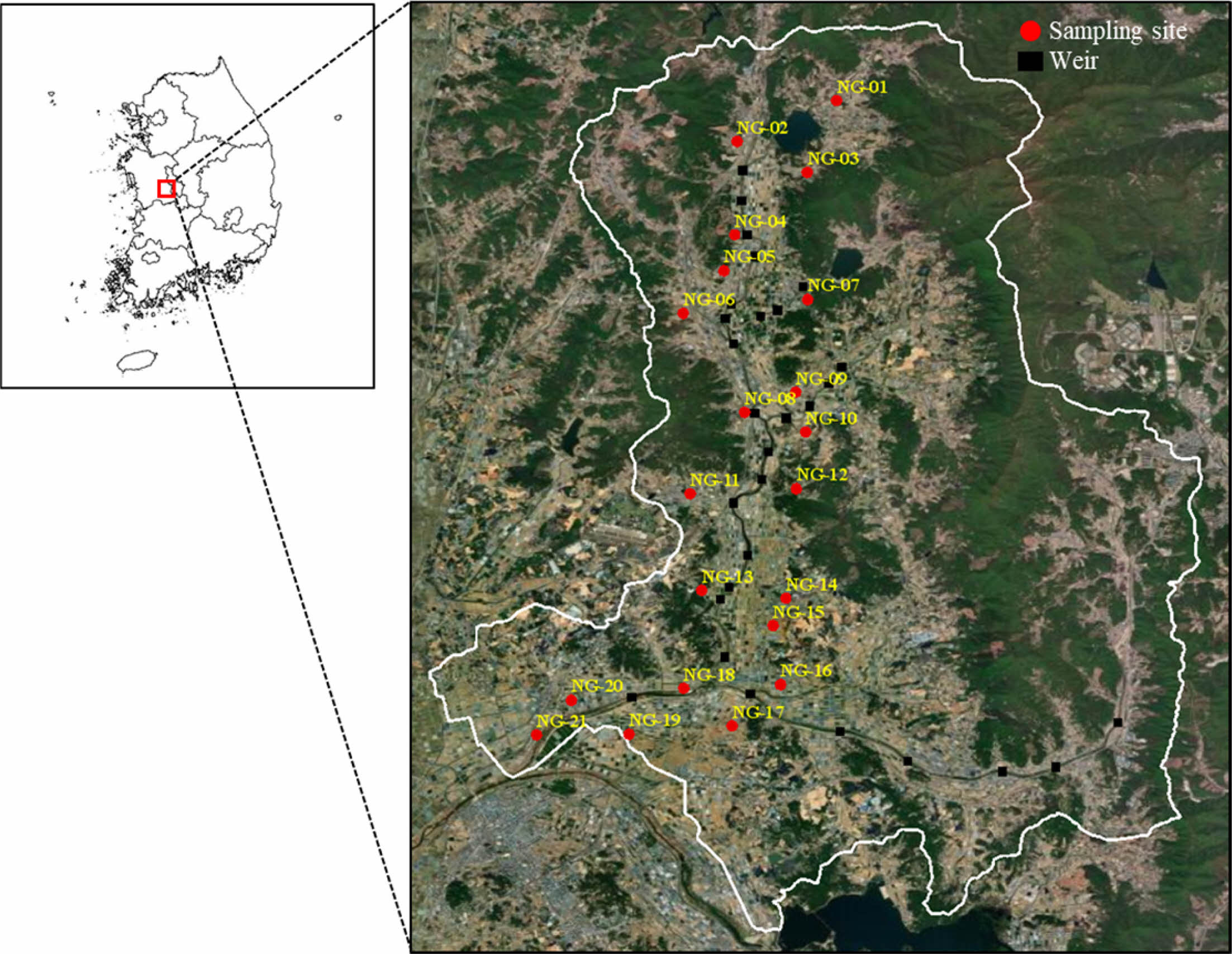
연구지역은 충청남도 공주시와 논산시를 지나는 노성천 유역으로 최근 30년간 연평균 기온과 강수량은 각각 12.2oC와 1349.2 mm이다. 연구지역은 전형적인 농촌지역으로 토지의 대부분이 농지로 사용되고 있으며 초지, 임목지 등을 포함하는 기타 토지이용, 도시 및 주거지의 순으로 이용되고 있다(KIGAM, 2019). 연구지역의 지질은 선캄브리아기 편마암과 옥천층군, 쥬라기 화강섬록암과 일부 백악기 화산암 등으로 구성되며 충적층의 깊이는 대략 20 - 30 m 사이의 범위를 보인다(Cho et al., 2012; KIGAM, 2019; Kwon et al., 2017; Oh et al., 2021). 논산 지역을 가로지르는 노성천은 길이 약 20 km, 폭 5 - 30 m, 평균 수심 0.3 m로 총 면적은 약 200 km2이며 다양한 지류로 구성된다(Fig. 1). 노성천에는 여러 개의 보가 중앙에 설치되어 있어 상류의 수위를 일정하게 유지시켜줄 뿐만 아니라 농사에 필요한 용수의 공급원으로도 사용된다. 특히 평야가 발달한 하류 지역에서는 겨울철 시설재배의 냉기 피해를 줄이기 위해 지하수를 이용한 수막재배가 집중적으로 이뤄지고 있으며 이로 인해 지하수위가 심각하게 하강하는 문제가 발생하고 있다(Cho et al., 2012; Kwon et al., 2020).
2.2. 시료 채취
본 연구를 위한 시료는 2018년 4월에서 6월 사이에 논산에 위치한 21개 지하수 관정에서 채취하였다(Fig. 1). 지하수의 현장 수질(수온, 전기전도도, pH, 용존산소, 산화환원전위)은 휴대용 수질측정장비(Multi 3620 IDS, WTW, Germany)를 이용하여 시료 채취 직전에 측정하였다. 지하수 시료는 현장 수질이 안정될 때까지 지하수를 purging 한 뒤 채취하였다. 지하수 중 주요 용존 양이온(Ca2+, Mg2+, Na+, SiO2(aq), K+), 용존 음이온(Cl-, SO42-, NO3-, HCO3-) 농도, 미생물 군집 분석을 위한 시료를 채취하였다. 주요 용존 양이온과 용존 음이온 분석을 위하여 시료를 0.45 μm membrane filter(Advantec, Japan)를 이용하여 부유물질을 제거한 후 각각 30 mL를 폴리에틸렌 용기에 채취하였다(Jeong et al., 2015). 용존 양이온 시료의 경우, 용기 벽면 흡착과 침전을 방지하기 위해 현장에서 질산(HNO3)을 첨가하여 pH를 2 이하로 유지하였다(Jeong et al., 2015). HCO3- 시료의 경우, 125 mL 폴리에틸렌 용기를 이용하여 시료를 채취하였다. 미생물 군집 분석을 위해 시료 2 L를 무균 채수병에 채취하였고 냉장 상태(4oC)를 유지하며 실험실로 운반하였다.
2.3. 주요 용존 이온 분석
지하수 시료의 주요 용존 양이온과 용존 음이온 농도는 각각 유도결합 플라즈마 분광광도계(ICP-OES; Optima 7300 DV; Perkin Elmer, USA)와 이온크로마토그래피(IC; ICS-1500; Dionex, USA)를 이용하여 측정하였다. HCO3- (total alkalinity) 농도는 자동적정기(T50 Titrator; Mettler-Toledo, USA)를 이용하여 측정하였다. Ca2+, Mg2+, Na+, SiO2(aq), K+, Cl-, SO42-, NO3- 농도의 detection limit은 각각 0.02, 0.1, 0.1, 0.06, 0.01, 0.01, 0.05, 0.04 mg/L이다.
2.4. DNA 추출 및 염기서열 분석
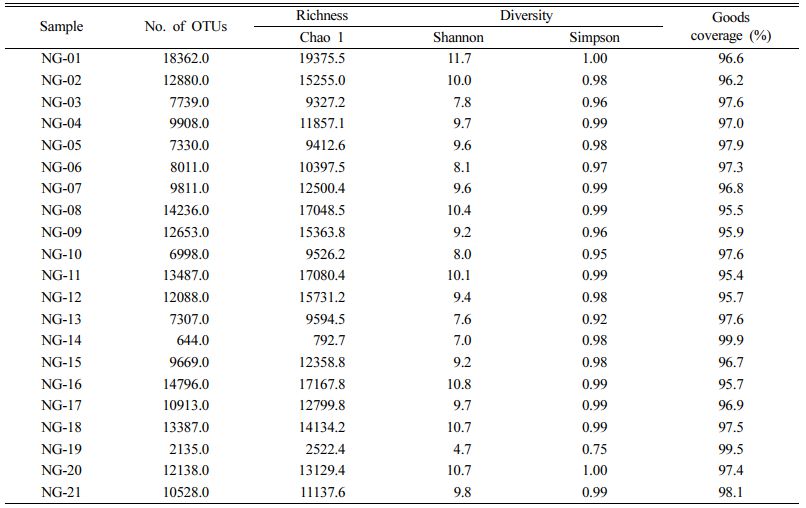
염기서열 분석을 위하여 채취한 시료를 0.22 mm membrane filter(Advantec, Japan)를 사용해 여과한 후 필터는 -20oC에 보관한 뒤 DNA 추출에 사용하였다. 미생물의 genomic DNA(gDNA)는 여과된 필터로부터 DNeasy PowerWater Kit(Qiagen, USA)를 이용하여 제조사의 방법에 따라 추출하였다. 차세대염기서열분석(next-generation sequencing, NGS)은 Macrogen Inc.(Korea)의 Miseq(Illumina, Inc.) 장비를 이용하여 미생물의 16S ribosomal RNA(16S rRNA) 유전자의 V3 - V4 영역을 대상으로 제조사의 방법에 따라 수행하였다. NGS 결과로 얻어진 염기서열들은 CD-HIT-OUT(Li et al., 2012)를 사용하여 저품질 서열과 모호한 서열, 키메라 서열 등을 제거하고, 97% 이상의 서열 유사도를 바탕으로 군집화하여 종 수준의 OUT(operational taxonomic units)를 선별하였다. 각 OUT의 대표 서열은 RDP(Ribosomal Database Project)에 UCLUST(Edgar, 2010)을 이용하여 수행하였다. 미생물 군집의 종 다양성과 균등도, 샘플 간 유사도 등은 QIIME version 1.9.1(Caporaso et al., 2010)을 이용하여 수행하였다.
|
Fig. 1 Sampling locations of groundwater wells in the study area (Noseong stream watershed). |
3.1. 현장 수질
기본적인 지하수 특성 조사를 위해 지하수의 현장 수질을 측정하였다(Table 1). 연구지역 지하수 수온은 14.4 - 22.3oC 범위로 평균 16.7oC로 나타났으며 대체적으로 고도가 낮아지는 하류 지역으로 갈수록 온도가 높아지는 경향을 보였다. 전기전도도(EC)는 130.7 - 780.0 μS cm-1(평균 318.4 ± 160.3 μS cm-1) 범위의 값을 보였으며 하류 지역으로 갈수록 점차 증가하는 경향을 보였다. EC 값은 지하수의 유동속도 및 지질특성, 오염 여부와도 관련이 있으나 충적 관정에서는 일반적으로 농경 활동에 의한 오염 가능성을 시사하므로 이러한 현상은 노성천 하류 지역에서의 활발한 농업활동에 의한 영향으로 판단된다. 평균 pH는 6.5이며 5.2 - 7.3 범위로 나타났다. 연구지역의 pH는 약산성의 특징을 보이는데, 이는 시료 채취 기간을 고려했을 때 농업으로 살포된 축산 분뇨와 비료 성분에서 침출되는 암모늄 이온의 질산화 작용에 의한 것으로 예상된다(Hlavinek et al., 2008). 용존산소와 산화환원전위의 경우 각각 0.0 - 9.1 mg/L와 -68.4 - 308.1 mV의 범위를 보였다. 대체적으로 연구지역 내 지하수 관정에서는 높은 용존산소 농도와 산화환원전위 값을 보였는데, 이는 조사된 관정들이 대부분 심도 100 m 이하의 천부 지하수 관정(평균 30 m)이며 주로 생활용 및 농업용으로 사용되고 있어 지하수 사용량이 많다는 점을 고려할 때, 주변의 물과 공기와의 접촉에 의한 영향으로 판단된다. 특히, 농업용 관정의 경우 통상적으로 많은 용수 확보를 위해 상부의 미고결부에도 스크린 처리하는 방법으로 설치하므로 상부의 지표수 유입 영향을 크게 받을 수 있다(Moon et al., 2008). 연구지역의 경우 과도한 지하수 사용으로 인한 최대 5 m 정도의 지하수위 감소로 인해 주변 하천(노성천)의 지표수가 지하수로의 유입이 관측되기도 하였다(Kwon et al., 2020).
3.2. 용존 이온 분포특성
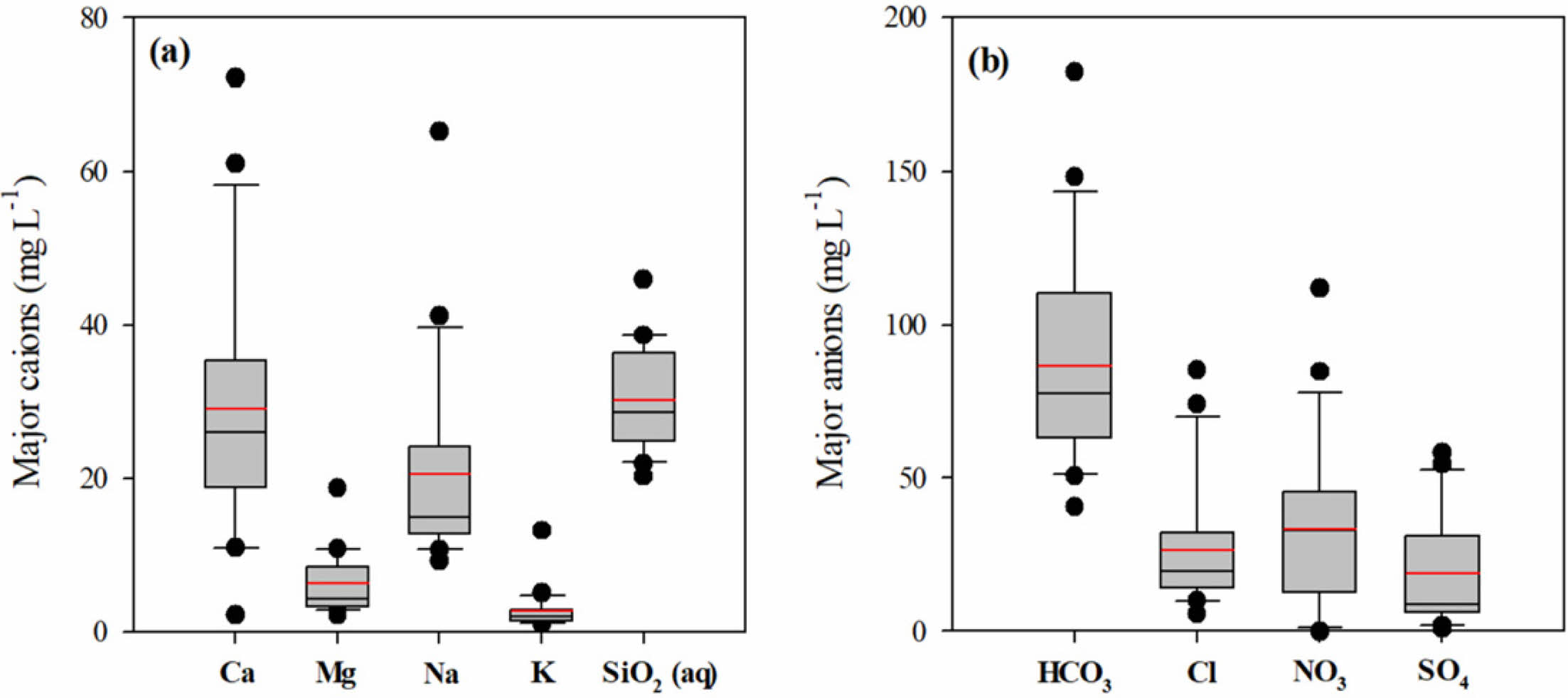
연구지역에서 채취된 지하수 중 주요 용존 양이온과 용존 음이온 농도의 통계적 분석 결과는 box-whisker plot으로 나타냈다(Fig. 2). 또한 연구지역 지하수의 수질특성을 평가하기 위하여 상관분석을 수행하였다(Table 2). 전반적으로 양이온의 농도는 Ca2+ > Na+ > Mg2+ > K+ 순으로 함량이 높게 나타났고 음이온의 경우 HCO3- > NO3- > Cl- > SO42- 순으로 높게 나타났다. 일반적으로 지하수에 용존되어 있는 Ca2+는 탄산염광물(방해석 또는 백운석)의 용해나 퇴적암내에 존재하는 석고나 경석고, 또는 사장석의 용해에 의해 주로 공급되며 인위적 활동에 의해서도 지하수에 용존될 수 있다(Hounslow, 2018). 연구지역의 용존 Ca2+는 2.2 - 72.2 mg/L의 광범위한 농도 범위를 보이며 HCO3-, SO42-와 각각 0.49, 0.55의 상관계수를 보이는 반면 Cl-, NO3-와는 각각 0.86과 0.78의 상관계수 값을 보인다. 따라서 연구지역의 용존된 Ca2+의 함량은 지질기원과 더불어 인위적 유입의 가능성을 고려할 수 있다. 지하수 내 Na+ 성분은 주로 사장석의 용해로부터 이루어지나, 생활하수 등과 관련된 오염물질로부터 유래되기도 한다. 용존된 Na+ 함량은 9.2 - 65.2 mg/L의 농도 범위를 보이며 지질특성을 반영하는 HCO3-와의 상관계수가 0.69를 보이는 반면 인위적 오염으로 부화되는 NO3-와의 상관계수는 0.18로 매우 낮은 경향성을 보이므로 인위적 오염보다는 지질특성에 기반한 것으로 판단된다. 백운암 또는 Mg 산화광물이나 규산염 광물의 용해에 의해 지하수에 용존되는 Mg2+의 경우 Ca2+와 유사하게 지질 기원과 인위적 오염원의 유입을 통해 지하수에 용존된 것으로 예측된다. 지하수 내 K+는 대부분 광물의 용해작용으로 의한 것으로 2 mg/L 이하로 존재한다(Saether and De Caritat, 1996). 연구지역의 K+는 평균 2.7 mg/L (1.1 - 13.2 mg/L)로 전형적인 지하수 K+ 농도를 초과하고 있어 인위적 요인에 의해 지하수에 용존되었을 가능성이 있다.
연구지역의 질산염 평균 농도는 33.2 mg/L(0 - 111.9 mg/L)로 먹는 물 수질기준을 초과하고 있었으며, 용도에 따라 농업용 관정 20.3 mg/L(n=7), 개인용 관정 45.6 mg/L(n=9), 공공 관정에서 29.0 mg/L(n=5)의 평균값을 보였다. 질산염(NO3-)이나 염소(Cl-)의 농도가 황산염(SO42-)의 농도에 비해 높은 것은 인위적 오염의 가능성을 시사한다(Kim et al., 2002; Yang et al., 2015). 자연상태 지하수의 질산염 농도는 2 mg/L 이하이며 최대 13.3 mg/L 정도로 그 이상의 농도는 인위적 오염원으로부터 유입을 의미하므로 연구지역 전반에 걸쳐 농업활동에 의한 지하수 오염이 상당히 진행되고 있는 것으로 판단된다(Mueller and Helsel, 1996). 연구지역의 경우 전형적인 농촌지역으로 화학비료, 분뇨, 축산폐수, 생활오수 등 다양한 오염요인들이 많을 뿐만 아니라 퇴비 사용량이 많아 토양 및 지하수 오염을 일으킬 가능성이 높은 딸기 등의 작물을 재배하는 시설영농(비닐하우스)에 넓게 분포하고 있는 특징이 있다. 실제로 연구지역의 마을 상수도 수질 모니터링에 의하면 먹는 물 수질 기준을 초과하는 항목 중 질산성 질소가 차지하는 비율이 높고 지속적으로 유지되고 있음을 보여주었다(Ko et al., 2008). 연구지역의 경우 질산염의 농도가 매우 광범위하게 분포하는 특징을 보이는 것으로 보아 다양한 경로를 통한 질산염 오염이 일어나고 있는 것으로 판단되며, 상대적으로 농도가 낮은 일부 지역(NG-09, 14, 18, 21)의 경우 환원 환경에서 미생물에 의한 탈진 반응이 영향을 미쳤을 것으로 판단된다. Cl- 이온은 생활하수, 동물 배설물, 유기물 분해 산물로 환경에 배출되는 물질로 알려져 있으며 대수층 내에서 수리지질학적 영향에 의해 침전, 흡착, 그리고 미생물에 의한 저감 반응이 거의 나타나지 않기 때문에 다양한 환경 추적자로 많이 사용되고 있다(Stites and Kraft, 2001). 연구지역의 경우 Cl-은 5.7 - 85.2 mg/L의 범위로 평균 26.5 mg/L 농도를 보이며 전반적으로 농업활동이 왕성한 하류지역으로 갈수록 농도가 증가하는 경향을 보인다. 인위적 오염의 지표인 Cl-과 NO3-의 관계를 살펴보면 상관계수 0.672의 높은 상관관계를 보인다. 해수에 의한 침입을 배제한 Cl-의 존재는 대부분 제빙 용제, 생활폐수, 가축분뇨 및 비료의 사용과 같은 인위적 오염에 기인될 수 있다(Sherwood, 1989; Stites and Kraft, 2001). 황산염의 경우 기반암에 포함되어 있는 황화광물의 산화반응이나 석고(gypsum)와 같은 황산염 광물의 용해에 의해 증가될 수도 있다. 연구지역 지하수의 경우 Ca2+ 함량이 SO42- 함량 증가에 따라 비례적으로 증가하는 경향을 보여주어 지하수내 SO42-의 기원으로 황산염광물의 용해 가능성이 높음을 지시하지만, 천부대수층 지하수내에 높은 농도로 나타나는 황산염(SO42-) 농도는 일반적으로 화학 비료, 퇴비 및 생활하수 등 인간 활동에 의해 생성되는 오염물질로 알려져 있다. 일반적으로 지하수의 오염취약성은 오염물질의 부하와 지하수위에 밀접한 상관성을 보여주는데, 연구지역의 경우 낮은 고도와 대부분 30 m 이하의 충적 관정이며, 주로 농경지나 인가가 분포하고 있어 지하수가 농경활동이나 생활하수에 영향을 크게 받고 있는 것으로 판단된다.
3.3. 수질 유형 특성
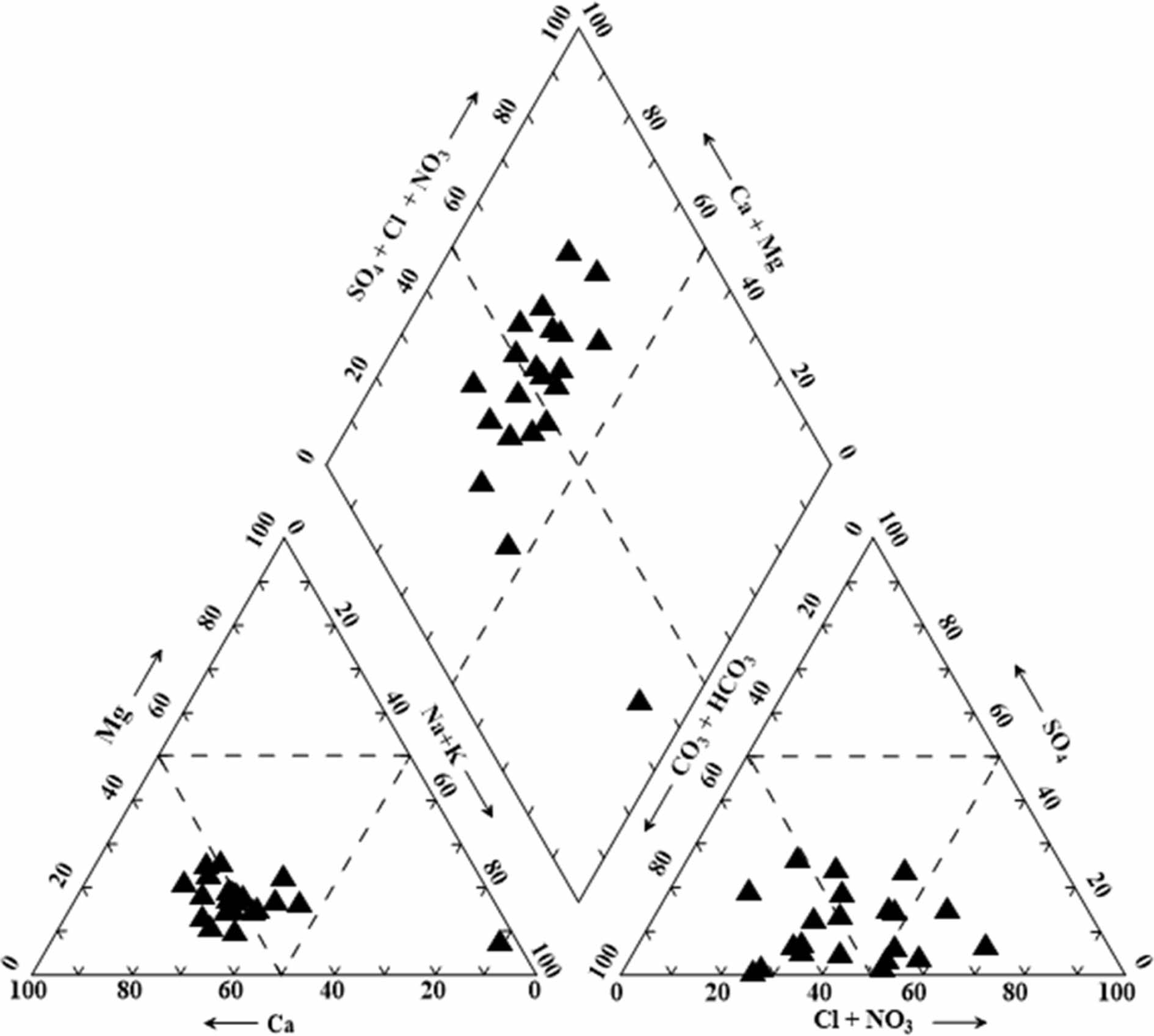
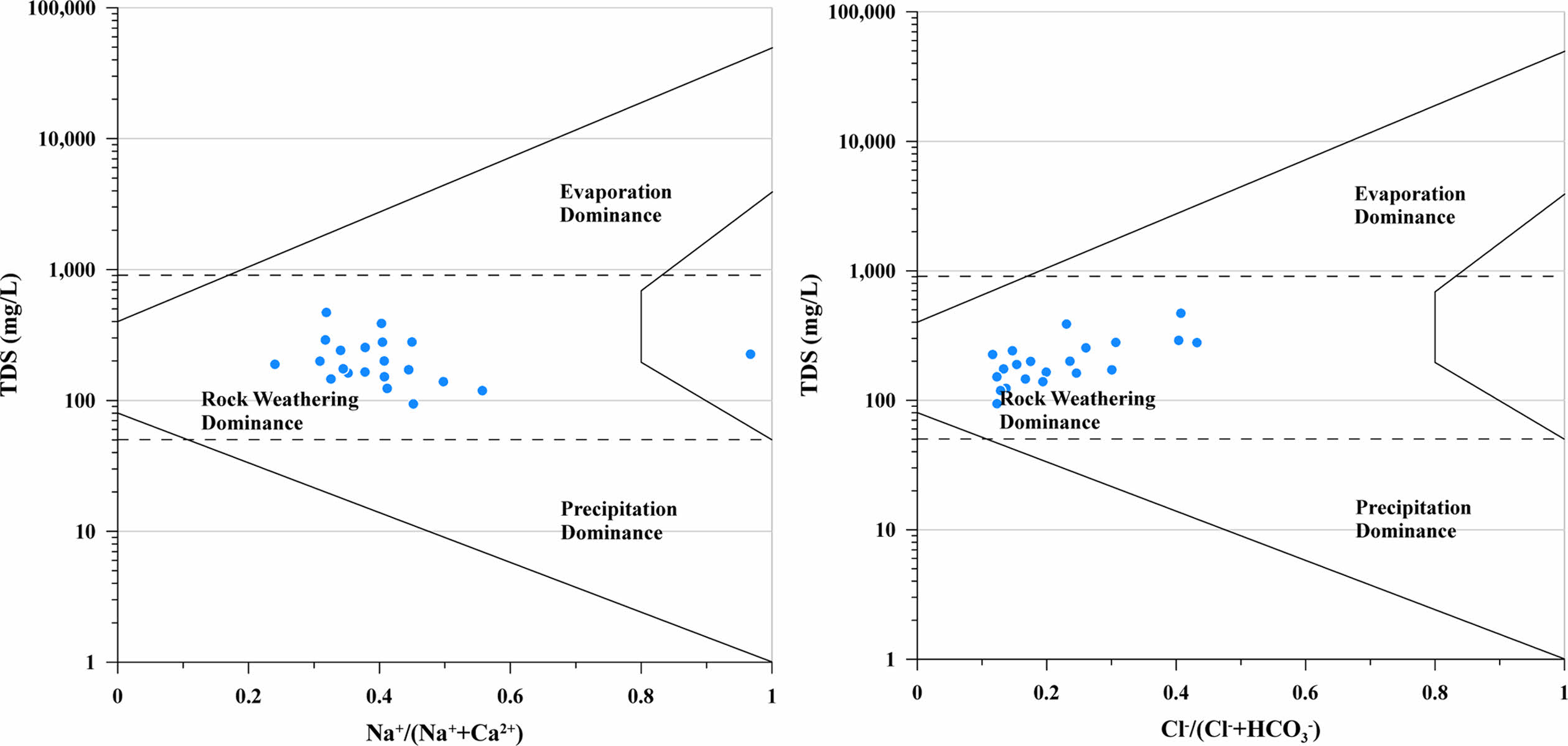
연구지역의 지하수 수질 유형을 파악하기 위해 주요 용존 이온 성분을 Piper diagram(Piper, 1944)에 도시하였다(Fig. 3). 연구지역의 지하수는 Ca-HCO3형에서부터 Ca-SO4형까지의 영역에 속하며 일부 시료는 Na-HCO3형에 속함을 알 수 있다. 전체 지하수 시료의 57%(n=12)는 Ca-SO4 유형으로 분류되었으며 이는 사장석 또는 황화광물에서 기인한 것으로 판단된다. 지하수 시료의 38%(n=8)는 화강암 지하수의 수질화학적 특성을 나타내는 Ca-HCO3 유형에 도시되었다. 특히, 최하류에 위치한 NG-21 관정의 경우 물-암석 반응에 의해 형성되는 Na-HCO3 유형을 보이는데 사장석과 지하수와의 반응 및 양이온 교환 기작에 의해 형성되었을 것으로 판단된다. 다만, Na의 농도(65.2 mg/L)가 다른 지하수 시료에 비해 현저히 높기 때문에 지질학적 영향 이외에 노성천 하류지역에서의 활발한 농업활동과 생활하수로 인한 오염에 의한 영향도 가능할 것으로 판단된다. 또한, 연구지역 지하수의 수리화학 특성을 결정하는 인자를 이해하기 위해 Gibbs diagram(Gibbs, 1970)으로 도시하였을 때, 모든 시료가 중간 영역에 도시되어 연구지역의 지하수는 대부분 기반암의 풍화에 의해 결정되는 것으로 판단된다(Fig. 4).
3.4. 미생물 군집 분석
노성천 주변 지하수 내 미생물 군집의 다양성 분석을 위하여 염기서열 분석을 수행하였다. 분석 결과 21개의 시료로부터 저품질 서열, 모호한 서열과 키메라 서열을 제외하고 2,963,561개의 염기서열을 얻었으며 각 시료당 115,000개의 염기서열을 동일하게 추출하여 분석을 수행하였다(Table 3). 평균 OUT(Operational Taxonomic Unit)는 10,239.0이고, 종풍족도(richness)를 나타내는 Chao1는 12,214.9이었으며, 군집의 다양성(diversity)을 나타내는 Shannon과 Simpson index는 각각 9.2와 0.97을 나타냈다. 각 시료의 coverage 값은 평균 97% 이상으로 각 시료의 특성을 잘 반영하였다. 전체적으로 하류로 내려갈수록 다양성 지표가 점차 감소하는 경향을 보였다. 지하수는 수문학적, 화학적 및 지질학적 특성을 바탕으로 미생물이 다양하게 분포한다. 하지만, 오염이나 특정 환경이 지속됨에 따라 미생물의 다양성이 감소하게 되면 전체적인 수생태계에도 영향을 미칠 수 있다(GRIEBLER and LUEDERS, 2009).
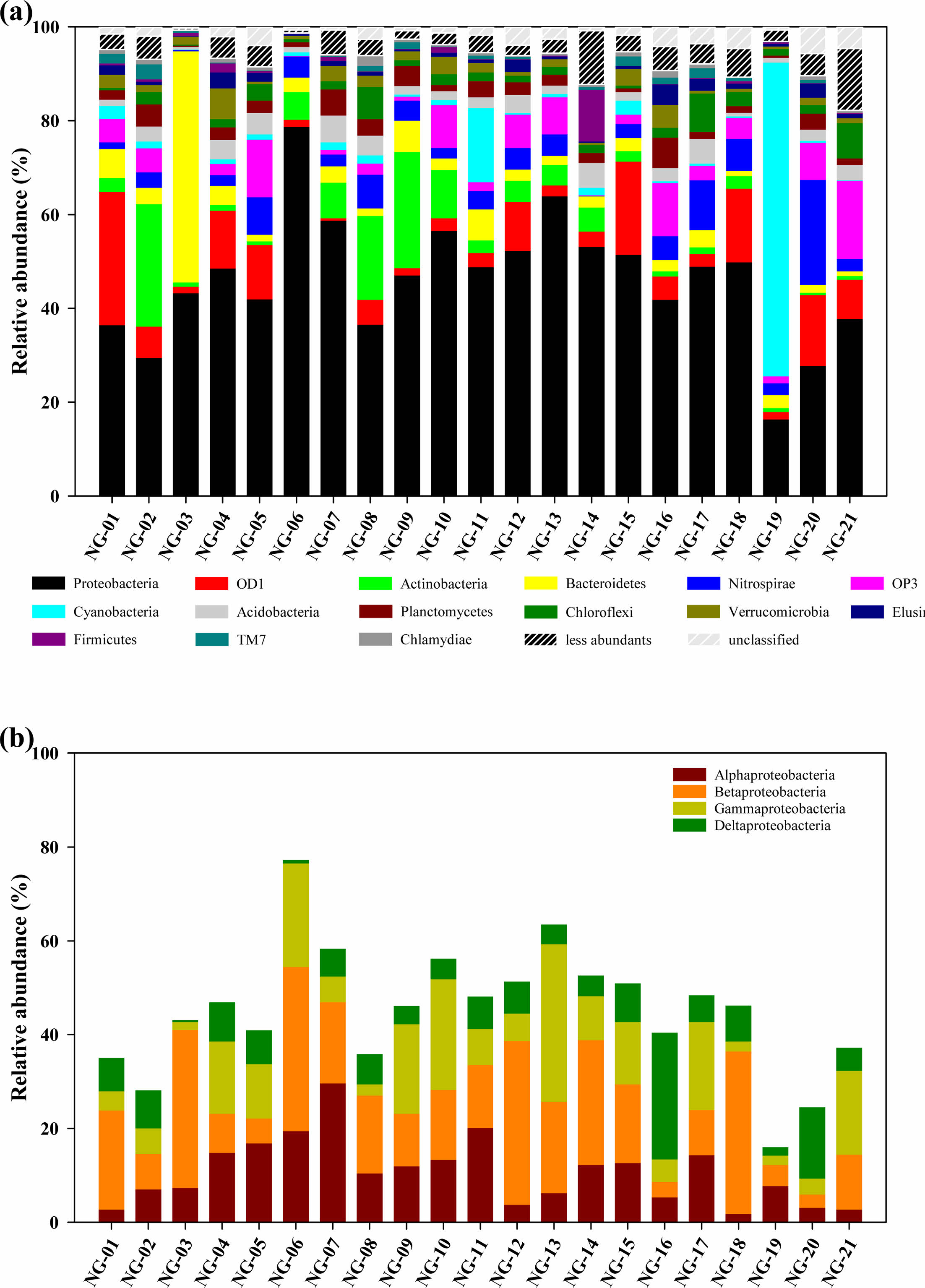
염기서열 기반 미생물 군집 분석 결과, 총 67개의 문(phylum)으로 구성되어 있고 이중 Proteobacteria가 가장 우점하고 있었으며 OD1, Actinobacteria, Bacteroidetes순으로 존재하였다(Fig. 5a). Proteobacteria는 대부분의 지하수에서 가장 많이 발견되는 문으로(GRIEBLER and LUEDERS, 2009; Lee et al., 2018; Zeng et al., 2017; Zhang et al., 2016) 전체 시료에서 평균 46.1%를 차지하고 있으며 최소 16.3%(NG-19)부터 최고 78.7%(NG-06)까지 폭넓게 분포하고 있다. OD1은 주로 무산소 환경에서 발견되는 미생물(Nelson and Stegen, 2015)로 평균 7.6%를 차지하며 NG-01 시료에서 28.4%로 가장 높은 비율을 보이고 NG-07 시료에서 0.5%로 가장 낮게 나타났다. Actinobacteria는 퇴적물에 부착되기보다는 유체에 부유하며 존재하고 심부보다 천부 지하수 시료에서 흔히 발견되는 미생물로(GRIEBLER and LUEDERS, 2009; Korbel et al., 2017; Oh Yong et al., 2020) 평균 5.9%를 차지하고 있었다. 유기물을 분해할 수 있는 Bacteroide-tes(Sang et al., 2018; Thomas et al., 2011)는 평균 5.3%로 존재하였으며 나머지 Nitrospirae, OP3, Cyanobacteria, Firmicutes 등은 평균 5% 이하로 존재하고 있었으나 NG-20 시료에서 Nitrospirae(22.4%), NG-19 시료에서 Cyanobacteria(66.9%), NG-14 시료에서 Fir- micutes(11.0%)가 높게 존재하는 특징을 보였다. 특히 Bacteroidetes는 분변오염 가능성을 지시할 수 있으며 대표적 호기성균인 Cyanobacteria의 존재는 주변 지표수의 유입에 의한 영향으로 판단된다.
시료의 가장 큰 비중을 차지하는 Proteobacteria는 강(class) 수준에서 분석해보면 Alpha, Beta, Gammaproteo- bacteria가 각각 평균 10.6(1.8-29.6), 16.6(2.8-35.0), 10.9 (1.7-33.6)%로 고르게 분포되어 있으며 Deltaproteo- bacteria는 평균 6.9(0.4 - 27.0)%를 차지하고 있다(Fig. 5b). Alphaproteobacteria는 매우 다양한 종으로 구성되어 있으며 해양 퇴적물, 빙하 또는 심부 환경과 같이 저 영양 환경에서 생존할 수 있는 특징을 갖는다(Kersters et al., 2006). 시료 전체적으로 질소고정균을 포함하는 Rhizobiales 목(평균 3.6%)과 저분자 유기물이나 수소를 전자공여체로 사용하는 purple non-sulfur bacteria를 포함하는 Rhodos- pirillales 목(1.4%), 방향족 유기물을 분해하거나 바이오필름 형성에 주된 역할을 하는 Sphingmonadales 목(3.7%) (Balkwill et al., 2006; Oh and Choi, 2019)이 전체 Alphaproteobacteria의 82%를 차지하고 있었다. 특히, 전형적인 농업지역에서 주로 발견되는 Rhizobiales 목은 질소 고정 등의 활성을 통해 토양 영양분과 관련이 있는 미생물로 토양의 건강성과 지속가능한 사용을 위해 중요한 역할을 하고있다고 알려져 있다(Wang et al., 2016). 매우 다양한 대사 기작을 지니고 있는 Betaproteobacteria 강에는 주로 혐기환경에서 산소가 포함된 철 수화물의 이가철(Ferrous ion, Fe2+)을 산화시키며 화학무기영양 성장을 할 수 있는 Gallionellales 목(5.5%)이 가장 많이 존재하고 있었다(Hallbeck and Pedersen, 2014). 이들의 혐기적 철 산화능은 철이 풍부한 지하수에서 산화철에 의한 관정 막힘의 원인이 되기도 하지만 철 또는 미량 금속의 제거에 활용될 수도 있다(De Vet et al., 2012; De Vet et al., 2011; Katsoyiannis and Zouboulis, 2006). 또한, 혐기적 또는 호기적 환경에서 다양한 방향족 유기 화합물을 분해할 수 있는 Rhodocyclales 목(1.9%)(Oren, 2014)도 중요한 부분을 차지하고 있었다. 다수의 병원성균을 포함하며 의학적으로 중요한 Gammaproteobacteria 강은 Legionellales 목과 Xanthomonadales 목이 전체적으로 고르게 분포하고 있었으며 특히, 온실가스로 알려진 메탄을 이용할 수 있는 Methylococcales 목(Orata et al., 2018)이 NC-14 시료에 높은 비율(13.60%)로 존재하고 있는 특징을 보였다. 반면, Deltaproteobacteria 강은 전체 군집에서 비교적 낮은 비율로 존재하고 있으나 NG-16 시료에 26.98%로 높게 나타나는 특징을 보였다. 비배양성균이지만 질소고정과 관련이 있는 것으로 알려진 NB1-j 목(de Voogd et al., 2015)과 생물학적 방제제로 활용 가능성이 있는 Bedellovibrionales 목(Bratanis et al., 2020), 주로 토양에 존재하며 불용성 유기물을 분해하는 Myxococcales 목(Huntley et al., 2010)이 대부분을 차지하고 있었다.
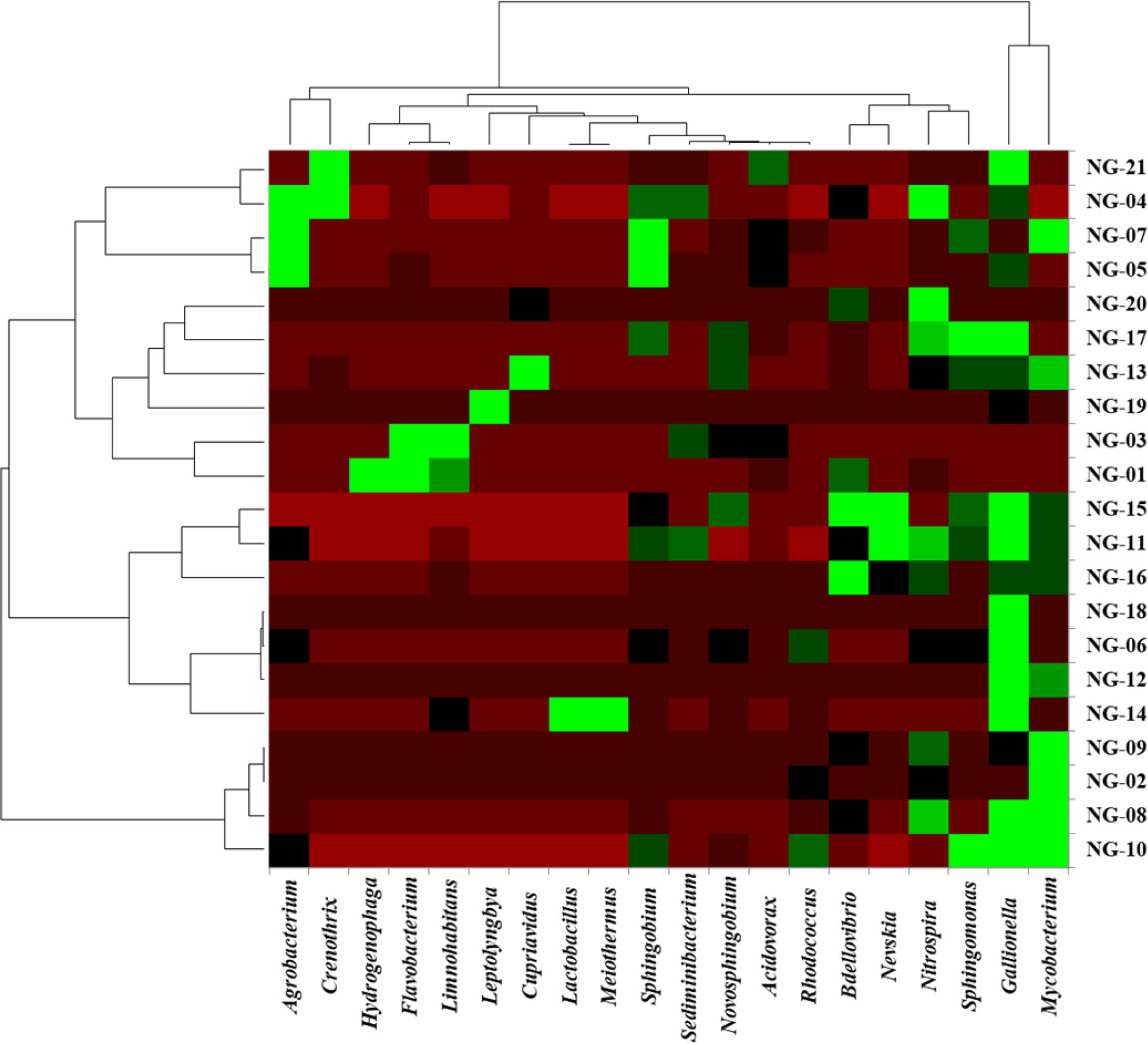
속(genus) 수준에서 시료에 따른 미생물 군집의 특성을 확인하기 위하여 가장 높은 빈도로 존재하는 상위 20개 속을 대상으로 heatmap 분석을 수행하였다(Fig. 6). 시료는 크게 3개의 그룹으로 구분되었으나 수질 특성과의 상관관계를 보이지는 않았다. 첫번째 그룹은 Agrobacterium, Sphingobium, Hydrogenophaga, Flavobacterium, Limno- habitans와 같이 대부분 담수 환경에서 주로 발견되는 호기성 미생물이 우점하는 특징으로 보아 상부 지표층의 영향을 크게 받고 있는 것으로 판단된다(Kasalický et al., 2013; Lacroix and Citovsky, 2013; Lee et al., 2015; Waśkiewicz and Irzykowska, 2014; Yoon et al., 2008). Crenothrix polyspra의 경우 철산화와 관련된 미생물로 관정 내에 갈색 응집 침전물을 만들어 지하수 사용에 문제를 일으키기도 한다(Wolfe, 1960). 또한, Crenothrix 속은 온실가스 중 하나인 메탄 산화능을 갖는 종도 존재하기 때문에 농촌지역에서 기후변화 관련 생태 연구를 위한 중요한 자료로 활용이 가능할 것이다(Stoecker et al., 2006). 두번째 그룹은 미소호기성 환경에서 용존된 이가철 이온(Fe2+)을 불용성 침전물인 수산화철(ferric hydroxide)로 산화시키는 Gallionella 속이 우점하고 있다(Pedersen, 2011). 철 산화 미생물의 경우 철 산화를 통해 관정 막힘의 원인이 되기도 하지만, 생성된 철산화물에 의해 중금속을 제거하는 기능을 할 수도 있다(Hassan et al., 2015; Kim et al., 2020). 또한 이 그룹에는 호기성 미생물인 Bdellovibrio 속과 Nevskia 속이 비교적 높은 빈도로 존재하는 관정이 있고, 호열성 미생물인 Meiothermus 속(Spanevello and Patel, 2004)과 주로 장내에 서식하며 젖산을 생산하는 통성혐기성균인 Lactobacillus 속이 발견되어 분변 오염을 고려할 수 있는 일부 관정을 포함한다(Slover and Danziger, 2008). 세번째 그룹은 주로 농업용으로 사용되는 관정을 포함하고 있으며 병원성균으로 분류되는 Mycobacterium 속이 우점하고 있는 특징을 보인다. Mycobacterium 속은 토양, 습지, 지표수, 지하수 및 해수와 같이 다양한 환경에 서식하고 있으며 흡입, 접종 및 섭취에 의해 전염되기 때문에 해당 관정에 대한 관리가 필요한 실정이다(Forbes et al., 2018; Percival and Williams, 2014; Schulze-Röbbecke, 1993).
3.5. 잠재적 병원성 미생물 분포
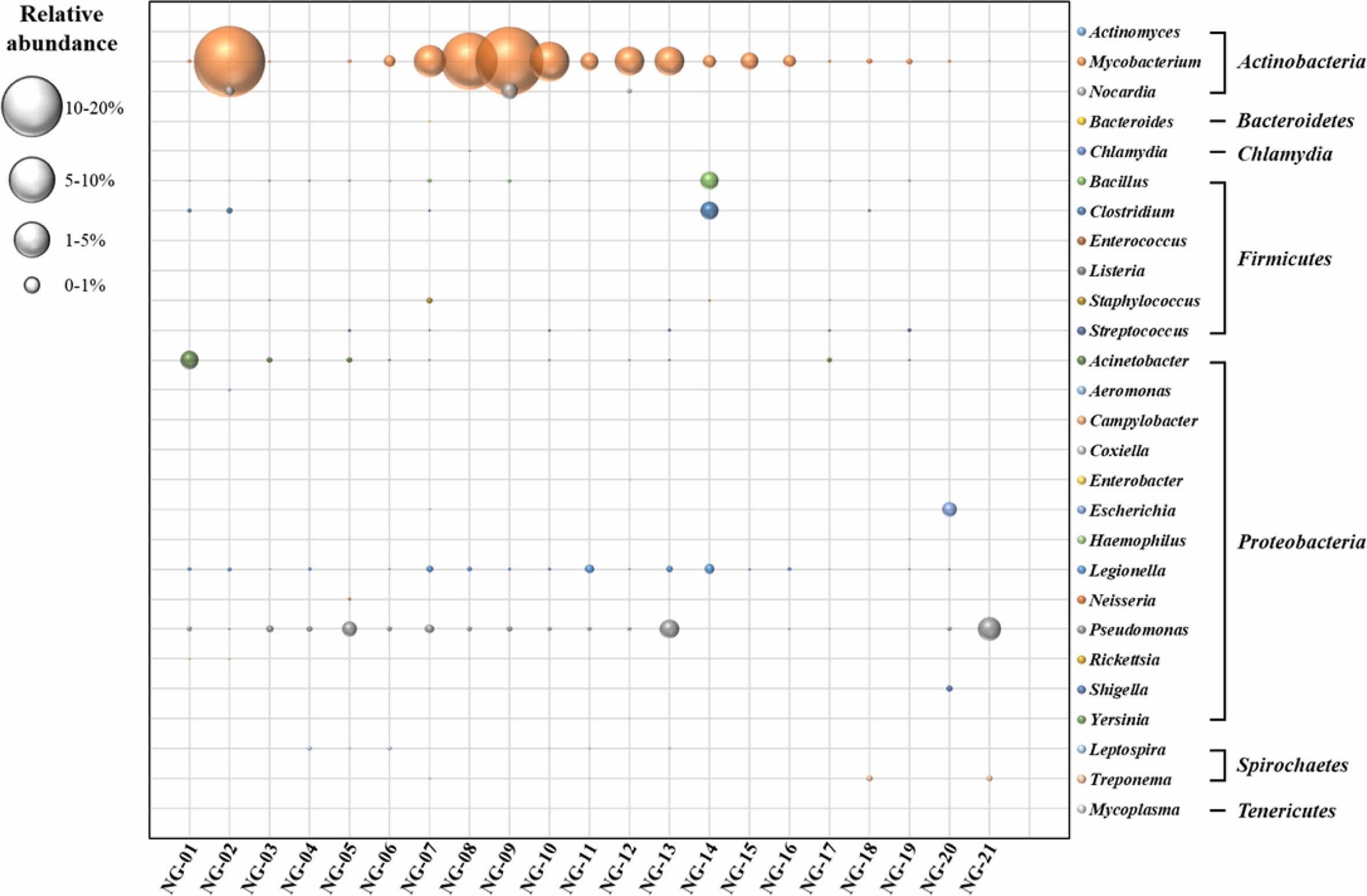
전체 2,415,000개의 염기서열을 속(genus) 수준에서 분석하였을 때, 117,931개의 염기서열(4.88%)이 잠재적 병원성 미생물 염기서열(Ghilamicael et al., 2018; Ibekwe et al., 2013)로 분류되었다(Fig. 7). 전체 27개 속 중에서 Mycobacterium 속이 평균 7.6%로 가장 높은 비율로 존재하는 것으로 확인되었으며 NG-02, NG-08, NG-09 시료에서 각각 23.34, 14.83, 21.46%로 존재하고 있었다. 이들 관정은 주로 농업용으로 사용되고 있으나 음용수로 사용하거나 작물에 직접 살포하여 바로 섭취하였을 시 감염될 가능성이 매우 높기 때문에 주의가 필요하다(Pachepsky, 2011). 특히, Mycobacterium llatzerense는 비결핵성균으로 최근 상수 시스템에서도 자주 발견되어 공중 보건 문제와 관련이 높은 것으로 보고되었다(Delafont et al., 2017). 이밖에도 수인성 질환을 일으킬 수 있는 Bacillus, Clostridium, Escherichia, Legionella, Pseudomonas, Shigella 속 등도 연구지역 전체에 광범위하게 분포하는 특징을 보였다(Kanamori et al., 2016; Ramírez-Castillo et al., 2015). 농촌 지역의 경우 지하수를 음용수로 사용하는 사례가 많으므로 농촌지역 지하수의 전반적인 수질 관리가 반드시 필요한 실정이다.
|
Fig. 2 Box and whisker plots showing statistical analysis results for the concentrations of (a) major cations (Ca, Mg, Na, K, and SiO2 (aq)) and (b) major anions (HCO3, Cl, NO3, and SO4). The edges of the boxes are the 25% and 75% quartiles and the bars indicate the 10% and 90% data spread. Red line presents the mean value and outliers are indicated by solid circles. |
|
Fig. 3 Piper diagram for the groundwater samples collected from study area. |
|
Fig. 4 Gibbs diagrams showing the ratio of TDS and Na+ /(Na+ + Ca2+) or Cl- /(Cl- + HCO3 - ) and indicating mechanisms controlling the groundwater chemistry in the study area. |
|
Fig. 5 Microbial taxonomic compositions of groundwater samples at plylum (a) and class (b) level. |
|
Fig. 6 Heatmap illustrating abundance of the OTUs at the genus level. Genera are present for top twenty OTUs those whose highest sequence abundance across the samples. Dendrograms on the vertical and horizontal axes are based on the Bray_Curtis dissimilarity matrix. |
|
Fig. 7 Relative abundance of potential pathogenic bacteria in groundwater. |
|
Table 1 Field parameters measured in this study |
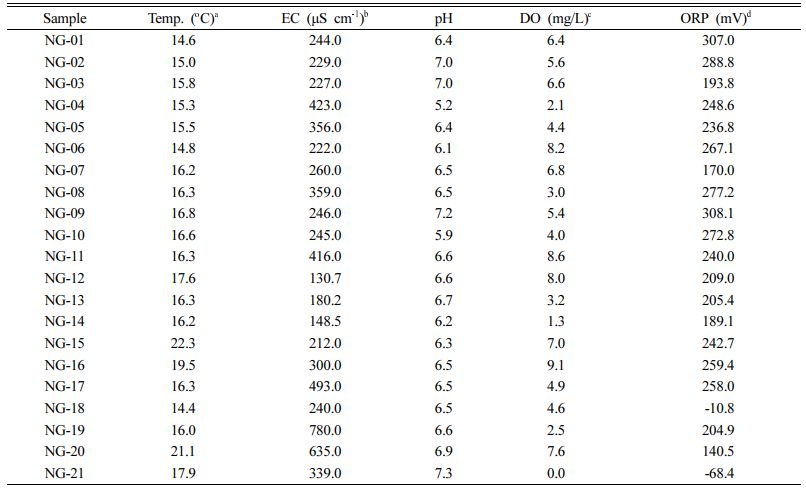
a Temperature |
|
Table 2 Pearson’s correlation matrix of groundwater hydrogeochemical parameters |
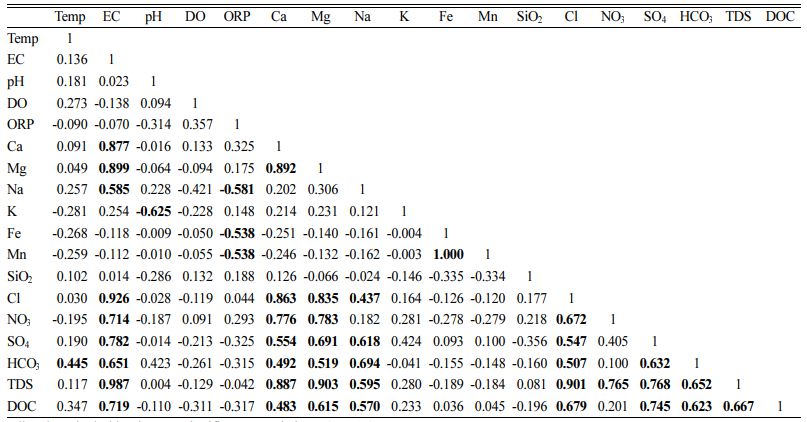
All values in bold print are significant correlations (p<0.05) |
본 연구는 전형적인 농촌지역인 노성천 유역의 지하수를 대상으로 수질 및 미생물학적 특성을 분석하였다. 연구지역의 지하수는 대부분 천부대수층으로 주로 생활용 및 농업용으로 사용되고 있으며 용존산소 농도와 산화환원 전위를 볼 때 지표층의 영향을 크게 받고 있는 것으로 보인다. 시료의 대부분은 Ca-SO4 유형과 Ca-HCO3 유형에 속하고 대부분 기반암과의 반응에 의해 수질이 형성된 것으로 보이나 농업활동에 의한 인위적 오염의 영향도 같이 받고 있는 것으로 나타났다. 미생물 군집의 경우 Proteobacteria가 가장 많이 존재하고 있었고 시료에 따라 OD1, Actinobacteria, Bacteriodetes, Cyanobacteria가 우점하기도 하였다. 전체적으로 철산화능이 있는 Gallionella 속이 광범위하게 존재하였으며 대부분 호기성 미생물이 군집의 중요한 부분을 차지하는 것으로 보아 연구지역의 지하수는 지표층과의 연결성이 매우 좋을 것으로 보인다. 특히 병원균으로 분류되는 Mycobacterium 속이 NG-4를 제외한 모든 시료에 분포하고 있으며 기타 병원성균들도 다수 검출되는 특징을 보였다. 연구지역 관정의 경우 대부분 충적 관정으로 생활용 및 농업용으로 개발되어 오염 방지 처리가 미비한 것으로 보인다. 연구지역의 상수도 보급율이 평균 83.7%인 점을 감안하면 지하수를 음용수나 생활용수로 사용할 가능성이 높기 때문에 해당 지역의 지하수 수질에 대한 전반적인 관리 방안이 반드시 필요하다.
본 연구는 과학기술정보통신부에서 지원한 한국지질자원연구원 기본사업(GP2020-012)의 도움으로 수행되었습니다.
- 1. Allende, A. and Monaghan, J., 2015, Irrigation water quality for leafy crops: A perspective of risks and potential solutions, Int. J. Environ. Res. Public Health, 12(7), 7457-7477.
-

- 2. Balkwill, D.L., Fredrickson, J.K., and Romine, M.F., 2006, Sphingomonas and related genera. In: Dworkin, M., Falkow, S., Rosenberg, E., Schleifer, K.-H., Stackebrandt, E. (Eds.), The Prokaryotes: Volume 7: Proteobacteria: Delta, Epsilon Subclass. Springer New York, New York, NY, p. 605-629.
-

- 3. Bratanis, E., Andersson, T., Lood, R., and Bukowska-Faniband, E., 2020, Biotechnological potential of Bdellovibrio and like organisms and their secreted enzymes, Front. Microbiol., 11(662).
-

- 4. Caporaso, J.G., Kuczynski, J., Stombaugh, J., Bittinger, K., Bushman, F.D., Costello, E.K., Fierer, N., Peña, A.G., Goodrich, J.K., Gordon, J.I., Huttley, G.A., Kelley, S.T., Knights, D., Koenig, J.E., Ley, R.E., Lozupone, C.A., McDonald, D., Muegge, B.D., Pirrung, M., Reeder, J., Sevinsky, J.R., Turnbaugh, P.J., Walters, W.A., Widmann, J., Yatsunenko, T., Zaneveld, J., and Knight, R., 2010, Qiime allows analysis of high-throughput community sequencing data, Nat. Methods, 7(5), 335-336.
-

- 5. Cho, B.-W., Yun, U., Lee, B.-D., and Ko, K.-S., 2012, Hydrogeological characteristics of the wangjeon-ri PCWC area, Nonsan-city, with an emphasis on water level variations, The J. Eng. Geol., 22(2), 195-205.
-

- 6. De Vet, W., Dinkla, I., Abbas, B., Rietveld, L., and Van Loosdrecht, M., 2012, Gallionella spp. in trickling filtration of subsurface aerated and natural groundwater, Biotechnol. Bioeng., 109(4), 904-912.
-

- 7. De Vet, W., Dinkla, I., Rietveld, L., and Van Loosdrecht, M., 2011, Biological iron cxidation by Gallionella spp. in drinking water production under fully aerated conditions, Water Res., 45(17), 5389-5398.
-

- 8. de Voogd, N.J., Cleary, D.F.R., Polónia, A.R.M., and Gomes, N.C.M., 2015, Bacterial community composition and predicted functional ecology of sponges, sediment and seawater from the thousand islands reef complex, West Java, Indonesia, FEMS Microbiol. Ecol., 91(4).
-

- 9. Delafont, V., Samba-Louaka, A., Cambau, E., Bouchon, D., Moulin, L., and Héchard, Y., 2017, Mycobacterium llatzerense, a waterborne Mycobacterium, that resists phagocytosis by Acanthamoeba castellanii, Sci. Rep., 7(1), 46270.
-

- 10. Edgar, R.C., 2010, Search and clustering orders of magnitude faster than blast, Bioinform., 26(19), 2460-2461.
-

- 11. Forbes, B.A., Hall, G.S., Miller, M.B., Novak, S.M., Rowlinson, M.-C., Salfinger, M., Somoskövi, A., Warshauer, D.M., and Wilson, M.L., 2018, Practical guidance for clinical microbiology laboratories: Mycobacteria, Clin. Microbiol. Rev., 31(2), e00038-00017.
-

- 12. Ghilamicael, A.M., Boga, H.I., Anami, S.E., Mehari, T., and Budambula, N.L.M., 2018, Potential human pathogenic bacteria in five hot springs in eritrea revealed by next generation sequencing, PLoS One, 13(3), e0194554.
-

- 13. Gibbs, R.J., 1970, Mechanisms controlling world water chemistry, Science, 170(3962), 1088-1090.
-

- 14. Griebler, C. and Lueders, T., 2009, Microbial biodiversity in groundwater ecosystems, Freshw. Biol., 54(4), 649-677.
-

- 15. Hallbeck, L. and Pedersen, K., 2014, The family Gallionellaceae. In: Rosenberg, E., DeLong, E.F., Lory, S., Stackebrandt, E., Thompson, F. (Eds.), The Prokaryotes: Alphaproteobacteria and Betaproteobacteria. Springer Berlin Heidelberg, Berlin, Heidelberg, p. 853-858.
- 16. Hassan, Z., Sultana, M., van Breukelen, B.M., Khan, S.I., and Röling, W.F., 2015, Diverse arsenic- and iron-cycling microbial communities in arsenic-contaminated aquifers used for drinking water in Bangladesh, FEMS Microbiol. Ecol., 91(4).
-

- 17. Hlavinek, P., Bonacci, O., Marsalek, J., and Mahrikova, I., 2008, Dangerous pollutants (Xenobiotics) in urban water cycle. Nato Science for Peace and Security Series. Springer, Dordrecht.
-

- 18. Hounslow, A., 2018, Water quality data: Analysis and interpretation, p. 1-398.
-

- 19. Huntley, S., Hamann, N., Wegener-Feldbrügge, S., Treuner-Lange, A., Kube, M., Reinhardt, R., Klages, S., Müller, R., Ronning, C.M., Nierman, W.C., and S©ªgaard-Andersen, L., 2010, Comparative genomic analysis of fruiting body rormation in Myxococcales, Mol. Biol. Evol., 28(2), 1083-1097.
-

- 20. Ibekwe, A.M., Leddy, M., and Murinda, S.E., 2013, Potential human pathogenic bacteria in a mixed urban watershed as revealed by pyrosequencing, PLoS One, 8(11), e79490.
-

- 21. Janniche, G.S., Spliid, H., and Albrechtsen, H.J., 2012, Microbial community-level physiological profiles (CLPP and herbicide mineralization potential in groundwater affected by agricultural land use, J. Contam. Hydrol., 140-141, 45-55.
-

- 22. Jeong, C.H., Yang, J.H., Lee, Y.J., Lee, Y.C., Choi, H.Y., Kim, M.S., Kim, H.K., Kim, T.S., and Jo, B.U., 2015, Occurrences of uranium and radon-222 from groundwaters in various geological environment in the Hoengseong area., The J. Eng. Geol., 25(4), 557-576.
-

- 23. Kanamori, H., Weber, D.J., and Rutala, W.A., 2016, Healthcare outbreaks associated with a water reservoir and infection prevention strategies, Clin. Infect. Dis., 62(11), 1423-1435.
-

- 24. Kasalický, V., Jezbera, J., Hahn, M.W., and Šimek, K., 2013, The diversity of the Limnohabitans genus, an important group of freshwater bacterioplankton, by characterization of 35 isolated strains, PLoS One, 8(3), e58209.
-

- 25. Katsoyiannis, I.A. and Zouboulis, A.I., 2006, Use of iron-and manganese-oxidizing bacteria for the combined removal of iron, manganese and arsenic from contaminated groundwater, Water Qual. Rese. J., 41(2), 117-129.
-

- 26. Kersters, K., De Vos, P., Gillis, M., Swings, J., Vandamme, P., and Stackebrandt, E., 2006, Introduction to the proteobacteria. In: Dworkin, M., Falkow, S., Rosenberg, E., Schleifer, K.-H., Stackebrandt, E. (Eds.), The Prokaryotes: Volume 5: Proteobacteria: Alpha and Beta Subclasses. Springer New York, New York, NY, p. 3-37.
- 27. KIGAM, 2019, Integrated technology development for securing groundwater/geothermal resources and conserving ecosystem according to climate change.
- 28. Kim, D.-H., Moon, S.-H., Ko, K.-S., and Kim, S., 2020, Microbial community structures related to arsenic concentrations in groundwater occurring in Haman area, South Korea, Econ. Environ. Geol., 53(6), 655-666.
-

- 29. Kim, H., Kaown, D., Mayer, B., Lee, J.-Y., Hyun, Y., and Lee, K.-K., 2015, Identifying the sources of nitrate contamination of groundwater in an agricultural area (Haean basin, Korea) using isotope and microbial community analyses, Sci. Total Environ., 533, 566-575.
-

- 30. Kim, K.-H., Yun, S.-T., Chae, G.-T., Choi, B.-Y., Kim, S.-O., Kim, K., Kim, H.-S., and Lee, C.-W., 2002, Nitrate contamination of alluvial groundwaters in the Keum river watershed area: Source and behaviors of nitrate, and suggestion to secure water supply, The J. Eng. Geol., 12(4), 471-484.
- 31. Ko, K.-S., Ahn, J.-S., Suk, H.-J., Lee, J.-S., and Kim, H.-S., 2008, Hydrogeochemistry and statistical analysis of water quality for small potable water supply system in Nonsan area, J. Soil and Groundw. Environ., 13(6), 72-84.
- 32. Korbel, K., Chariton, A., Stephenson, S., Greenfield, P., and Hose, G.C., 2017, Wells provide a distorted view of life in the aquifer: Implications for sampling, monitoring and assessment of groundwater ecosystems, Sci. Rep., 7(1), 40702.
-

- 33. Kwon, H.-I., Koh, D.-C., Jung, B., and Ha, K., 2017, Quantification of seasonally variable water flux between aquifer and stream in the riparian zones with water curtain cultivation activities using numerical simulation., J. Geol. Soc. Korea, 53, 277-290.
-

- 34. Kwon, H.-I., Koh, D.-C., Jung, Y.-Y., Kim, D.-H., and Ha, K., 2020, Evaluating the impacts of intense seasonal groundwater pumping on stream–aquifer interactions in agricultural riparian zones using a multi-parameter approach, J. Hydrol., 584, 124683.
-

- 35. Lacroix, B. and Citovsky, V., 2013. Agrobacterium. In: Maloy, S., Hughes, K. (Eds.), Brenner's encyclopedia of genetics (Second Edition). Academic Press, San Diego, p. 52-54.
-

- 36. Lall, U., Josset, L., and Russo, T., 2020, A snapshot of the world's groundwater challenges, Annu. Rev. Environ. Resour., 45, 171-194.
-

- 37. Lee, G.-M., Park, S., Kim, K.-I., Jeon, S.-H., Song, D., Kim, D.-h., Kim, T.-S., Yun, S.-T., Chung, H.M., and Kim, H.-K., 2017, Evaluation for impacts of nitrogen source to groundwater quality in livestock farming area, Korean J. Soil Sci. Fert., 50(5), 345-356.
-

- 38. Lee, J.-C., Kim, S.-G., and Whang, K.-S., 2015, Sphingobium subterraneum sp. Nov., isolated from ground water, Int. J. Syst. Evol. Microbiol., 65(Pt_2), 393-398.
-

- 39. Lee, J.-H., Lee, B.-J., and Unno, T., 2018, Bacterial communities in ground-and surface water mixing zone induced by seasonal heavy extraction of groundwater, Geomicrobiol. J., 35(9), 768-774.
-

- 40. Li, W., Fu, L., Niu, B., Wu, S., and Wooley, J., 2012, Ultrafast clustering algorithms for metagenomic sequence analysis, Brief. Bioinform., 13(6), 656-668.
-

- 41. Moon, J.-T., Kim, K.-J., Kim, S.-H., Jeong, C.-S., and Hwang, G.-S., 2008, Geochemical investigation on arsenic contamination in the alluvial ground-water of Mankyeong river watershed, Econ. Environ. Geol., 41(6), 673-683.
- 42. Mueller, D.K. and Helsel, D., 1996, Nutrients in the nation's waters--too much of a good thing?
- 43. Nelson, W.C. and Stegen, J.C., 2015, The teduced genomes of Parcubacteria (OD1) contain signatures of a symbiotic lifestyle, Front. Microbiol., 6, 713-713.
-

- 44. Oh, S. and Choi, D., 2019, Microbial community enhances biodegradation of bisphenol a through selection of Sphingomonadaceae, Microb. Ecol., 77(3), 631-639.
-

- 45. Oh, Y.H., Koh, D.-C., Kwon, H.-I., Jung, Y.-Y., Lee, K.Y., Yoon, Y.-Y., Kim, D.-H., Moon, H.S., and Ha, K., 2021, Identifying and quantifying groundwater inflow to a stream using 220Rn and 222Rn as natural tracers, J. Hydrol. Reg. Stud., 33, 100773.
-

- 46. Oh, Y.H., Kim, D.-H., Lee, S.-H., Moon, H.S., and Cho, S.Y., 2020, Determining characteristics of groundwater inflow to the stream in an urban area using hydrogeochemical tracers (222Rn and major dissolved ions) and microbial community analysis, J. Soil Groundw. Environ., 25(2), 16-23.
- 47. Orata, F.D., Meier-Kolthoff, J.P., Sauvageau, D., and Stein, L.Y., 2018, Phylogenomic analysis of the gammaproteobacterial methanotrophs (rrder Methylococcales) calls for the reclassification of members at the genus and species levels, Front. Microbiol., 9(3162).
-

- 48. Oren, A., 2014, The family Rhodocyclaceae. In: Rosenberg, E., DeLong, E.F., Lory, S., Stackebrandt, E., Thompson, F. (Eds.), The Prokaryotes: Alphaproteobacteria and Betaproteobacteria. Springer Berlin Heidelberg, Berlin, Heidelberg, p. 975-998.
-

- 49. Pachepsky, Y., Shelton, D.R., McLain, J.E.T., Patel, J., and Mandrell, R.E., 2011, Irrigation waters as a source of pathogenic microorganisms in produce: a review, Adv. Agron., 113, 75-141.
-

- 50. Pagadala, S., Marine, S.C., Micallef, S.A., Wang, F., Pahl, D.M., Melendez, M.V., Kline, W.L., Oni, R.A., Walsh, C.S., Everts, K.L., and Buchanan, R.L., 2015, Assessment of region, farming system, irrigation source and sampling time as food safety risk factors for tomatoes, Int. J. Food. Microbiol., 196, 98-108.
-

- 51. Pedersen, K., 2011, Gallionella. In: Reitner, J., Thiel, V. (Eds.), Encyclopedia of Geobiology. Springer Netherlands, Dordrecht, p. 411-412.
-

- 52. Percival, S.L. and Williams, D.W., 2014, Chapter Nine - Mycobacterium. In: Percival, S.L., Yates, M.V., Williams, D.W., Chalmers, R.M., Gray, N.F. (Eds.), Microbiology of Waterborne Diseases (Second Edition). Academic Press, London, p. 177-207.
-

- 53. Piper, A.M., 1944, A Graphic procedure in the geochemical interpretation of water-analyses, Eos, Transactions American Geophysical Union, 25(6), 914-928.
-

- 54. Ramírez-Castillo, F.Y., Loera-Muro, A., Jacques, M., Garneau, P., Avelar-González, F.J., Harel, J., and Guerrero-Barrera, A.L., 2015, Waterborne pathogens: detection methods and challenges, Pathogens, 4(2), 307-334.
-

- 55. Saether, O.M. and De Caritat, P., 1996, Geochemical processes, weathering and groundwater recharge in catchments. CRC Press.
-

- 56. Sang, S., Zhang, X., Dai, H., Hu, B.X., Ou, H., and Sun, L., 2018, Diversity and predictive metabolic pathways of the prokaryotic microbial community along a groundwater salinity gradient of the Pearl river delta, China, Sci. Rep., 8(1), 17317.
-

- 57. Schulze-Röbbecke, R., 1993, Mycobacteria in the environment, Immun. Infekt., 21(5), 126-131.
- 58. Sherwood, W.C., 1989, Chloride loading in the south fork of the Shenandoah river, Virginia, U.S.A, Environ. Geol., 14, 99-106.
-

- 59. Slover, C.M. and Danziger, L., 2008, Lactobacillus: a review, Clin. Microbiol. Newsl., 30(4), 23-27.
-

- 60. Spanevello, M.D. and Patel, B.K.C., 2004, The phylogenetic diversity of Thermus and Meiothermus from microbial mats of an Australian subsurface aquifer runoff channel, FEMS Microbiol. Ecol., 50(1), 63-73.
-

- 61. Stites, W. and Kraft, G.J., 2001, Nitrate and chloride loading to groundwater from an irrigated north-central U.S. sand-plain vegetable field, J. Environ. Qual., 30(4), 1176-1184.
-

- 62. Stoecker, K., Bendinger, B., Schöning, B., Nielsen, P.H., Nielsen, J.L., Baranyi, C., Toenshoff, E.R., Daims, H., and Wagner, M., 2006, Cohn¡¯s Crenothrix is a filamentous methane oxidizer with an unusual methane monooxygenase, Proc. Natl. Acad. Sci., 103(7), 2363-2367.
-

- 63. Thomas, F., Hehemann, J.-H., Rebuffet, E., Czjzek, M., and Michel, G., 2011, Environmental and gut Bacteroidetes: the food connection, Front. Microbiol., 2, 93-93.
-

- 64. UN Water, 2018, Progress on level of water stress: global baseline for SDG indicator 6.4. 2, UN Water, Geneva (2018).
- 65. Uyttendaele, M., Jaykus, L.-A., Amoah, P., Chiodini, A., Cunliffe, D., Jacxsens, L., Holvoet, K., Korsten, L., Lau, M., McClure, P., Medema, G., Sampers, I., and Rao Jasti, P., 2015, Microbial hazards in irrigation water: standards, norms, and testing to manage use of water in fresh produce primary production, Comp. Rev. Food Sci. Food Saf., 14(4), 336-356.
-

- 66. Van Der Linden, I., Cottyn, B., Uyttendaele, M., Berkvens, N., Vlaemynck, G., Heyndrickx, M., and Maes, M., 2014, Enteric pathogen survival varies substantially in irrigation water from Belgian lettuce producers, Int. J. Environ. Re.s Public Health, 11(10), 10105-10124.
-

- 67. Wang, W., Wang, H., Feng, Y., Wang, L., Xiao, X., Xi, Y., Luo, X., Sun, R., Ye, X., Huang, Y., Zhang, Z., and Cui, Z., 2016, Consistent responses of the microbial community structure to organic farming along the middle and lower reaches of the Yangtze river, Sci. Rep., 6(1), 35046.
-

- 68. Waśkiewicz, A. and Irzykowska, L., 2014, Flavobacterium spp. – characteristics, occurrence, and toxicity. In: Batt, C.A., Tortorello, M.L. (Eds.), Encyclopedia of Food Microbiology (Second Edition). Academic Press, Oxford, p. 938-942.
-

- 69. Wolfe, R., 1960, Observations and studies of Crenothrix polyspora, J. Am. Water Work. Assoc., 52, 915-918.
-

- 70. Yang, J.H., Kim, H.-K., Kim, M., Lee, M.K., Shin, I.K., Park, S.H., Kim, H.S., Ju, B.K., Kim, D.S., and Kim, T.S., 2015, Evaluation of groundwater quality deterioration using the hydrogeochemical characteristics of shallow portable groundwater in an agricultural area, The J. Eng. Geol., 25(4), 533-545.
-

- 71. Yoon, J., Park, S., Choi, H., Kim, D.H., Kim, M., Yun, S.-T., Kim, Y., and Kim, H.-K., 2020, Analysis of groundwater quality and contamination factors in livestock region, South Korea, J. Soil Groundw. Environ., 25(4), 98-105.
-

- 72. Yoon, K.-S., Tsukada, N., Sakai, Y., Ishii, M., Igarashi, Y., and Nishihara, H., 2008, Isolation and characterization of a new facultatively autotrophic hydrogen-xxidizing betaproteobacterium, Hydrogenophaga sp. AH-24, FEMS Microbiol. Lett., 278(1), 94-100.
-

- 73. Zeng, X., Hosono, T., Matsunaga, M., Ohta, H., Niidome, T., Shimada, J., and Morimura, S., 2017, Spatial distribution of microbial communities in the alluvial aquifer along the Oyodo river, Miyakonojo basin, Japan, J. Water Environ. Technol., 15(4), 152-162.
-

- 74. Zhang, Q., Wu, J., Yang, F., Lei, Y., Zhang, Q., and Cheng, X., 2016, Alterations in soil microbial community composition and biomass following agricultural land use change, Sci. Rep., 6(1), 36587.
-

 This Article
This Article
-
2022; 27(2): 61-75
Published on Apr 30, 2022
- 10.7857/JSGE.2022.27.2.061
- Received on Feb 17, 2022
- Revised on Mar 7, 2022
- Accepted on Mar 22, 2022
 Services
Services
Shared
 Correspondence to
Correspondence to
- Dong-Hun Kim
-
Groundwater Environment Research Center, Climate Change Response Division, Korea Institute of Geoscience and Mineral Resources, Daejeon 34132, Republic of Korea
- E-mail: donghun@kigam.re.kr