- Assessing the Role of Citric Acid in Denitrification of Nitrate in Slow-releasing Carbon Source Tablet
Kyungjin Han1·Yuhoon Yeum2·Young Kim2·Sooyoul Kwon3*
1Department of Environmental Engineering, Korea National University of Transportation, Chungcheongbuk-do 27469, Korea
2Department of Environmental Engineering, Korea University, Sejong 30019, Korea
3Department of Environmental Health, Korea National Open University, Seoul 03087, Korea- 완효성 탄소원 정제 내 citric acid의 생물학적 탈질소화 영향
한경진1·염여훈2·김 영2·권수열3*
1한국교통대학교 환경공학과, 2고려대학교 환경시스템공학과, 3한국방송통신대학교 보건환경학과
This article is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
This study utilized citric acid as a floating agent in biological denitrification process and assessed its role under different carbon supplying conditions. Several microcosm tests including citric acid active (CAA), precipitating tablet release active (PTRA) and floating tablet release active (FTRA) were conducted to evaluate nitrate denitrification efficacy. In CAA reactors, nitrate removal was accompanied by the formation of denitrification by-products such as nitrite and nitrous oxide, with the extent of nitrate removal being proportional to citric acid concentration. These results suggest that citric acid induced heterotrophic biological denitrification. PTRA reactor that incorporated CAA and the same electron donor showed a similar denitrification efficiency to CAA reactor. FTRA reactor, which contained the same amount of fumarate as PTRA, enhanced denitrification by 7% as compared to the PTRA reactor. The overall results of this work indicate that surplus citric acid can be efficiently utilized in heterotrophic denitrification.
Keywords: Heterotrophic nitrate denitrification, Citric acid, Carbon source/Electron donor, Slow release tablet
질산성질소는 지하수 내 대표적인 일반 오염물질로, 현재 국내에서는 생활하수, 축산폐수, 농경활동 등으로 인해 질산성질소로 인한 지하수의 오염이 전국적으로 광역화되고 있다(NIER, 2012). 특히, 대규모 축산단지나 축사 주변에서는 축산폐수 및 축분 등에서의 유출로 인해 점오염원 형태로 수십 ppm의 고농도 질산성질소가 지하수 내에서 검출되고 있다(Giammarino and Quatto, 2015; NIER, 2012; van der Schans et al., 2009). 농축산 지역의 질산성질소 오염 기원을 조사하기 위한 Kim et al.(2015)은 국내 지하수 내 약 20 mg-N/L의 고농도 질산성질소 오염의 기원은 대부분 퇴비 혹은 분뇨 등 축산계 기원의 오염원에 의한 것으로 보고하여, 축산단지 주변 지하수의 질산성질소 관리가 수계 관리에서 중요한 사안임을 시사하고 있다.
이에 국립환경과학원에서는 ‘농축산지역 지하수 중 질산성질소 수질관리 개선사업’을 2013년부터 진행하여 지하수 오염 저감을 위한 방안으로 질소비료 사용량 조절을 통한 방안, 그리고 적극적 질소오염 저감기술을 제시한 바 있다(NIER, 2021). 적극적 질소오염 저감 기술은 상기 전술한 축산계 기원의 점오염원 형태의 고농도 오염 지하수를 관리하기 위한 방법으로 액상형태의 탄소원 주입으로 질산성질소의 생물학적 종속영양 탈질 기작을 촉진하는 적극적 자연저감 기술이다(Park et al., 2019). 이에 Han et al.(2020)은 고농도 질산성질소가 검출되는 6곳 축산단지에서 액상 형태의 푸마르산을 기반으로 한 적극적 자연저감 기술의 적용을 통해 상기 방법이 축산계 기원 점오염원 형태의 질산성질소 관리에 효과적으로 적용 가능하다는 것을 입증하였다. 하지만 액상형태의 탄소원 주입기술은 유속이 빠른 조건의 지역에서는 탄소원의 지속적인 주입이 필요하고, 액상 탄소원 보관용기 및 부지 점용공간등이 요구되는 등 실제 기술 적용의 한계점을 나타났다.
Yeum et al.(2020)은 기존의 액상 형태의 탄소원 주입 기술의 단점을 보완하기 위해, 지속적인 약물 방출 기작으로 장기간 동안 충분한 약효를 유지하게 하는 방출조절(controlled release) 약학 분야 기술을 이용하여 푸마르산을 기반으로 한 침전형/부유형의 완효성(緩效性) 탄소원 정제(錠劑)를 개발하였다. 완효성 탄소원 정제는 생물학적 종속영양 탈질반응의 탄소원 또는 전자공여체로 푸마르산염(fumarate), 서방제(徐放劑)로 hydroxypropyl methyl- cellulose(HPMC), 결합제(結合劑)로 microcrystalline cell- ulose(MCC) 등으로 구성되었고, 부유형 정제의 경우 이산화탄소를 생성하는 화학반응을 기반으로 하여 탄산칼슘과 구연산(citric acid)을 부유제로 사용하였다. Yeum et al. (2020)의 선행연구 결과, 서방형 정제 내 포함된 푸마르산염의 생물학적 탈질에 의해 제거 가능한 이론적인 질산성질소의 총량 대비 약 1.3배 이상 분해가 되는 것으로 나타나 푸마르산 외 정제 내 조성된 잠재적인 탄소원이 탈질에 영향을 미칠 가능성이 높다는 것을 시사하였다.
따라서 본 연구에서는 부유형 탄소원 정제 조성 중, 생물학적 탈질소화 반응의 촉진을 위한 탄소원인 푸마르산염 외 부유제로 첨가한 구연산이 질산성질소의 탈질 반응에 미치는 영향을 확인하고자 한다.
2.1. 회분식 반응조 실험구성 및 모니터링 방법
회분식 반응조는 서방형 탄소원 정제 중 생물학적 탈질소화의 잠재적인 탄소원의 가능성이 가장 높은 구연산에 의한 탈질 영향을 정확하게 파악하기 위해, 액상 구연산을 주입한 citric acid(CA) 실험군, 서방형 침전 정제를 주입한 precipitating tablet(PT) 실험군, 서방형 부유 정제를 주입한 floating tablet(FT) 실험군을 구성하였다. 모든 반응조는 생물학적 탈질의 반응 촉진을 위해 충분한 미생물이 공급되도록 축사 주변 질산성질소 오염부지에서 채취한 미사질 토양을 0.425 mm ~ 1.70 mm로 채거름 및 균질화한 후 동일한 양의 토양을 주입하였다. CA 실험군은 정제가 아닌 구연산을 액상 형태로 농도별로 주입한 Citric Acid Control(CAC, 중농도 구연산, 염화수은 주입), Citric Acid Active1(CAA1, 저농도 구연산 주입), Citric Acid Active2(CAA2, 중농도 구연산 주입), Citric Acid Active3(CAA3, 고농도 구연산 주입)을 각각 구성하여, 구연산에 의한 질산성질소 분해를 모니터링 하였다.
또한 PT, FT 실험군 반응조 내 서방형 정제의 주 탄소원인 푸마르산염에 의해 방출되는 전자를 균일하게 하기 위해 침전형 정제와 부유형 정제의 조성을 고려하여 PT와 FT 실험군에 각각 3정과 5정의 정제를 주입하였다. PT와 FT에는 각각 푸마르산염이 3.75 mmol/정, 2.23 mmol/정씩 함유되어 있고, FT에는 구연산이 0.57 mmol/정씩 함유되어 있다. 따라서 PT와 FT 실험군에는 각각 11.3 mmol과 11.1 mmol의 푸마르산이 주입되어 아래 식 (1)의 energetic model(Rittman and McCarty, 2001)에 따라 동일한 양의 전자가 질산성질소가 생물학적 탈질소화에 사용되도록 설계하였다.
0.083C4H2O42- + 0.085NO3- + 0.252H+ → 0.025C5H7O2N + 0.03N2 + 0.208CO2 + 0.122H2O (1)
상기한 방법에 따른 FT 실험군 반응조는 푸마르산염 뿐만 아니라 부유제로서 구연산이 2.8 mmol 존재하게 되고, 식 (2)의 탄산칼슘과 구연산의 화학반응을 고려하였을 때 약 1.8 mmol의 구연산이 질산성질소의 탈질에 사용 가능하다.
3CaCO3 + 2C6H8O7 → Ca3 (C6H5O7)2 + 3CO2 + 3H2O (2)
따라서 아래 식 (3)과 같이 구연산이 생물학적 탈질의 탄소원으로 사용될 경우를 가정한 energetic model에 따라 FT 실험군에서는 PT 실험군 대비 약 2.7 mmol 만큼의 질산성질소가 이론적으로 더 분해 가능하다.
0.056C6H5O73- + 0.083NO3- +0.083H+ → 0.025C5H7O2N + 0.029N2 + 0.040CO2 + 0.167HCO3- + 0.008H2O (3)
따라서 질산성질소 주입량을 침전형 정제인 PT 기준으로 설계하여 PT와 FT의 질산성질소 제거를 비교하면 구연산의 탈질소화에 미치는 영향의 평가가 가능하다. 따라서 본 연구에서는 모든 반응조에서 질산성질소 주입량을 푸마르산염과 구연산이 동시에 탄소원으로 사용될 경우를 가정하여 설계하였다.
세부적인 실험 조성은 Table 1과 같이, PT 실험군은 PT Release Control(PTRC), PT Release Active(PTRA)로 구성하였다. 생물학적 반응을 불활성화시키는 염화수은은 25 mg/L 이상의 농도에서 충분히 생물학적 반응을 불활성화 시킬 수 있다고 보고된 바 있기에(Vancheeswaran et al., 1999; Yu and Semprini, 2002), PTRC 반응조는 충분한 생물학적 반응 불활성화를 위해 염화수은을 200 mg/L씩 과량 주입하여 서방형 탄소원 정제로부터의 탄소원 방출을 모니터링 하였다. PTRA 반응조는 염화수은을 주입하지 않은 조건에서 서방형 탄소원 정제로부터의 탄소원 방출 및 생물학적 탈질산화를 모니터링 하였다. FT 실험군은 FT Release Control(FTRC), FT Release Active (FTRA)로 구성하였다. FTRC 반응조에는 PTRC 반응조와 동일하게 염화수은을 주입하여, 완효성 탄소원 정제로부터의 탄소원 방출 및 이산화탄소 발생 반응에 의한 구연산의 분해를 모니터링 하였다. FTRA 반응조는 염화수은을 주입하지 않은 조건 하, 서방형 탄소원 정제로부터의 탄소원 방출, 이산화탄소 발생 반응 및 생물학적 탈질산화를 모니터링 하였다. 또한 모든 반응조는 20oC 조건의 항온배양기(JEIO TECH, Daejeon, South Korea)에서 10 rpm 조건으로 교반을 실시하며 모니터링을 실시하였다.
2.2. 기기 분석방법
푸마르산과 구연산은 HPLC를 이용하여 분석하였다. 시료는 0.35 mm의 실린지 필터를 이용하여 여과 후 1200 Series HPLC(Agilent Technologies, CA, USA)를 이용하여 분석하였다. HPLC의 검출기 파장은 210 nm, 오븐 온도는 37oC, 이동상으로는 20 mM 인산 용액, 그리고 이동상 유량은 600 ml/min으로 설정하였다. 크로마토그램 분리는 UNISON UK-C18 250 × 4.6 mm column(Imtakt Co., OR, USA)을 이용하여 수행하였다.
질산성질소, 아질산성질소는 이온 크로마토그래피를 이용하여 분석하였다. 시료는 0.35 mm의 실린지 필터를 이용하여 여과 후 Dionex Ion Chromatography System (Dionex Co., CA, USA)을 이용하여 분석하였다. 이동상으로는 3.5 mM Na2CO3와 1.0 mM NaHCO3 혼합용액, 이동상 유량은 1.2 mL/min, 검출기의 전류는 24 mA로 설정하였다. 크로마토그램 분리는 Dionex IonPac AS14 컬럼(Dionex Co., CA, USA)을 이용하여 수행하였다.
아산화질소는 외장 헬륨이온화검출기(Helium Ionization Detector, HID) PD-C2(Valco Instruments CO., TX, USA)가 장착된 DS6200 가스크로마토그래피(Donam, Seoul, South Korea)를 이용하여 분석하였다. 시료 주입구의 온도는 150oC, 오븐 온도는 40oC, 검출기 온도는 170oC로 설정하였다. 크로마토그램 분리는 Alltech #8011 8 ft × 1/8 in × 0.085 in 컬럼(Apex Scientific, Kildare, Ireland)을 이용하여 수행하였다.
|
Table 1 Initial nitrate, fumarate and citric acid mass in each reactors |
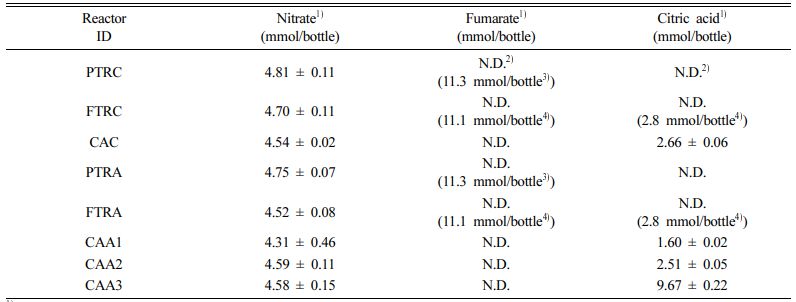
1)Average value ± 95% confidence interval |
3.1. 액상 구연산 주입 농도에 따른 질산성질소 제거효율 평가
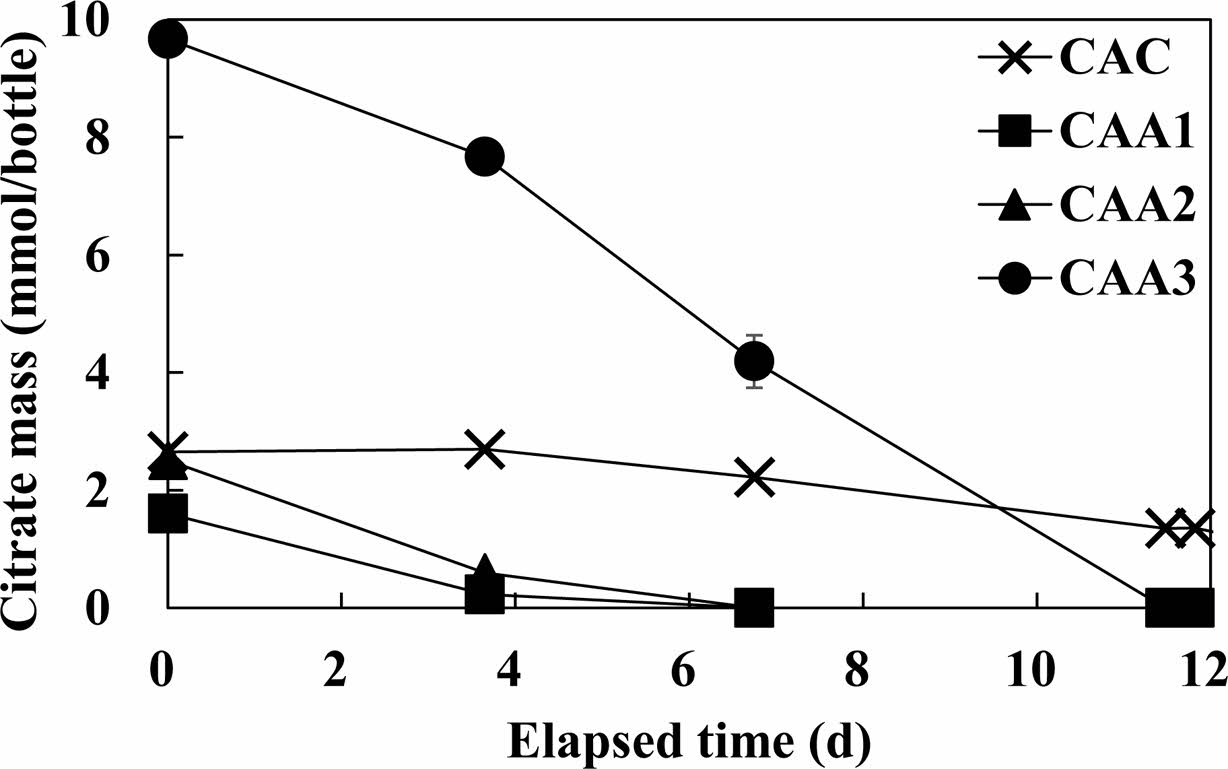
Fig. 1은 액상 형태의 구연산을 농도별로 주입한 CAA 반응조에서 구연산을 모니터링 결과이다. CAA1과 CAA2 반응조에서 구연산의 질량은 각각 초기 1.6 mmol/bottle 와 2.5 mmol/bottle에서 지속적으로 감소하여 7일 후 완전 분해가 이루어지는 것으로 나타났다. 고농도 구연산이 주입된 CAA3 반응조에서 구연산은 초기 질량 9.7 mmol/bottle로 검출되었으며, 11일 경과 후 모두 분해가 되는 것으로 나타났다. 그러나 생물학적 반응의 저해를 위해 염화수은을 주입한 CAC 반응조에서 구연산은 10일 경과 후 초기 질량 대비 약 5% 감소하는 것으로 나타나, CAA1~3 반응조 대비 큰 변화가 없음을 확인하였다. 이는 선행연구들에서 보고된 바와 같이 염화수은의 주입으로 인해 반응조 내 존재하는 미생물이 효과적으로 비활성되어 나타난 결과이다(Frey and Rieder, 2013; Hiller-Bittrolff et al., 2018; Wang et al., 2013). 따라서 CAA1~ 3 반응조에서의 나타난 구연산의 감소는 반응조 내 존재하는 미생물에 의한 생물학적 반응임을 확인하였다.
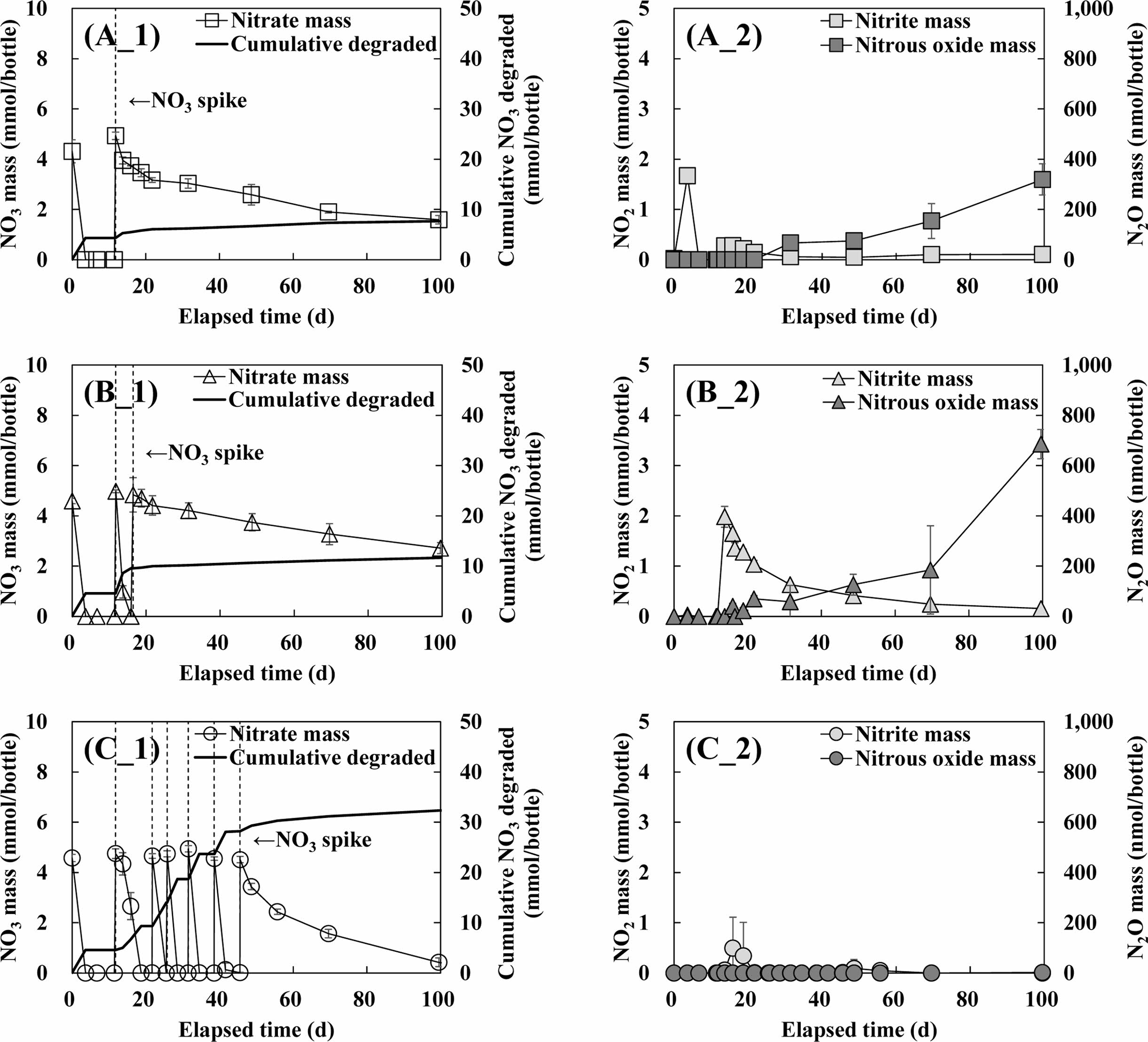
CAA1~3 반응조에서 질산성질소 농도, 누적 질산성질소 분해량, 아질산성질소 및 아산화질소 농도 변화를 Fig. 2에 나타내었다. CAA1 반응조에서 약 4.3 mmom/bottle 질산성질소가 약 4일 만에 분해되었고, 12일이 경과한 시점에 초기 주입과 동일한 질량의 질산성질소를 1회 재주입한 결과, 100일이 경과함에도 불구하고 주입량의 약 68%만 분해되어 누적 7.7 mmol/bottle이 분해되었다[Fig. 2(A_1)]. 또한 Fig. 2(A_2)에서와 같이 질산성질소 분해와 더불어 질산성질소의 생물학적 탈질 부산물인 아질산성질소와 아산화질소가 검출되어, 아세트산, 에탄올, 메탄올 등 유기 탄소원 주입에 의한 질산성질소 생물학적 종속영양 탈질과 유사한 형태의 결과를 보였다(Ribera-Guardia et al., 2014). 특히 CAA1과 CAA2의 경우 Han et al.(2020)의 연구와 유사하게 주입한 구연산의 완전 분해 후 아산화질소가 누적되는 경향을 보여, 전자공여체/탄소원 부족으로 인해 상대적으로 탈질 속도가 느린 아산화질소에서 질소가스로의 환원 반응이 저해되는 것으로 나타났다. 따라서 상기한 질산성질소 분해는 구연산 유래의 탄소원으로 인해 생물학적 이화작용(dissimilative)에 의한 탈질 반응에 기인한 것을 확인하였다.
또한 구연산이 7일만에 완전히 분해 되었음에도 불구하고 지속적으로 진행되는 생물학적 탈질 반응은, 구연산이 질산성질소의 직접적인 탈질을 위한 탄소원/전자공여체의 역할도 하지만, 상대적으로 저분자 탄소원으로 전환 등 생물학적 탈질을 위한 유기물로 분해된다는 것을 시사한다. CAA2와 CAA3 반응조에서 질산성질소는 앞선 반응조와 유사하게 초기 주입 질량은 약 4일 만에 완전히 분해되었고, 이후 CAA2는 2회의 질산성질소[Fig. 2(B_1)]를, CAA3 반응조는 6회의 질산성질소[Fig. 2(C_1)]를 추가 주입하였다. 각 반응조에서 누적 질산성질소 제거량은 CAA2과 CAA3 반응조에서 각각 11.7 mmol/bottle, 32.3 mmol/bottle로 나타나 구연산 주입량과 질산성질소 분해량이 비례하게 증가하는 것으로 나타났다. 특히 염화수은 주입을 통해 구연산의 생분해를 억제한 CAC 반응조의 경우 질산성질소 분해가 이루어지지 않는 것으로 나타났다. 상기한 생분해 억제 반응조에서 이루어지지 않은 질산성질소 분해, 구연산 주입량 증가에 따른 질산성질소 분해량 증가와 모든 CAA 반응조에서 관찰된 생물학적 탈질 부산물 결과는, 구연산이 생물학적 종속영양 탈질 반응을 위한 탄소원/전자공여체로서 충분히 사용되고 있는 것으로 판단된다.
3.2. 침전형, 부유형 탄소원 정제를 이용한 질산성질소 제거효율 평가
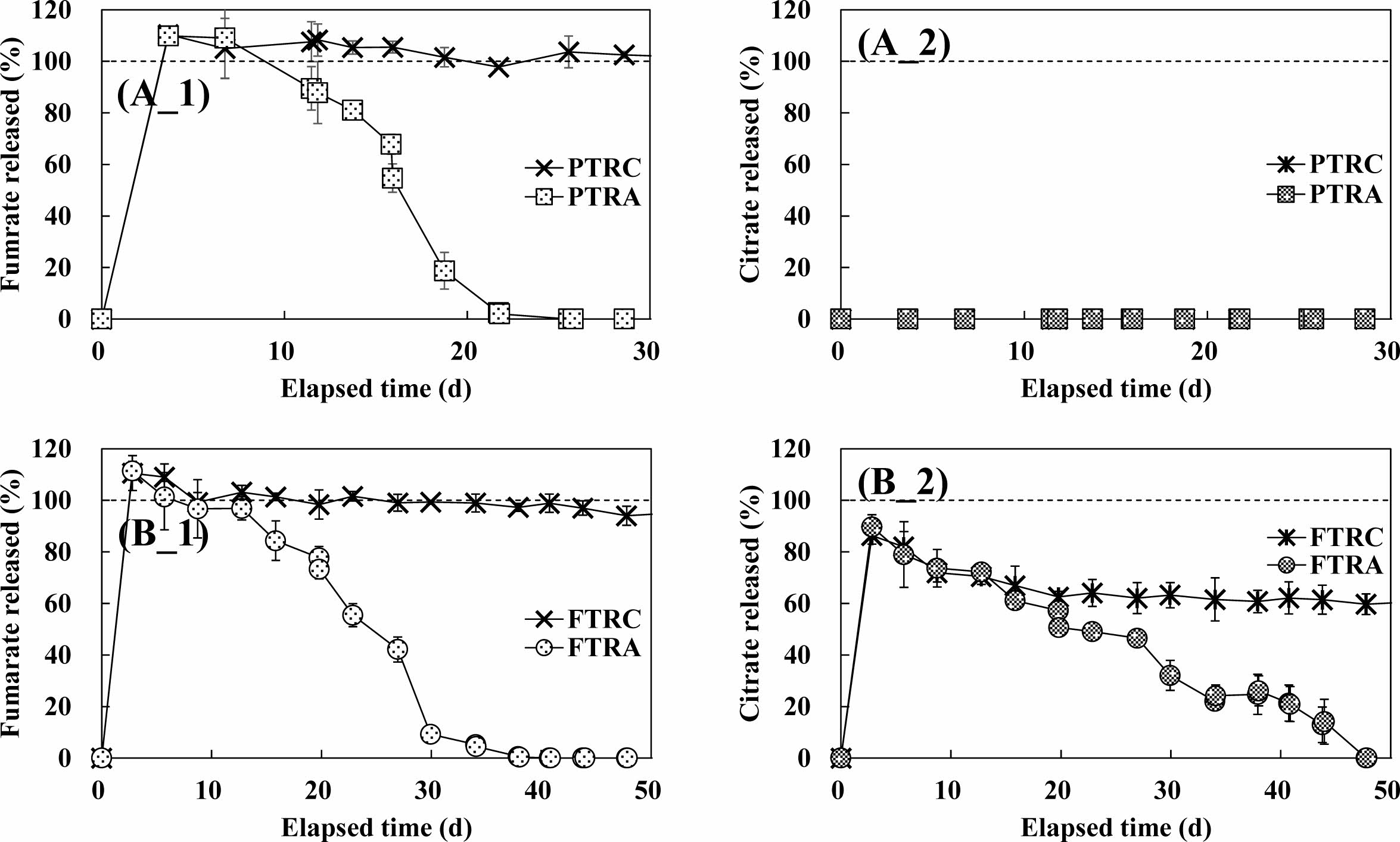
부유형 서방형 정제인 FT 내 함유된 구연산에 의한 질산성질소 분해량 차이를 평가하기 위해, 서방형 정제의 주 탄소원인 푸마르산염에 의해 방출되는 전자를 통일한 침전형 정제 기반 PT 실험군과 FT 실험군의 푸마르산 및 구연산 농도 모니터링 결과를 Fig. 3에 나타내었다. 그 결과 Yeum et al.(2020)의 선행연구 대비 약 5배 빠른 용출속도를 보이며, PTRC, PTRA 반응조는 4일 경과 후 정제 형태로 주입한 푸마르산 질량 전량이 액상으로 방출되었다[Fig. 3(A_1)]. 이는 Nickerson et al.(2018), Patel et al.(2020) 등이 보고한 바와 같이 서방형 정제 내 HPMC의 분해속도 증가를 통한 탄소원의 빠른 용출을 위해 지속적으로 물리적인 교반을 시행한 결과이다.
생물학적 반응이 비활성화된 PTRC 반응조에서는 29일 경과 후에도 반응조 내 푸마르산 질량이 102%로 큰 변화가 없는 것으로 나타났다. 반면, PTRA 반응조에서는 10일 경과 후 시점부터 푸마르산이 분해되기 시작하여 26일만에 완전 분해되는 것으로 나타났다. PT 내에는 구연산이 함유되어 있지 않기에, PTRC, PTRA 반응조에서 구연산은 불검출되었다[Fig. 3(A_2)].
FTRC, FTRA 반응조에서 또한 3.5일 경과 후 정제 형태로 주입한 푸마르산 질량 전량이 액상으로 방출되었다[Fig. 3(B_1)]. 생물학적 반응이 비활성화된 FTRC 반응조에서는 PTRC 반응조와 유사하게 48일 경과 후 푸마르산 방출율이 약 94%로 큰 변화가 없는 반면, FTRA 반응조에서는 20일 경과 후 시점부터 푸마르산이 분해되기 시작하여 38일부터는 푸마르산 방출율이 1% 미만으로 검출되었다. FT에 부유제로 함유된 구연산 또한 푸마르산과 유사한 방출경향을 보이며 약 3.5일 경과 후, 주입한 구연산 질량의 약 90%가 방출되어 방출과 동시에 일부는 화학적인 반응에 사용되는 것을 확인하였다. 또한 푸마르산의 결과와 달리 FTRC와 FTRA 반응조에서 모두 구연산이 감소하였고, FTRC 반응조에서는 48일 경과 후 구연산 방출율이 60%인 반면, FTRA 반응조에서는 불검출되었다[Fig. 3(B_2)]. FTRC의 반응조에서는 염화수은의 주입으로 인해 생물학적 반응이 억제되었음을 고려하고, Heinrich et al.(2022) 등이 보고한 것과 같이 구연산이 탄산칼슘과의 화학적인 반응에 의해 즉각적으로 소모된 것으로 보아, 상기한 구연산의 감소는 부유제로 구연산과의 반응을 위해 주입한 탄산칼슘과의 화학적 반응에 기인함을 알 수 있다. 따라서 FTRC의 구연산 제거가 화학적인 반응만임을 고려하면, FTRA 반응조에서는 정제에 조성된 약 60%의 구연산이 생물학적 반응에 의해 사용되었음을 시사한다.
상기한 가정을 확인하기 위해 정제의 조성을 살펴본 결과, FT 내 구연산 및 탄산칼슘 함유량은 각각 0.57 mmol/정과 0.30 mmol/정 이고, FTRC와 FTRA 반응조에 각각 5정의 FT를 주입하였음을 고려하면, 두 반응조 내 주입한 구연산 및 탄산칼슘은 각각 2.8 mmol/bottle과 1.5 mmol/bottle이다. 상기 식 2 화학양론에 따라 1 mmol의 구연산이 부유를 위해 탄산칼슘 1.5 mmol과 반응함을 고려하면, 두 반응조 내 부유를 위해 필요한 이론적인 구연산의 양은 1.0 mmol/bottle(36%)이고, 잔여 구연산은 1.8 mmol/bottle(64%)임을 알 수 있다. 즉, FTRC, FTRA 반응조 모니터링 결과를 통해서 확인한 부유 반응에 소모된 구연산 대 생물학적 반응에 의해 분해된 구연산의 비인 40% : 60%은 이론적 몰비인 36% : 64%와 근사함을 확인할 수 있었다. 따라서 본 실험을 통해 정제에 조성된 구연산의 약 60% 이상이 생물학적 반응에 의해 사용되었음을 확인하였다.
3.3. 실험 결과 종합 평가
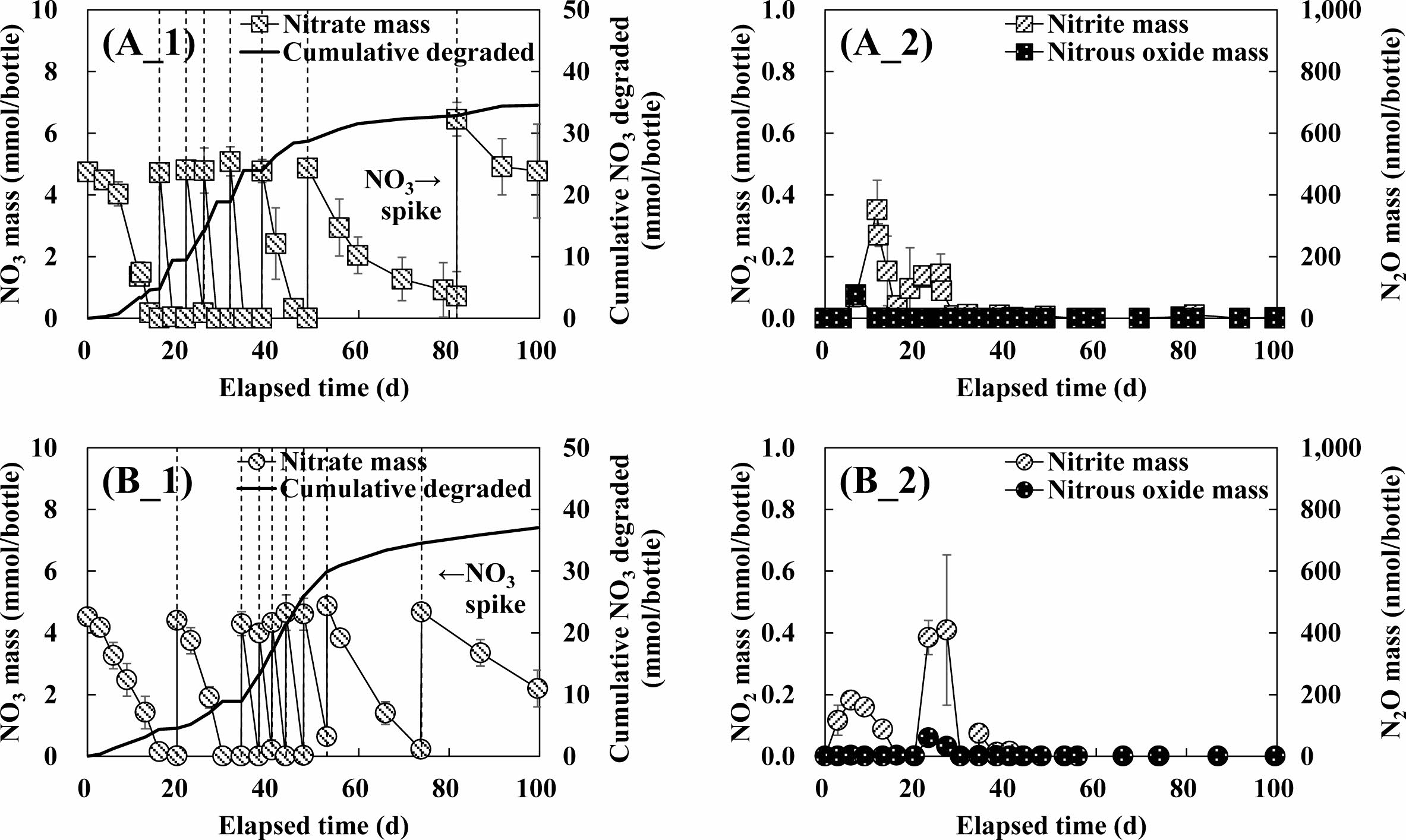
PT 실험군과 FT 실험군의 질산성질소 농도, 누적 질산성질소 분해량, 아질산성질소 및 아산화질소 농도를 모니터링 한 결과, PTRA, FTRA 반응조에서 초기 주입 질산성질소는 약 15~20일 만에 완전히 분해되었고, 이후 수일 내의 빠른 분해 효율을 보여 PTRA 반응조는 7회의 질산성질소[Fig. 4(A_1)]를, FTRA 반응조는 8회의 질산성질소[Fig. 4(B_1)]를 추가 주입하였다. 각 반응조에서 100일 경과 후 누적 질산성질소 제거량은 PTRA과 FTRA 반응조에서 각각 34.5 mmol/bottle, 37.0 mmol/bottle로 나타났다. 또한 두 반응조에서 모두 질산성질소의 생물학적 종속영양 탈질 반응의 부산물인 아질산성질소 및 아산화질소가 검출되어[Fig. 4(A_2), Fig. 4(B_2)], Han et al.(2020)이 푸마르산을 기반으로 현장에서 수행한 질산정질소 생물학적 저감연구와 유사한 경향을 보이는 것으로 나타났다. 따라서 상기한 질산성질소의 추가 주입 및 분해, 그리고 생물학적 종속영양 탈질 반응의 부산물인 아질산성질소 및 아산화질소의 검출은 주입한 서방형 정제 내 함유된 주 탄소원인 푸마르산과 부유제로 주입한 구연산에 의한 생물학적 종속영양 탈질 반응으로부터 기인함을 확인하였다.
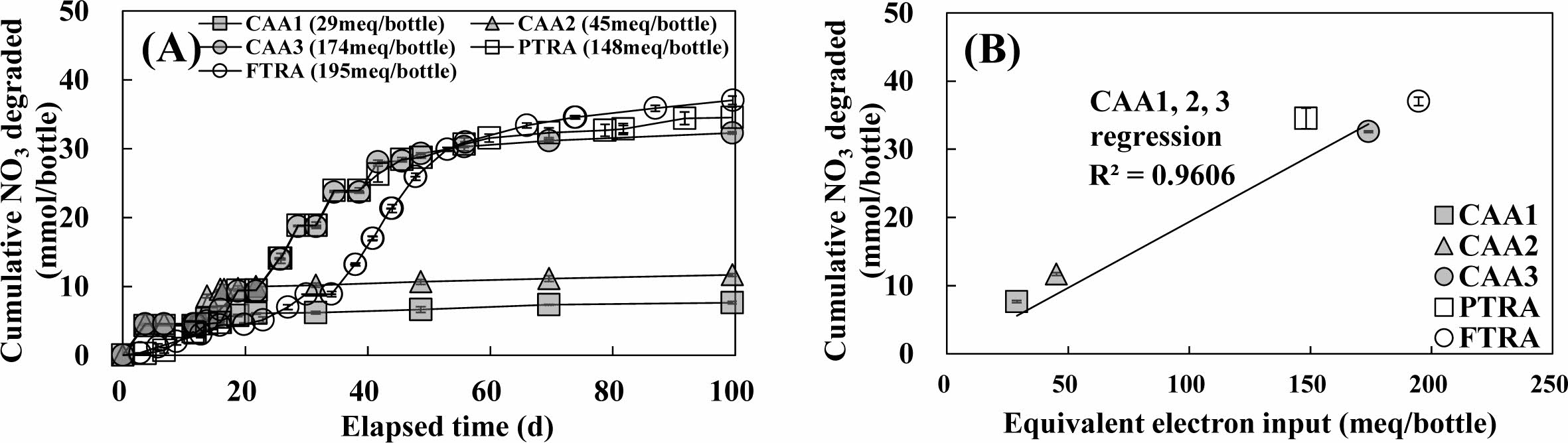
구연산의 질산성질소 탈질 가능성 평가를 위해 구축한 반응조들의 누적 질산성질소 분해량을 산출한 결과를 Fig. 5(A)에 종합하였다. 농도별 액상 구연산을 주입한 CAA1, CAA2, CAA3 반응조에서는 각각 7.7 mmol/bottle, 11.7 mmol/bottle, 32.3 mmol/bottle의 질산성질소가 분해되는 것으로 나타났다. 또한 Mielcarek et al.(2017)은 생물학적 질산성질소의 탈질에 구연산이 매우 효율적인 탄소원임을 보고한 것을 고려하면, 본 실험에서 주입한 구연산이 생물학적 탈질소화 반응을 촉진하여 질산성질소를 제거함을 입증하였다. 구연산이 생물학적 탈질 반응에 탄소원/전자공여체로 사용된다는 가정 아래 CAA3와 동일한 양의 전자가 방출이 되도록 푸마르산 주입량을 주입한 서방형 탄소원 침전 정제 PTRA에서는 약 34.5 mmol/bottle의 질산성질소 제거율을 보였다. 이렇게 CAA3과 PTRA 반응조에서 유사한 질사성질소 제거량은 구연산과 푸마르산이 생물학적 종속영양 탈질 기작의 탄소원/전자공여체로서 유사한 효율을 보인다는 것을 의미한다. 특히, 균등한 양의 푸마르산을 포함하고 부유제로 구연산이 주입된 부유성 서방형 정제인 FTRA 반응조에서는 PTRA 반응조 대비 2.5 mmol/bottle의 질산성질소가 추가로 분해되어 총 37.0 mmol/bottle의 질산성질소가 분해되었다. Fig. 3(B_2)에 따르면 FT에 포함된 구연산 중 60%(1.68 mmol)가 생물학적 반응에 사용된다는 점을 고려하고, 식 3의 energetic model에 따라 구연산인 질산성질소의 탈질에 소모된다고 가정하면 정제 내 포함된 구연산에 의해 제거가능한 이론적인 질산성질소 양은 약 2.6 mmol/bottle 이다. 따라서 PTRA 대비 증가한 FTRA에서의 질산성질소는 정제 내 존재하는 구연산에 의한 영향임을 확인하였다.
모든 반응조에서 동일한 시점의 누적 질산성질소 분해량을 주입한 탄소원(푸마르산 및 구연산)의 전자 주입량에 따라 Fig. 5(B)에 도식하여 선형 회귀분석을 수행한 결과, 푸마르산 및 구연산의 양에 따른 전자발생량과 질산성질소 제거량은 선형으로 증가함을 확인할 수 있었다.
|
Fig. 1 Citrate mass in Citric Acid Control (CAC), Citric Acid Active (CAA1, CAA2, CAA3) reactor. |
|
Fig. 2 Nitrate mass (A_1, B_1, C_1), cumulative degraded nitrate mass (A_1, B_1, C_1), biological denitrification byproducts mass (A_2, B_2, C_2) in CAA1 (A_1, 2), CAA2 (B_1, 2), CAA3 (C_1, 2) reactor. |
|
Fig. 3 Fumarate released mass ratio (A_1, B_1), citrate released mass ratio (A_2, B_2) in PTRC, PTRA (A_1, 2), FTRC, FTRA (B_1, 2) reactor |
|
Fig. 4 Nitrate mass (A_1, B_1), cumulative degraded nitrate mass (A_1, B_1), biological denitrification byproducts mass (A_2, B_2) in PTRC, PTRA (A_1, 2), FTRC, FTRA (B_1, 2) reactor. |
|
Fig. 5 Cumulative degraded nitrate mass along time (A), cumulative degraded nitrate mass versus equivalent electron input at 100 day elapsed (B) in CAA, PTRA, FTRA reactor. |
본 연구에서는 부유형 탄소원 정제 내 포함된 부유제로서 첨가한 구연산이 질산성질소의 생물학적 탈질소화 반응에 미치는 영향을 확인하고자 액상 구연산, 푸마르산 기반 침전형 탄소원 정제 및 부유형 탄소원 정제를 이용해 질산성질소 제거효율을 평가하였다. 연구 결과, 구연산 주입량과 질산성질소의 분해량이 비례하고, 동일한 전자의 액상 구연산과 정제 내 푸마르산에 의한 질산성질소 제거 효율이 유사하다는 점, 그리고 질산성질소 제거량이 구연산이 포함되지 않은 침전형 탄소원 정제 대비 구연산이 추가된 부유형 정제에서 추가된 구연산에 의해 제거 가능한 질산성질소 양 이론치와 유사하게 증가한다는 것을 확인하였다. 따라서 부유형 탄소원 정제 내 함유된 구연산은 정제의 부유 반응에 소모될 뿐만 아니라, 질산성질소의 종속영양 탈질소화 반응의 탄소원 또는 전자공여체로 사용 가능함을 확인하였다. 따라서 서방형 탄소원 정제를 기반으로 한 질산성질소 정화공정의 설계 시, 이와 같은 영향을 고려해서 정제의 투입량 등의 설계에 반영해야 한다고 판단된다.
이 논문은 2020년 한국방송통신대학교 학술연구비 지원을 받아 수행되었습니다.
- 1. Frey, B. and Rieder, S.R., 2013, Response of forest soil bacterial communities to mercury chloride application, Soil Biol. Biochem., 65, 329-337.
-

- 2. Giammarino, M. and Quatto, P., 2015, Nitrates in drinking water: relation with intensive livestock production, J. Prev. Med. Hyg., 56(4), E187-E189.
- 3. Han, K., Yoon, J., Yeum, Y., Park, S., Kim, H.K., Kim, M., Chung, H.M., Kwon, S., Yun, S.-T. and Kim, Y., 2020, Efficacy of in situ well-based denitrification bio-barrier (WDB) remediating high nitrate flux in groundwater near a stock-raising complex, J. Environ. Manage., 258, 110004.
-

- 4. Heinrich, A., Sullivan, D., and Moore, A.D., 2022, Indicators of lime reactivity in soil: particle size, carbon dioxide evolution, and citric acid titration, Arch. Agron. Soil Sci., 68(6), 732-748.
-

- 5. Hiller-Bittrolff, K., Foreman, K., Bulseco-McKim, A.N., Benoit, J., and Bowen, J.L., 2018, Effects of mercury addition on microbial community composition and nitrate removal inside permeable reactive barriers, Environ. Pollut., 242, 797-806.
-

- 6. Kim, K.H., Yun, S.T., Mayer, B., Lee, J.H., Kim, T.S., and Kim, H.K., 2015, Quantification of nitrate sources in groundwater using hydrochemical and dual isotopic data combined with a Bayesian mixing model, Agric. Ecosyst. Environ., 199, 369-381.
-

- 7. Mielcarek, A., Rodziewicz, J., Janczukowicz, W., Dabrowska, D., Ciesielski, S., Thornton, A., and Struk-Soko©©owska, J., 2017, Citric acid application for denitrification process support in biofilm reactor, Chemosphere, 171, 512-519.
-

- 8. Nickerson, B., Kong, A., Gerst, P., and Kao, S., 2018, Correlation of dissolution and disintegration results for an immediate-release tablet, J. Pharm. Biomed. Anal., 150, 333-340.
-

- 9. NIER, 2012, Survey on the background and pollution of groundwater in livestock area.
- 10. NIER, 2021, Nirate management for groundwater quality improvement in agricultural and livestock area (V).
- 11. Park, S., Kim, H.K., Kim, D.H., Lee, G.M., Yoon, J., Choi, H., Kim, M., Han, K., Kim, Y., and Chung, H.M., 2019, The effectiveness of injected carbon sources in enhancing the denitrifying processes in groundwater with high nitrate concentrations, Process Saf. Environ. Prot., 131, 205-211.
-

- 12. Patel, S., Scott, N., Patel, K., Mohylyuk, V., McAuley, W.J., and Liu, F., 2020, Easy to swallow ¡°Instant¡± jelly formulations for sustained release gliclazide delivery, J. Pharm. Sci., 109(8), 2474-2484.
-

- 13. Ribera-Guardia, A., Kassotaki, E., Gutierrez, O., and Pijuan, M., 2014, Effect of carbon source and competition for electrons on nitrous oxide reduction in a mixed denitrifying microbial community, Process Biochem., 49(12), 2228-2234.
-

- 14. Rittmann, B.E. and McCarty, P.L., 2001, Environmental biotechnology: principles and applications, McGraw-Hill Education.
- 15. van der Schans, M.L., Harter, T., Leijnse, A., Mathews, M.C., and Meyer, R.D., 2009, Characterizing sources of nitrate leaching from an irrigated dairy farm in Merced County, California, J. Contam. Hydrol., 110(1-2), 9-21.
-

- 16. Vancheeswaran, S., Halden, R.U., Williamson, K.J., Ingle, J.D., and Semprini, L., 1999, Abiotic and biological transformation of tetraalkoxysilanes and trichloroethene/cis-1, 2-dichloroethene cometabolism driven by tetrabutoxysilane-degrading microorganisms. Environ. Sci. Technol., 33(7), 1077-1085.
-

- 17. Wang, Y., Wiatrowski, H.A., John, R., Lin, C.C., Young, L.Y., Kerkhof, L.J., Yee, N., and Barkay, T., 2013, Impact of mercury on denitrification and denitrifying microbial communities in nitrate enrichments of subsurface sediments, Biodegradation, 24(1), 33-46.
-

- 18. Yeum, Y., Han, K., Kang, J.H., Kim, D.W., Park, C.W., Kwon, S., and Kim, Y., 2020, Production, characterization, and evaluation of two types of slow-releasing carbon source tablets for in-situ heterotrophic nitrate denitrification in aquifers, Chemosphere, 260, 127478.
-

- 19. Yu, S., and Semprini, L., 2002, Comparison of trichloroethylene reductive dehalogenation by microbial communities stimulated on silicon-based organic compounds as slow-release anaerobic substrates. Water Res., 36(20), 4985-4996.
-

 This Article
This Article
-
2022; 27(3): 41-49
Published on Jun 30, 2022
- 10.7857/JSGE.2022.27.3.041
- Received on May 24, 2022
- Revised on May 24, 2022
- Accepted on Jun 21, 2022
 Services
Services
Shared
 Correspondence to
Correspondence to
- Sooyoul Kwon
-
Department of Environmental Health, Korea National Open University, Seoul 03087, Korea
- E-mail: sykwon@knou.ac.kr





