- Characteristics of the Microbial Community Responding to the Vertical Distribution of TPH Concentrations in the Petroleum-Contaminated Site
Soo Min Song1,2·Hee Sun Moon1,2*·Ji Yeon Han3·Jehyun Shin1·Seung Ho Jeong1·Chan-Duck Jeong4·Sunghyen Cho5
1Groundwater Environment Research Center, Climate Change Response Division, Korea Institute of Geoscience and Mineral Resources (KIGAM)
2Geological Science, University of Science and Technology (UST)
3Hanwool Life Science Ltd.
4Future Rural Research Office, Rural Research Institute, Korea Rural Community Corporation
5National Instrumentation Center for Environmental Management (NICEM), Seoul National University- 유류오염지역 부지 내 TPH 수직 농도 분포에 따른 미생물 생태 특성
송수민1,2·문희선1,2*·한지연3·신제현1·정승호1·정찬덕4·조성현5
1한국지질자원연구원 기후변화대응연구본부 지하수환경연구센터
2과학기술연합대학원대학교 지질과학전공
3㈜한울생명과학
4한국농어촌공사 농어촌연구원 미래농어촌연구소
5서울대학교 농생명과학공동기기원This article is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
In this study, the TPH(Total Petroleum Hydrocarbon) contamination and microbial ecological characteristics in petroleum-contaminated site were investigated through the correlation among the vertical TPH contamination distribution of the site, the geochemical characteristics, and the indigenous microbial ecology. The high TPH concentration showed in the vicinity of 3~4 m or less which is thought to be affected by vertical movement due to the impervious clay layer. In addition, the TPH concentration was found to have a positive correlation with Fe2+, TOC concentration, and the number of petroleum-degrading bacteria, and a negative correlation with the microbial community diversity. The microbial community according to the vertical distribution of TPH showed that Proteobacteria and Firmicutes at the phylum level were dominant in this study area as a whole, and they competed with each other. In particular, it was confirmed that the difference in the microbial community was different due to the difference in the degree of vertical TPH contamination. In addition, the genera Acidovorax, Leptolinea, Rugoshibacter, and Smithella appeared dominant in the samples in which TPH was detected, which is considered to be the microorganisms involved in the degradation of TPH in this study area. It is expected that this study can be used as an important data to understand the contamination characteristics and biogeochemical and microbial characteristics of these TPH-contaminated sites.
Keywords: TPH (Total Petroleum Hydrocarbon), Ferrous iron, Microbial community, Proteobacteria, Firmicutes
석유화학산업활동의 증가로 유류에 대한 수요는 날로 증가하고, 이에 따른 유류 누출 사고로 인한 환경오염 또한 증가하고 있는 추세이며(Lai et al., 2009), 특히, 산업단지공장 내 유류지하 저장시설, 주유소의 누출로 인한 오염, (구)군부대에서의 부적절한 관리로 인한 유류 오염 사고는 토양 및 지하수의 오염과 주변 생태계, 그리고 중추신경계 장애 등 인체에 잠재적 위해성을 가지고 있다(Adams et al., 2020; Zheng et al., 2021).
유류는 linear chain alkane, cycloalkanes, polycyclic aromatic hydrocarbon과 같은 수백가지의 복잡한 석유계 총탄화수소(Total Petroleum Hydrocarbon, TPH)를 포함하고 있으며, TPH에 의해 토양 및 지하수가 오염되게 되면 시각적으로 확인이 어려울 뿐만 아니라 토양 및 지하수 환경의 불균질성으로 인해 오염 범위와 정도를 판단하기가 쉽지 않다(Lee and Chang, 2019). 또한, 토양은 자정능력을 상실하게 되고 생산성이 저하될 뿐만 아니라, 전체적인 토양 생태계에 영향을 주게 된다(Kim and Cho, 2006). 한편, 불포화대를 통과한 석유계 총탄화수소 화합물은 지하수까지 도달할 수 있는데, 느린 지하수 유속과 높은 소수성의 특징으로 분해가 잘 이루어지지 않아 장기간 오염을 유발한다(Li et al., 2018).
1970년 후반부터 지하수와 토양 정화기술 개발이 선진국을 필두로 하여 우리나라는 1990년대 후반에 본격적인 연구가 진행되었는데(Han et al., 2008), 유류오염 토양 정화의 대표적인 방법들 중 하나인 토양증기추출법(Soil Vapor Extraction), 토양세척법(Soil Washing), 화학적 산화/환원법(Chemical Oxidation/Reduction) 등의 물리화학적 방법은 비용이 너무 많이 들고 2차 오염, 소음/진동, 지역주민에게 불편함, 환경 미화에 악영향 등 문제점이 제기되고 있다(Kim, 2010). 한편, 생분해법(Biodegrada- tion), 생물학적 통풍법(Bioventing), 토양경작법(Landfar- ming)과 같은 생물학적 방법들은 석유화합물에 관련되는 사슬 구조와 방향족 탄화수소들을 에너지원으로 이용하여 생물학적으로 분해하는 방법으로(Barker et al., 1987) 상대적으로 경제적이며 친환경적이나 미생물 생장에 적합한 환경조건이 구비되어야 한다는 한계도 있다(Prenafeta-Boldú et al., 2002; Siles and Margesin, 2018).
이와 같은 생물학적 방법 또는 자연정화기법과 같은 부지의 생물학적 및 생지화학적 특성을 TPH 오염 부지 정화기술에 적용하기 위해서 해당 부지의 수리지질학적 특성은 물론 TPH 오염분포 및 생지화학적 환경특성, 미생물 생태 등의 현장 특성에 기본적인 이해가 선행되어야 하며, TPH 오염부지의 정화 기간 동안의 미생물 군집 특성 및 미생물 활성의 변화 모니터링에 대한 연구가 매우 중요하다(Chaudhary et al., 2021; Li et al., 2020a; Siles and Margesin, 2018).
토양 및 지하수 환경 내의 토착 미생물들 중에는 석유계 총탄화수소를 전자공여체로 이용할 수 있는 미생물들이 있으며(Chaudhary et al., 2021; Gutierrez et al., 2013; Lopez-Echartea et al., 2020; Yergeau et al., 2012), Siles와 Margesin(2018)은 TPH 오염 토양의 생물 정화 공법 적용 동안 장기적인 미생물 생태 다양성 및 구조를 분석한 결과, Gammaproteobacteria와 Bacteroidia강이 TPH의 자연저감 및 생물정화동안 우점하여 나타났다고 보고하였다. 평균 TPH 농도가 3,819 mg/kg인 디젤로 오염된 토양(2.59% 수분함량 및 pH 6.7 조건)에서는 Bacillus sp.와 Cupriavidus sp. 종의 TPH 제거효율이 모두 87%이상으로 나타났다(Park and Lee, 2012). 또한, 오염되지 않은 토양보다 유류로 오염된 토양에서 종 다양성이 낮은 것으로 보고되었으며, Chloroflexi, Firmicutes 문이 유류에 의한 오염 토양에서 상대적으로 높은 풍부도를 나타냈다(Sutton et al, 2013). 이와 같이 유류의 주요성분과 전자수용체의 이용가능성에 따라 미생물 군집이 크게 좌우하여 우점종이 결정되며, 연구부지의 지질 및 생지화학적 특성에 따라 세부적인 미생물 군집 구조의 차이가 나타난다(Lee and Park, 2008),
본 연구에서는 유류오염부지의 TPH 오염분포와 토착 미생물 군집 및 지질의 지화학 특성의 상관 관계 등을 통해 현장 부지 오염 특성을 파악하고자, TPH의 수직적인 농도 분포에 따른 미생물 생태 특성을 비교해보고, TPH 노출에 따른 토착 미생물 군집 구조사이의 상호작용 및 지질 매질의 생지화학적 특성에 대해 알아보고자 하였다.
2.1. 연구 부지의 지형 및 지질
유류로 오염된 연구 지역은 국방부와 한국농어촌공사의 협조를 받아 실제 유류오염정화가 이루어지고 있는 현장에서 수행하였으며 백악기 경상계 낙동층군 낙동층을 신생대 제4기 신기하성층인 충적층이 피복하는 구조로 이루어져 있고 대표 암상은 사암, 셰일 및 갈색역암으로 구성되어 있다(Fig. 1(a)).
항공사진을 바탕으로 살펴본 결과, 연구지역은 1954년 철도와 논으로 토지를 이용하였으며, 1968년부터 2015년까지 여러 곳에 군부대에서 사용한 지상유류저장시설이 존재 했던 곳으로 확인된다(Fig. 1(b)).
연구지역 시추 코어 로깅 분석 결과, 전체적으로 sand 혹은 sand/silt질의 토양 특성을 나타냈으며, 지하수위는 2~2.4 m 범위에서 변화하고 연구부지의 북동쪽이 높게 확인되어 남서쪽으로 지하수의 유동이 형성될 것으로 해석된다. 또한 지표 아래 3~4 m 이하 부근에서 상대적으로 점토를 많이 함유한 지층이 관찰되었다.
2.2. 토양 시료 채취 방법
2021년 4월 13일부터 16일까지 연구 지역 내 5 × 5 m2 면적 내 7개 지점(M1~M7)에서 약 10 m 깊이(풍화대)까지 지오프로브(Geoprobe) 시스템이 장착된 토양시료 채취기를 이용하여 1 m 간격으로 불교란시료를 채취하였다. 시료 회수중에 심도별로 교차오염이 발생하지 않도록 1회용 라이너(liner)와 stop pin을 사용하여 시료채취기(sampler)를 세척하면서 채취하였다. 단, 육안으로 확인하였을 때 1 m 내에 입자 크기나 색상이 다르게 나타나는 구간은 0.5 m씩 분리하여 총 83개의 불교란 시료를 채취하였다. TPH 분석을 위한 시료 채취는 토양오염공정시험기준(NIER, 2017)의 ES 07130.b 방법을 적용해 수행하였다.
산화에 따른 철 농도의 변화를 우려하여 토양 내 철 농도는 현장에서 바로 분석하였다. 50 mL 코니칼튜브에 약 5 g을 시료를 채취하여 바로 분석에 이용하였으며, 약 10 g 정도 각각 채취하여 냉장 상태(4oC)를 유지하며 실험실로 운반하여 분석 전까지 -70oC 냉동 보관하였다. TPH, Fe, 미생물 분석을 위한 시료 채취 후, 각 지점의 심도별 채취 토양은 이화학특성 분석을 위해 사용하였다.
2.3. 토양 TPH 농도 및 지질 매질 지화학 특성 분석
각 지점별 석유계 총탄화수소(TPH) 농도와 토양 시료의 지화학 특성 분석(TOC, pH, SO42-, 수분함량) 및 유류분해미생물 균수는 서울대학교 농생명과학공동기기원(NICEM, 서울, 한국)에 의뢰하여 분석하였다. TPH 분석은 토양오염공정시험기준(NIER, 2017)의 ES 07552.1a와 ES 07601.1방법에 따라 GC-FID(7890B; Agilent, USA)를 이용하여 분석하였다.
토양 내 Fe2+ 농도는 0.5 N HCl 5 mL에 토양 1 g을 넣어 추출한 용액 0.1 mL와 Ferrozine 용액(pH7) 4.9 mL를 반응하여 휴대용 분광광도계(DR1900 Spectro- photometer; HACH USA)를 이용하여 562 nm 파장에서 흡광도를 측정하였다. Total Fe 농도는 토양 추출 용액에 6.25 N hydroxylamine 0.2 mL를 넣어 혼합한 후 1시간 반응 후에 0.1 mL 추출하여 Ferrozine 용액 4.9 mL와 반응시킨 후 측정하였다.
2.4. 토양 미생물 DNA 추출 및 군집 분석
TPH 농도에 따른 미생물 생태 특성을 비교하고자 심도 5 m이하의 토양 시료에 대해서 Fast DNA Spin Kit for Soil(MP Bio)을 이용하여 제조사의 방법에 따라 genomic DNA(gDNA)를 추출하였다. 추출된 DNA의 농도와 순도에 대한 QA/QC는 Multiskan SkyHigh Microplate Spec- trophotometer(ThermoFisher scientific; USA)와 아가로스(Agarose)겔을 사용한 전기영동실험을 통해 확인하였다.
추출된 DNA는 16S rRNA gene 유전자의 V3에서 V4 영역을 타겟으로 하는 fusion primers 341F(5’-AATGATACGGCGACCACCGAGATCTACAC-XXXXX XXX-TCGTCGGCAGCGTC-AGATGTGTATAAGAGAC AG-CCTACGGGNGGCWGCAG-3’)와 805R(5’-CAAGC AGAAGACGGCATACGAGAT-XXXXXXXX-GTCTCGTGGGCTCGG-AGATGTGTATAAGAGACAG-GACTACHVGGGTATCTAATCC-3’)를 사용하여 PCR로 증폭시켰고, Quanti-iT PicoGreen dsDNA Assay kit under QuantiFluor System로 정제하였다. 차세대 염기서열 분석(NGS, Next generation sequencing)은 천랩(Chunlab, Inc., 서울, 한국)에서 이루어졌으며, Illumina MiSeq sequencing system (Illumina, USA)을 사용하였다. EzBioCloud 데이터베이스는 VSEARCH의 fastq_mergepairs를 이용하여 기본 매개변수와 paired-end 시퀀스 데이터를 병합하였다. 프라이머는 유사도 0.8의 cut off 후 Myers & Miller의 정렬 알고리즘으로 정리하였다. EzBioCloud 16S rRNA gene 데이터베이스는 VSEARCH의 usearch_global을 사용한 taxonomic assignment에 사용하였다(Edgar, 2010). Chimeric read는 UCHIME 알고리즘 및 EzBioCloud의 키메라가 아닌 16S rRNA gene 데이터베이스를 사용하여 종 수준이 <97% 이하의 유사성을 가지는 read에서 필터링하였고 EzBioCloud 데이터베이스에서 종 수준(<97% 유사성)으로 식별되지 않은 read를 수집하고 cluster_fast command2를 사용하여 추가 OTU를 생성하기 위해 de-novo 클러스터링을 수행하였다.
2.5. 통계분석
모든 실험 결과는 EXCEL 2021의 통계 데이터 분석을 사용하여 수행되었다. 상관관계를 평가하기 위해 신뢰수준 95%에서 correlation analysis를 수행하여 결과의 통계학적 유의성을 평가하였다(p<0.05).

|
Fig. 1 (a) Geological maps and soil sampling points, (b) land use from 1919 to 2015 of the study area. |
3.1. 심도별 TPH 농도 분포 및 지화학특성
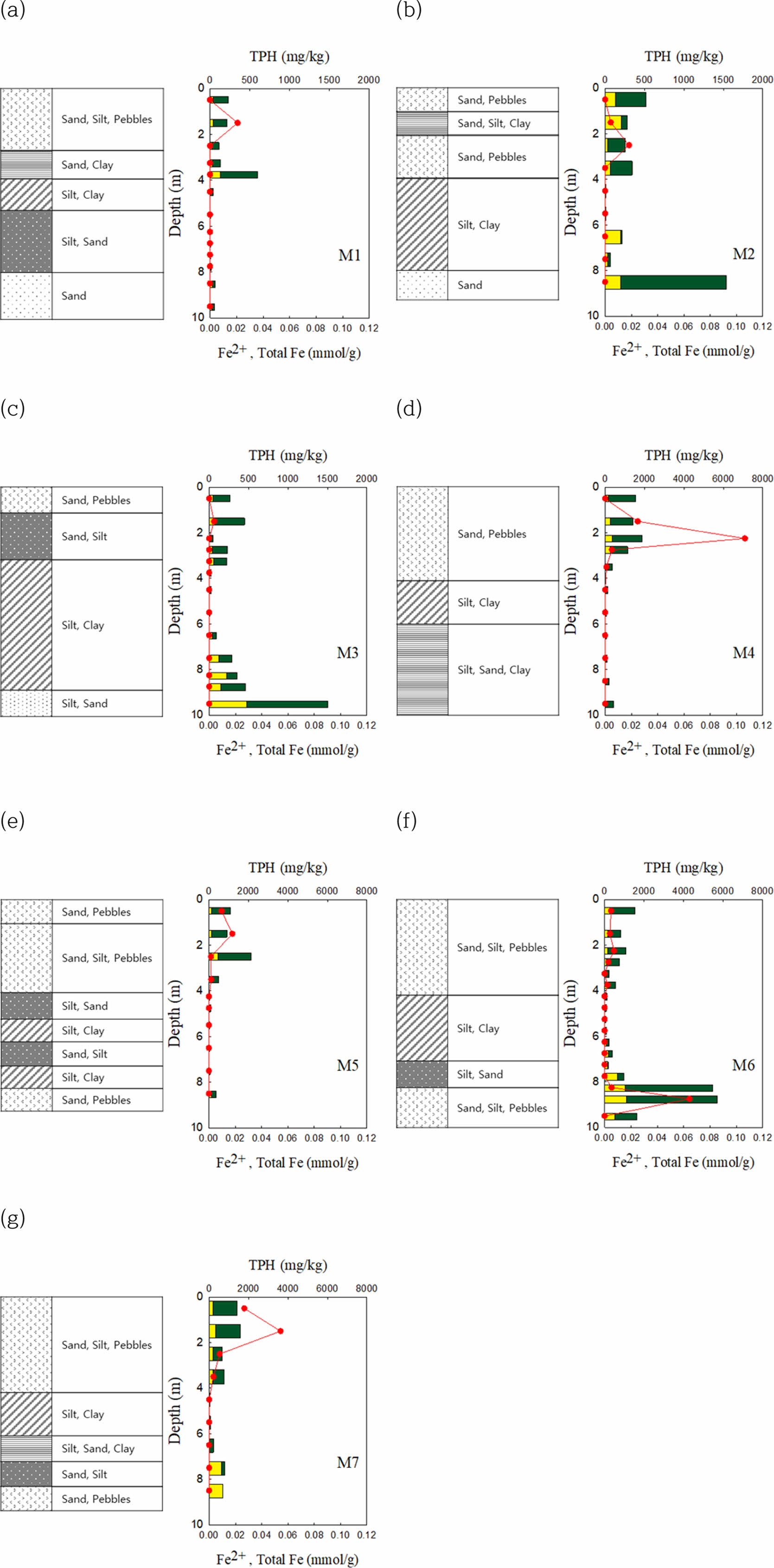
전체적으로 테스트베드(5 × 5 m2) 상부지층 3 m 이내 토양층에서 주로 TPH 농도가 검출되었다. 지하수 유동은 북동쪽에서 남서쪽으로 형성되어 남서쪽에 위치한 M4와 M6지점에서 약 2 cm 두께의 LNAPL층을 눈으로 확인하였다.
M1(Fig. 2(a)), M2(Fig. 2(b)), M3(Fig. 2(c)) 지점에서는 1.5~3 m 이내 심도에서만 약 62~345 mg/kg의 상대적으로 낮은 TPH 농도가 관찰된 반면, M4~M7(Fig 2(d), (e), (f), (g)) 지점에서는 M1~M3에 비해 높은 TPH 농도가 관찰되었는데, 특히, M4 지점은 약 2~2.5 m 심도에서 6,000 mg/kg 이상의 매우 높은 농도의 TPH가 검출되었다(Fig. 2(d)). M5지점에서는 1~2 m 심도에서 1,000 mg/kg 이상의 TPH가 검출되었으며, M6에서는 8.75~9 m 심도에서 약 4,000 mg/kg, M7에서는 1~2 m 심도에서 3,500 mg/kg의 TPH가 검출되었다(Fig. 2 (e)와 (f)).
현장의 심도별 산화 환원 및 지화학 특성을 파악하기 위해 Fe2+와 Total Fe 농도를 분석한 결과 모든 지점에서 심도가 깊어지면서 4 m 이내까지 Fe2+농도는 증가하다 그 이후 심도가 깊어질수록 다시 감소하는 특징을 나타내며 전체적으로 Total Fe의 비율이 높게 나타난다(Fig. 2). 특히 M2와 M3, M6지점의 약 8 m 깊이부터 철 농도가 상대적으로 높은데, 바로 상부에 위치한 약 3~4 m의 silt, clay층으로 인해 혐기 환경이 조성되어 미생물의 철 환원 반응이 진행되고 있음을 시사한다.
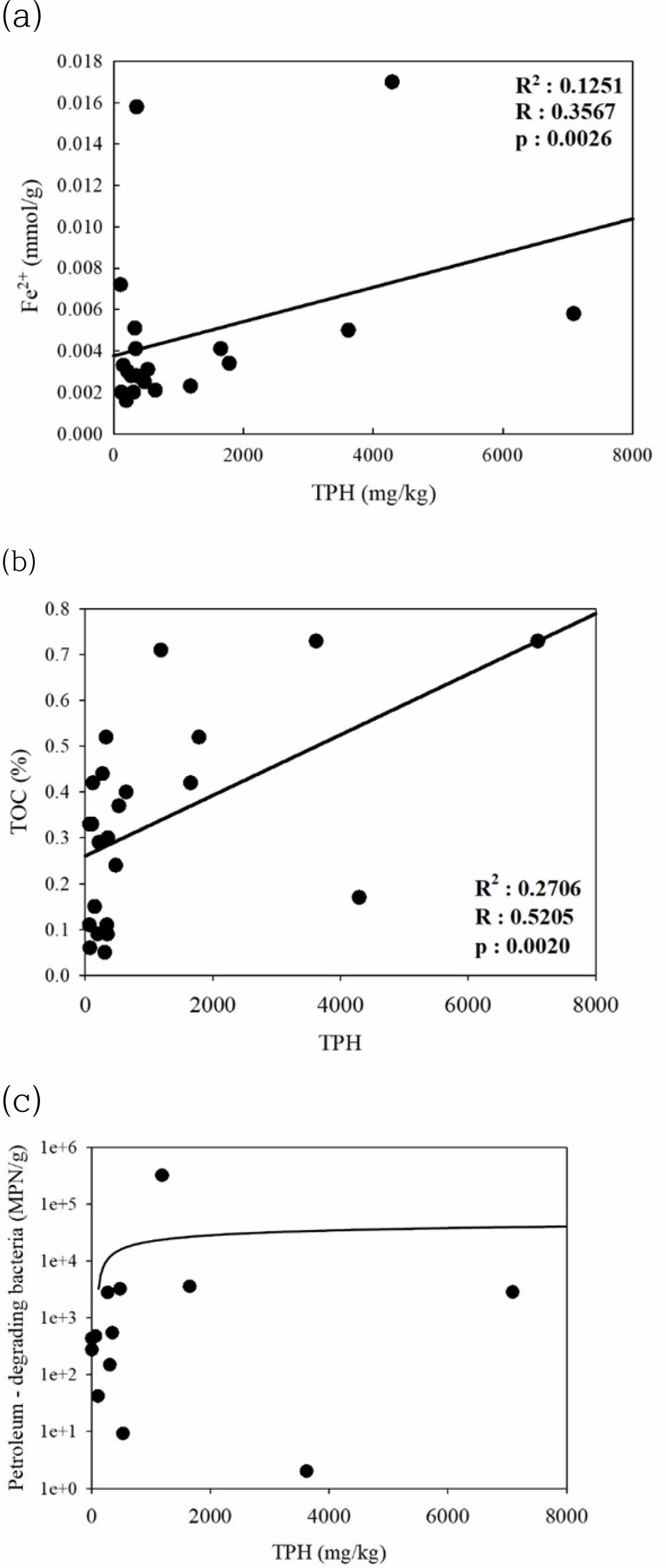
TPH의 오염농도가 높은 심도에서 Fe2+의 농도 또한 높게 관찰되는데 이는 TPH가 고농도로 오염되어 있는 심도에서, 산소가 급격히 소모되어 환원 환경을 형성한 것으로 사료되며, Fe3+을 전자수용체로 이용한 TPH의 생분해기작 가능성을 시사하였다. 또한, 시추 주상도에서 볼 수 있듯이, M1~M4와 M7지점은 지표 아래 3.5 m부터, M5, M6은 약 4 m 부근부터 clay층이 나타나는 구간에서 Fe2+와 TPH 농도가 줄어드는 결과를 확인하였다. 특히 M6구역의 심부층(8.75 m)에서 높은 농도의 TPH가 확인되었는데 이는 또다른 경로를 통해 아래로 축적된 것으로 확인된다(Fig. 2(f)). Fe2+와 TPH의 상관성을 파악하기 위해 통계분석을 실시한 결과, 양의 상관관계를 가지고 있음을 알 수 있다(R=0.3567) (Fig. 3(a)). 그러나, 상대적으로 고농도의 TPH 토양에서는 상관성이 비례하여 증가하지는 않는 것으로 나타났다.
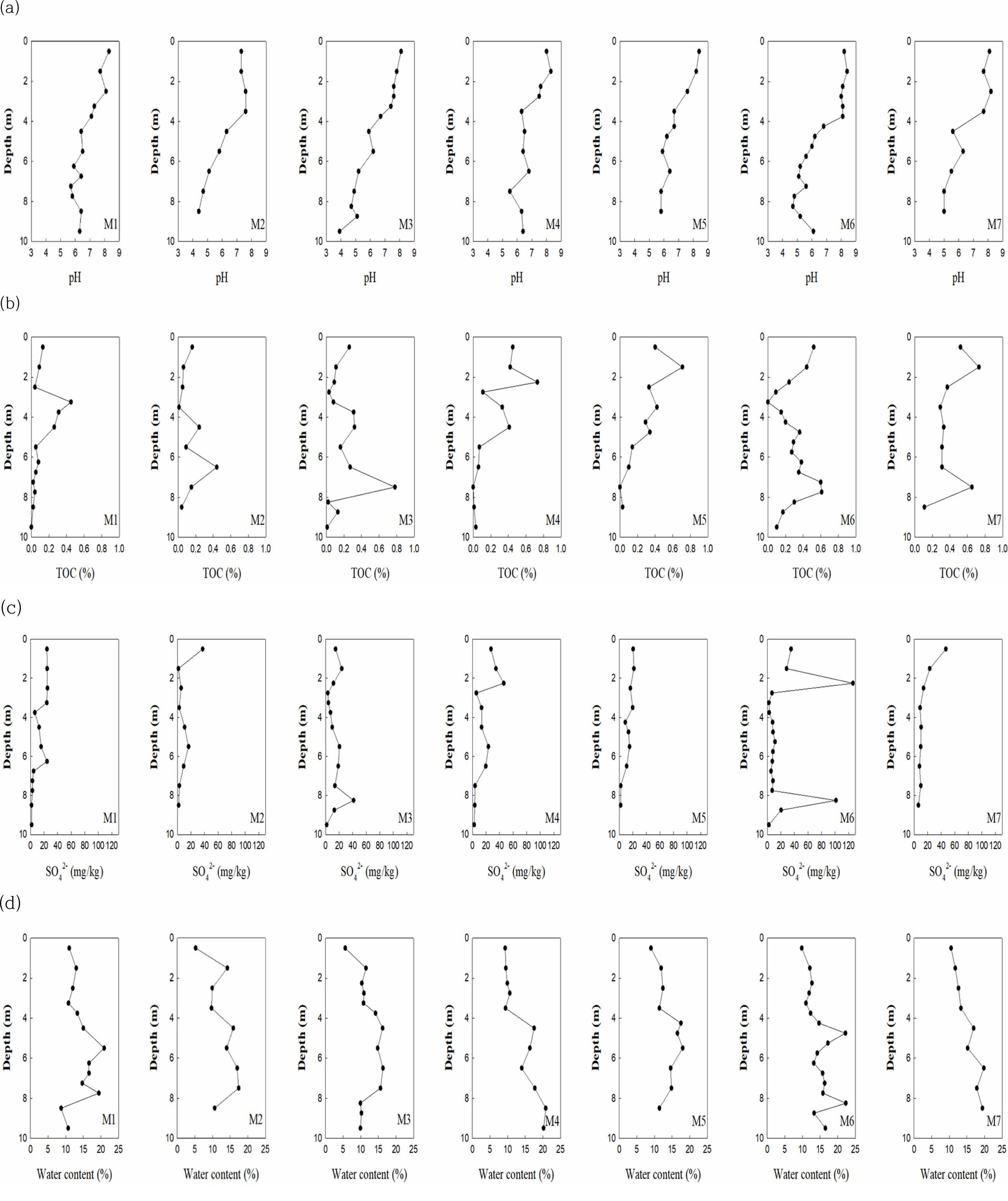
동일한 시료의 이화학적 분석을 통해 pH, TOC, 수분함량, SO42-를 깊이별로 확인하였다(Fig. 4). 시추 코어의 심도별 pH는(Fig. 4(a)) M1, M4, M5, M7지역에서 상부층 0~4 m에서는 7.1~8.4 정도의 범위로 중성에서 약알칼리성을 나타내다 4 m 이후에서 5.0~6.8 범위의 약산성에서 중성을 나타냈다. M2는 0~4 m까지 7.3~7.6의 중성을 나타내다 깊어질수록 산도가 높아지는 모습이 보이며 M3지역의 최대 심도인 10 m에서 pH가 가장 낮았다. M6는 4 m까지 8.0~8.4정도의 알칼리성을 나타내고 4 m 이후 4.7~6.8 정도로 산도가 높아지다가 8 m 깊이부터 다시 6.1 정도를 나타냈다.
TOC 분석 결과는(Fig. 4(b)) M1, M2, M3 지역에서 M4, M5, M6, M7지역에 비해 3 m 깊이까지 상대적으로 낮게 나타나고 M3의 7~8 m 구간에서 0.78%의 최댓값을 나타냈으며, M4, M5는 0~8 m 구간에서 심부로 내려갈수록 줄어들고 이후 0.03%의 낮은 값을 나타냈다. M6은 3 m 부근에서 0%까지 감소하다가 다시 상승하는 추세를 보이며 M7또한 마찬가지로 감소하다 상승하는 결과를 보인다. 한편, 시추 코어 내 TOC 농도는 TPH 농도가 검출된 23개의 시료들과 양의 상관관계를 나타냈다(R = 0.5205) (Fig. 3(b)). 시추 코어 내 SO42-는(Fig. 4(c)) 유류성분의 오염물질로 인하여 깊이가 깊어짐에 따라 혐기 환경이 조성되어 황산염 환원 반응으로 인해 깊이에 따라 sulfate 농도가 감소하는 것으로 확인된다. 하지만 M6 지역의 깊은 심도인 9 m에서 유일하게 100 mg/kg 이상의 값이 확인되었는데, 이에 대한 뚜렷한 다른 오염원이나 다른 지점과의 뚜렷한 지질 특성은 관찰되지 않았다. 수분함량은(Fig. 4(d)) 대부분 10~20%의 범위로 나타나며 심부로 갈수록 높아지는 추세를 보였는데, 이는 불포화대에서 심부로 들어갈수록 포화대 환경을 형성하기 때문으로 판단된다.
3.2.미생물 군집 분석
3.2.1. 지점별 수직적 미생물 군집 구조 및 생태특성
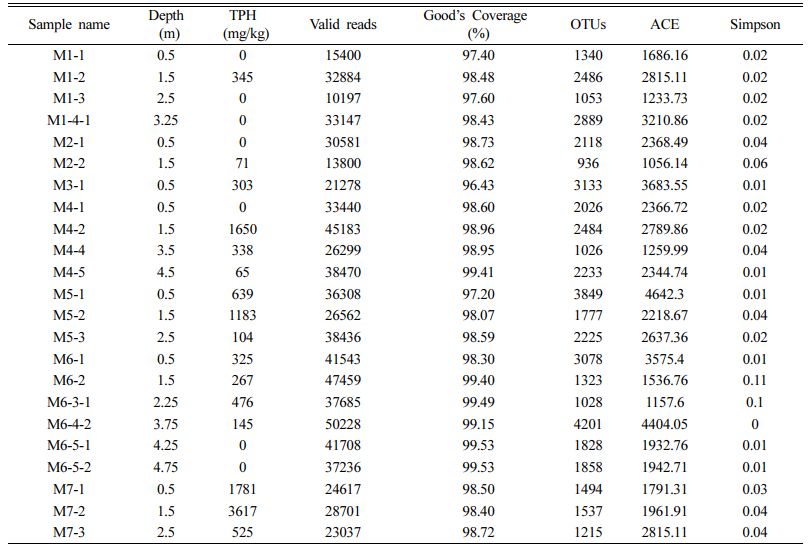
DNA 추출결과, QA/QC를 통과한 총 23개 시료에 대해 16 S rRNA gene에 대한 차세대 염기서열 분석을 수행하여, 미생물 군집 특성 및 α-diversity를 알아보았다(Table 1). 총 23개의 시료에 대한 valid reads와 Good’s coverage의 분석 값은 10197~50228과 96.43~99.53%으로, 신뢰할 수 있는 자료임을 알 수 있다. 각 시료에 해당하는 TPH농도와 미생물 종 풍부성 및 다양성을 나타내는 ACE, Simpson 지수를 함께 확인해본 결과, TPH 농도가 0 mg/kg인 시료들은 Simpson 지수가 0.01에서 0.04범위 내로 나타나지만 TPH가 검출된 시료에서는 0.01에서 0.11의 범위로 나타난다. Simpson 지수는 미생물 종 집중도를 나타내므로 값이 낮을수록 다양성이 높다. 따라서 TPH 농도가 높은 시료에서 다양성이 떨어지고 비교적 TPH 농도가 낮은 시료에서 높아지는 것을 확인할 수 있었으나, TPH가 고농도인 시료는 이와 같은 상관성이 나타나지 않았다(Jiao et al., 2016). 문헌들에 따르면 본 연구 결과와 마찬가지로 TPH와 종 다양성은 음의 상관관계를 가지고 있음을 알 수 있으며 Li et al.(2020)는 TPH로 오염된 토양 미생물들의 alpha 다양성과 OTU 수가 감소하였다고 보고하였다.
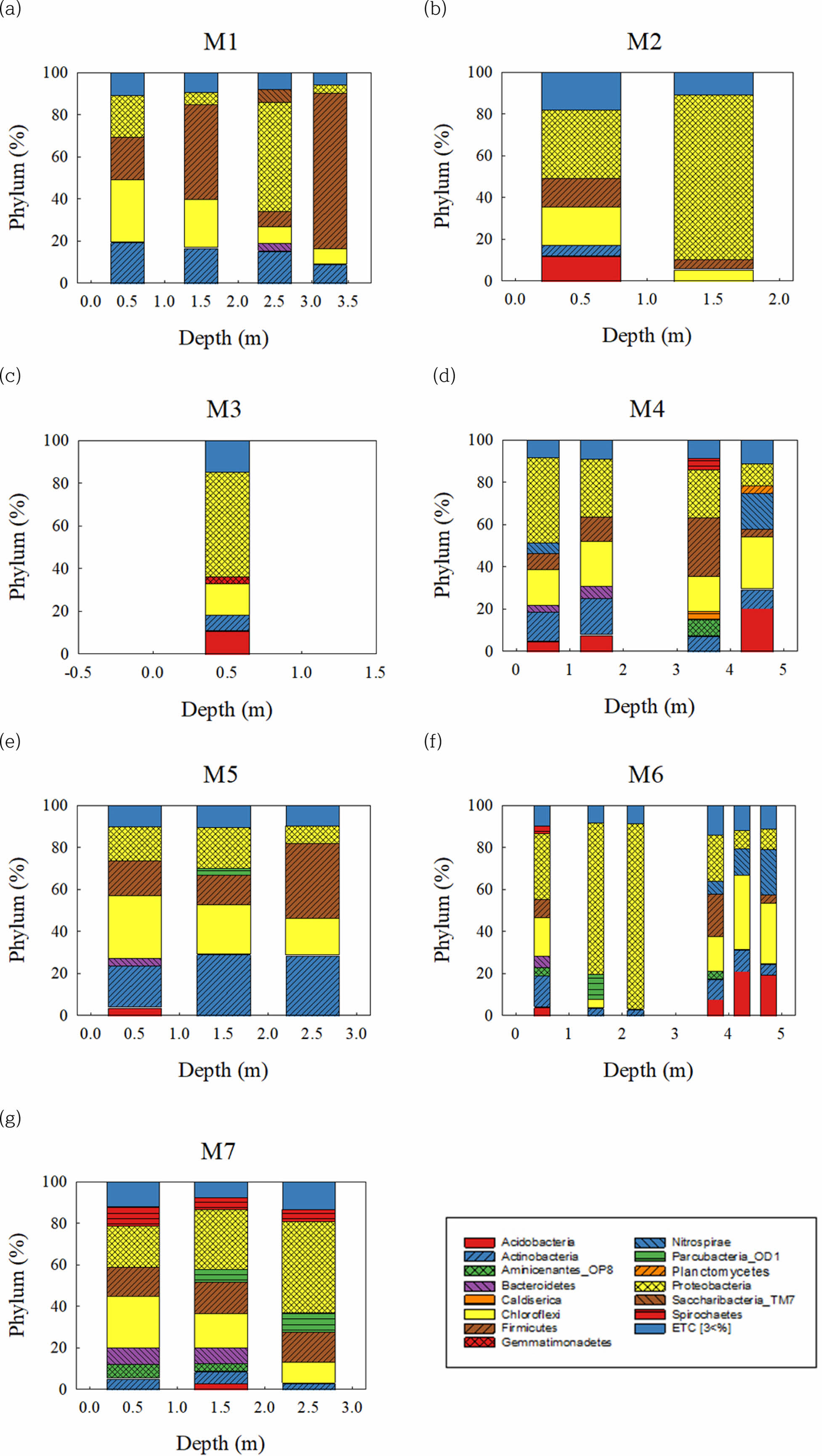
전체적으로 연구지역의 미생물 군집 특성을 phylum 수준에서 살펴보면, Proteobacteria와 Firmicutes가 전체시료에서 모두 검출되었으며 각각 88.5%~4.06%와 74.1%~ 1.14% 범위로 우세하게 나타난다(Fig. 5). M4, M6, M7에 Aminicenantes_OP8이 검출되었고 M1, M2, M5, M7 지점에서 Chloroflexi가 심도가 깊어질수록 검출되는 비율이 줄어드는 추세를 확인할 수 있다.
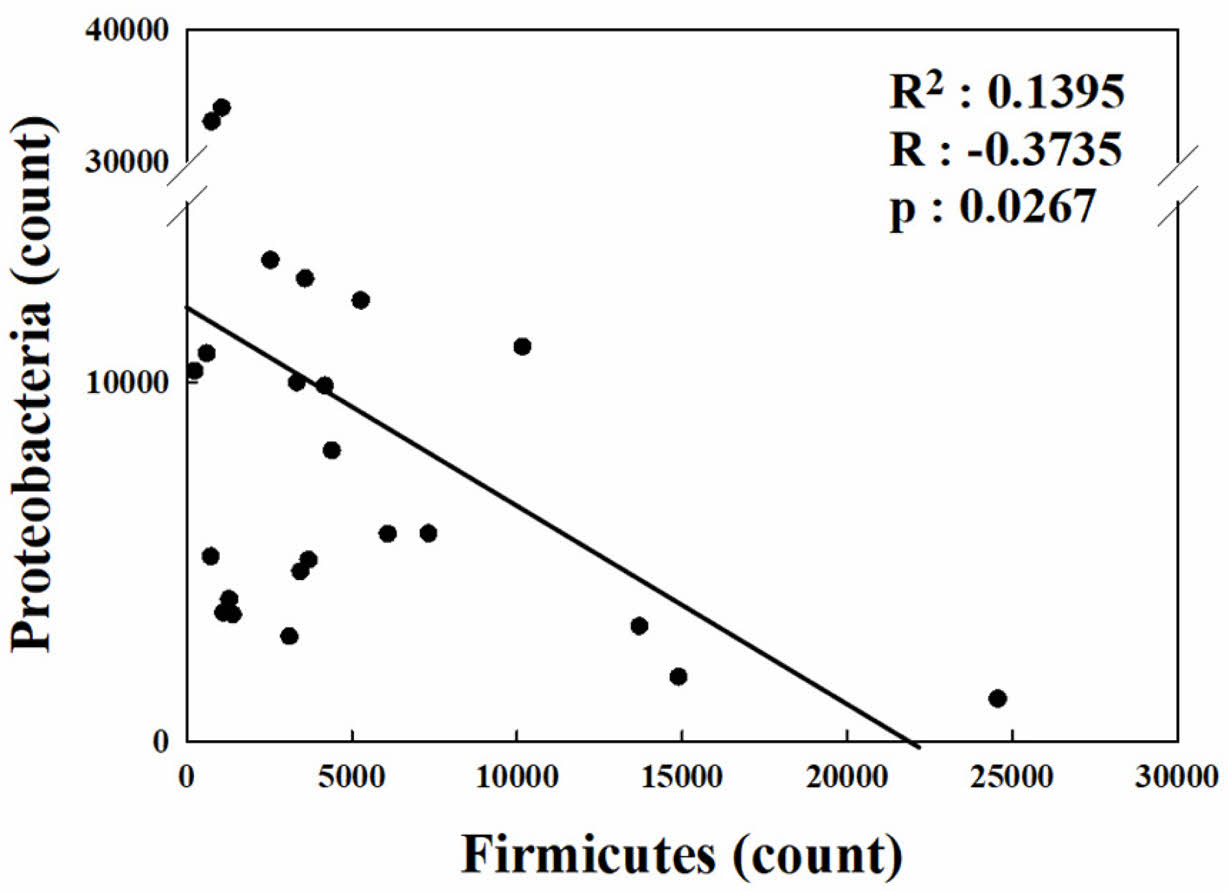
M4 지점의 3.5 m, 4.5 m 구간 토양에서는 유일하게 각각 Caldiserica(4.0%)와 Planctomycetes(3.5%)가 검출되었고 Spirochaetes는 M4의 3.5 m(5.5%), M6의 0.5 m (3.8%)와 M7 구간 전체에서 21.3%가 발견되었다. M3 지점에서 Gemmatimonadetes(3.4%)가 검출되었고 M6의 2.25 m 구간에 위치한 시료에서 Proteobacteria가 전체의 88.5%를 차지하는 특이성을 가지고 있다. Li et al. (2020b) 연구의 유류오염 정화 토양에서 Firmicutes가 Proteobacteria보다 우세하게 나타나는 것을 알 수 있는데 본 연구 지역의 대부분의 시료에서 Proteobactera가 감소하면 Firmicutes가 증가하는 특성을 보였다(p<0.05) (Fig. 6).
한편, Pseudomonas, Rhodococcus, Acinetobacter, Al- canivorax, Sphingomonas, Burkholderia, Arthrobacter, Methylobacterium 속에 속하는 미생물들이 석유계 총탄화수소를 분해하는데 관여한다고 알려져 있으며(Chaudhary et al., 2021; Gutierrez et al., 2013; Lopez-Echartea et al., 2020; Yergeau et al., 2012), 연구 지역에서는 Rho- dococcus가 M1-1과 M4-1에서 2.11%, 0.95% 비율로 나타나고 이외 시료들은 0.08% 이하로 나타난다. 또, Acinetobacter는 모두 0.01% 이하로 검출되었으며 나머지 미생물들은 검출되지 않았다.
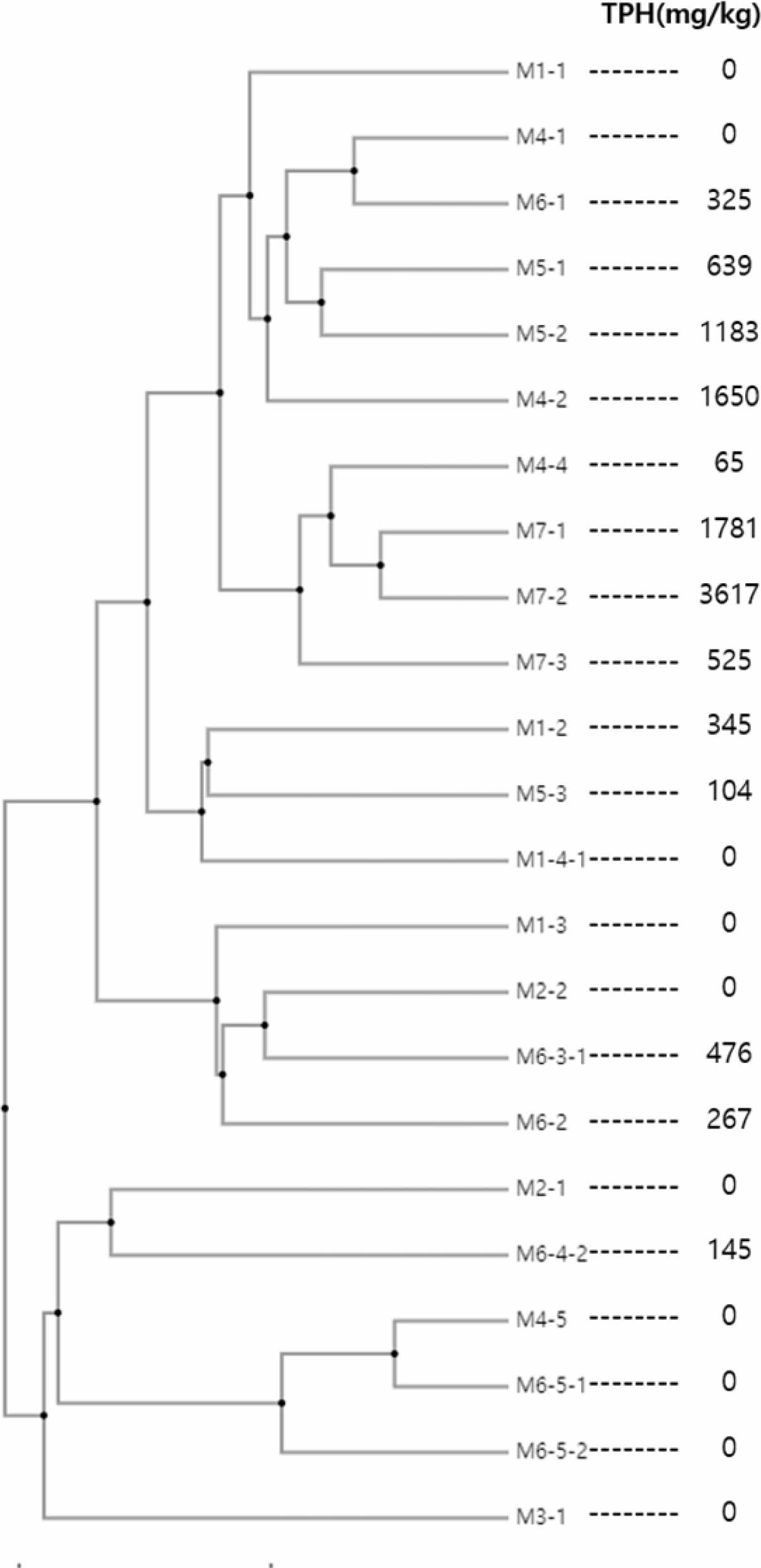
UPGMA(Unweighted Pair Group Method with Arith- metic Mean) Clustering 결과, TPH가 검출되지 않은 시료들은 검출된 시료들 사이사이에 위치하며 M6-1~M5-3은 유사한 미생물 생태 특성을 나타내어, species수준의 미생물 군집 사이 유사성이 토양 내 TPH농도와 관련이 있음을 확인하였다(Fig. 7). 또한, TPH가 저농도일 때 유류분해균수가 증가하다가 일정 농도에 도달하면 증가하지 않고 일정하게 유지되는 것으로 나타났다(Fig. 3(c)).
3.2.2. TPH 농도 검출 유무에 따른 미생물 군집 특성
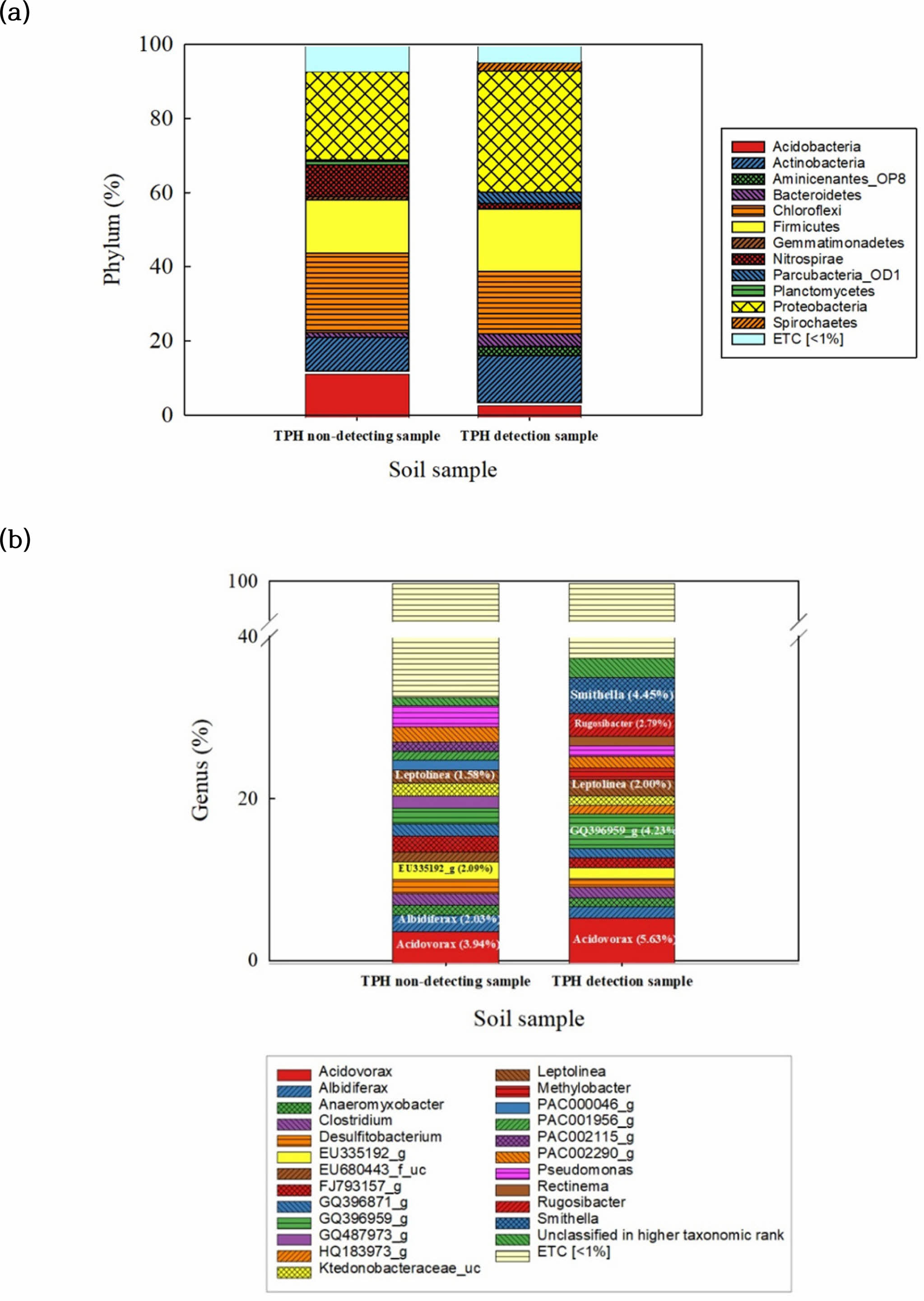
TPH의 검출 유무에 따라 나타나는 미생물 군집 차이를 phylum 수준으로 분석한 결과(Fig. 8(a)) TPH가 검출되지 않은 시료에서 Acidobacteria(9.37%), Nitrospirae(6.32%), 비교적 우세하게 나타나며 TPH가 검출된 시료에서는 Actinobacteria(12.6%), Firmicutes(17.53%), Spiro- chaetes(3.03%), Aminicenantes_OP8이 (2.71%)의 농도로 나타났다. 문헌에 따르면 TPH로 인해 Nitrospirae, Chloroflexi, Planctomycetes들의 다양성을 감소시키는 것으로 알려져 있다(Li et al., 2020a). 따라서 TPH가 검출되지 않은 시료에서만 이들 미생물이 검출되거나 상대적으로 높게 나타나는 것으로 해석된다. TPH가 검출된 시료와 TPH가 검출되지 않은 시료들을 Genus 수준으로 확인해 본 결과(Fig. 8(b)), Proteobacteria 문의 Betapro- teobacteria 강에 속하는 Acidovorax는 각각 3.94%, 5.63%로 나타났으며, Leptolinea는 5.29%, 4.45%로 유사한 비율로 나타나며 TPH 분해에 관여하는 미생물로 확인된다(James et al., 2002; Obuekwe et al., 2009; Wang et al., 2016). 이외에 우세하게 나타나는 속(genus)가 서로 다른데, TPH가 검출되지 않은 시료에서는 Betaproteo- bacteria의 Albidiferax가 3.97%, Nitrospirae의 EU335192_g가 1.50%의 비율로 비교적 높은 비율로 나타난다. TPH가 검출된 시료에서는 Deltaproteobactera의 Smithella가 4.45%, Actinobacteria의 GQ396959_g가 4.23%, Betapro- teobacteria의 Rugoshibacter가 2.79%의 비율로 비교적 우세하게 나타난다. 특히 Rugoshibacter는 디젤로 오염된 토양의 초기상태에서 31.3%로 우세하게 검출되며(Chaudhary et al., 2021), Smithella는 n-alkane을 분해할 수 있다고 알려져 있다(Gray et al., 2011; Ji et al., 2020; Toth and Gieg, 2018). TPH 오염 정도에 따라 미생물 군집 구조가 달라지는 이유는 유류 성분의 농도에 따라 미생물 특성 상 적합한 환경 차이로 인해 나타나는 특징으로 보인다.
|
Fig. 2 The core logs and depth profile of TPH and Fe2+ concentration each sampling site. (The yellow and green bars of the bar graph indicate Fe2+ and Total Fe, respectively. The red line represents TPH). |
|
Fig. 3 Relationship between (a) TPH and Fe2+ concentration; (b) TPH and TOC concentration; (c) TPH concentration and petroleum- degrading bacteria. |
|
Fig. 4 Depth profiles of (a) pH, (b) TOC, (c) SO4 2-, and (d) water content in each sampling site |
|
Fig. 5 Microbial taxonomic compositions in soils of (a) M1, (b) M2, (c) M3, (d) M4, (e) M5, (f) M6, and (g) M7 at phylum level. |
|
Fig. 6 Correlation analysis between abundance of Proteobacteria and Firmicutes in TPH-contaminated site |
|
Fig. 7 UPGMA (Unweighted Pair Group Method with Arithmetic Mean) clustering at species level and TPH concentration. |
|
Fig. 8 Microbial taxonomic compositions of (a) phylum level, and (b) genus level in soil without TPH and with TPH. |
본 연구에서는 유류오염부지의 TPH 수직적인 오염분포와 토착 미생물 군집 및 지질의 지화학 특성의 상관 관계 등을 통해, 연구지역 현장 부지 TPH 오염 및 미생물 생태 특성을 알아보았다. 연구지역 내 TPH 농도는 지하수위가 분포하는 상부 3 m 이내 토양층에서 상대적으로 높게 관찰되었으며, 지하수위 부근에서 NAPL층을 육안으로 확인할 수 있었다. TPH의 농도는 이하 심부로 갈수록 감소하는 특성을 보이는 데 이는 3~4 m 이하 부근에 존재하는 불투수성의 점토층으로 인해 수직적인 이동에 영향을 받은 것으로 판단된다. 또한, 지질 매질 내 TPH 농도는 Fe2+, TOC, 그리고 유류분해균수는 양의 상관관계를 가지는 것으로 나타났으며, 미생물 군집 다양성과는 음의 상관관계를 나타냈다. TPH의 수직적인 농도 분포에 따른 미생물 생태 특성은 전체적으로 Phylum 수준의 Proteo- bacteria와, Firmicutes가 본 연구지역에 우점하여 나타났으며, 이들은 TPH 오염 토양에서 서로 경쟁하는 관계로 나타났다. 특히, 수직적인 TPH 오염 정도의 차이로 인해 미생물 군집의 차이가 달라지는 것으로 확인하였으며, 본 연구지역에서는 Acidovorax, Leptolinea, Rugoshibacter, Smithella속이 TPH가 검출되는 시료에서 우점하여 나타나 본 연구지역의 TPH 분해에 관여하는 미생물로 사료된다.
유류 오염 부지의 효율적인 정화를 위해서는 TPH 오염분포 및 생지화학적 환경특성, 미생물 생태 등의 현장 특성에 기본적인 이해가 매우 중요하며, TPH 오염부지의 정화 기간 동안의 미생물 군집 특성 및 미생물 활성의 변화 모니터링이 필요하다. 본 연구는 이러한 TPH 오염 부지의 오염 특성과 생지화학 및 미생물 특성을 파악하는 데 중요한 자료로 활용될 수 있을 것이라 기대한다.
본 연구 수행을 위해 현장에서 불교란 시료 채취를 도와 주신 NICEM 이동근 연구원님께 감사드립니다. 또한, 본 연구는 환경부의 재원으로 한국환경산업기술원의 ‘지중환경오염위해관리기술개발사업’의 지원을 받아 연구되었습니다(과제번호: 2018002440004).
- 1. Adams, R.H., Ojeda-Castillo, V., Guzmán-Osorio, F. J., Álvarez-Coronel, G., and Domínguez-Rodríguez, V.I., 2020, Human health risks from fish consumption following a catastrophic gas oil spill in the Chiquito River, Veracruz, Mexico, Environ. Monit. Assess., 192(12), 1-15.
-

- 2. Barker, J.P., Patrick, G.C., and Major, D., 1987, Natural attenuation of aromatic hydrocarbons in a shallow sand aquifer, Ground Water Monit. Remediat., 7(1), 64-71.
-

- 3. Chaudhary, D.K., Bajagain, R., Jeong, S.W., and Kim, J., 2021, Insights into the biodegradation of diesel oil and changes in bacterial communities in diesel-contaminated soil as a consequence of various soil amendments, Chemosphere, 285, 131416.
-

- 4. Edgar, R.C., 2010, Search and clustering orders of magnitude faster than BLAST, Bioinform., 26(19), 2460-2461.
-

- 5. Gray, N.D., Sherry, A., Grant, R.J., Rowan, A.K., Hubert, C.R.J., Callbeck, C.M., Aitken, C.M., Jones, D.M., Adams, J.J.,Larter, S.R., and Head, I.M., 2011, The quantitative significance of Syntrophaceae and syntrophic partnerships in methanogenic degradation of crude oil alkanes, Environ. Microbiol., 13(11), 2957-2975.
-

- 6. Gutierrez, T., Singleton, D.R., Berry, D., Yang, T., Aitken, M.D., and Teske, A., 2013, Hydrocarbon-degrading bacteria enriched by the deepwater horizon oil spill identified by cultivation and DNA-SIP, ISME J., 7(11), 2091-2104.
-

- 7. Han, J.S., Kim, C.S., and Han, G.S., 2008, Pollution control & remediation of contaminated groundwater. J. Korean Geo Environ. Soc., 9(3), 5-21.
- 8. James, E.K., Gyaneshwar, P., Mathan, N., Barraquio, W.L., Reddy, P.M., Iannetta, P.P., Olivres, F.L., and Ladha, J.K., 2002, Infection and colonization of rice seedlings by the plant growth-promoting bacterium Herbaspirillum seropedicae Z67, Mol. Plant Microbe Interact., 15(9), 894-906.
-

- 9. Ji, J.H., Zhou, L., Mbadinga, S.M., Irfan, M., Liu, Y.F., Pan, P., Qi, Z.Z., Chen, J., Liu, J.F., Yang, S.Z., Gu, J.D., and Mu, B.Z., 2020, Methanogenic biodegradation of C9 to C12 n-alkanes initiated by Smithella via fumarate addition mechanism. AMB Express, 10(1), 1-9.
-

- 10. Jiao, S., Liu, Z., Lin, Y., Yang, J., Chen, W., and Wei, G., 2016, Bacterial communities in oil contaminated soils: biogeography and co-occurrence patterns, Soil Biol. Biochem., 98, 64-73.
-

- 11. Kim, J.S., 2010, Findings of microbial community structure and dominant species in soils near army bases and gas stations, Environ. Eng., 32(3), 227-233.
- 12. Kim, J.Y. and Cho, K.S., 2006, Bioremediation of oil-contaminated soil using Rhizobacteria and plants, Microbiol. Biotechnol. Lett., 34(3), 185-195.
- 13. Lai, C.C., Huang, Y.C., Wei, Y.H., and Chang, J.S., 2009, Biosurfactant-enhanced removal of total petroleum hydrocarbons from contaminated soil, J. Hazard. Mater., 167(1-3), 609-614.
-

- 14. Lee, G.B. and Chang, Y.Y., 2019, Treatability study on the remediation groundwater contaminated by TPH Cr6+: lab-scale experiment, J. Environ. Impact Assess., 28(3), 332-345.
-

- 15. Lee, J. and Park, K., 2008, Microbial community in the TPH-contaminated aquifer for hot air sparging using terminal-restriction fragment length polymorphism, J. Environ. Impact Assess., 24(1), 19-29.
- 16. Li, D.C., Xu, W.F., Mu, Y., Yu, H.Q., Jiang, H., and Crittenden, J.C., 2018, Remediation of petroleum-contaminated soil and simultaneous recovery of oil by fast pyrolysis, Environ. Sci. Technol., 52(9), 5330-5338.
-

- 17. Li, Q., You, P., Hu, Q., Leng, B., Wang, J., Chen, J., Wan, S., Wang, B., Yuan, C., Zhou, R., and Ouyang, K., 2020a, Effects of co-contamination of heavy metals and total petroleum hydrocarbons on soil bacterial community and function network reconstitution, Ecotoxicol. Environ. Saf., 204, 111083.
-

- 18. Li, W., Zhang, Y., Mao, W., Wang, C., and Yin, S., 2020b., Functional potential differences between Firmicutes and Proteobacteria in response to manure amendment in a reclaimed soil, Can. J. Microbiol., 66(12), 689-697.
-

- 19. Lopez-Echartea, E., Strejcek, M., Mukherjee, S., Uhlik, O., and Yrjälä, K., 2020, Bacterial succession in oil-contaminated soil under phytoremediation with poplars, Chemosphere, 243, 125242.
-

- 20. NIER (National Institute of Environmental Research), 2017, Soil pollution process test standards (National Institute of Environmental Research Notice No. 2017-22, Aug. 11th, 2017 enacted).
- 21. Obuekwe, C.O., Al-Jadi, Z.K., and Al-Saleh, E.S., 2009, Hydrocarbon degradation in relation to cell-surface hydrophobicity among bacterial hydrocarbon degraders from petroleum-contaminated Kuwait desert environment, Int. Biodeterior. Biodegrad., 63(3), 273-279.
-

- 22. Park M.H., and Lee, M.H., 2012, TPH removal of the biodegradation process using 4 indigenous microorganisms for the diesel contaminated soil in a military camp, J. Soil Groundw. Environ., 17(3), 49-58.
-

- 23. Prenafeta-Boldú, F.X., Vervoort, J., Grotenhuis, J.T. C., and van Groenestijn, J.W., 2002, Substrate interactions during the biodegradation of benzene, toluene, ethylbenzene, and xylene (BTEX) hydrocarbons by the fungus Cladophialophora sp. strain T1, Appl. Environ. Microbiol., 68(6), 2660-2665.
-

- 24. Siles, J.A. and Margesin, R., 2018, Insights into microbial communities mediating the bioremediation of hydrocarbon-contaminated soil from an alpine former military site, Appl. Microbiol. Biotechnol., 102(10), 4409-4421.
-

- 25. Sutton, N.B., Maphosa, F., Morillo, J.A., Abu Al-Soud, W., Langenhoff, A.A., Grotenhuis, T., Rijnaarts, H.H., and Smidt, H., 2013, Impact of long-term diesel contamination on soil microbial community structure, Appl. Environ. Microbiol., 79(2), 619-630.
-

- 26. Toth, C.R. and Gieg, L.M., 2018, Time course-dependent methanogenic crude oil biodegradation: dynamics of fumarate addition metabolites, biodegradative genes, and microbial community composition, Front. Microbiol., 8, 2610.
-

- 27. Wang, S.Y., Kuo, Y.C., Hong, A., Chang, Y.M., and Kao, C.M., 2016, Bioremediation of diesel and lubricant oil-contaminated soils using enhanced landfarming system, Chemosphere, 164, 558-567.
-

- 28. Yergeau, E., Sanschagrin, S., Beaumier, D., and Greer, C.W., 2012, Metagenomic analysis of the bioremediation of diesel-contaminated Canadian high arctic soils, PloS One, 7(1), e30058.
-

- 29. Zheng, X., Ding, H., Xu, X., Liang, B., Liu, X., Zhao, D., and Sun, L., 2021, In situ phytoremediation of polycyclic aromatic hydrocarbon-contaminated agricultural greenhouse soil using celery, Environ. Technol., 42(21), 3329-3337.
-

 This Article
This Article
-
2022; 27(S1): 51-63
Published on Jul 31, 2022
- 10.7857/JSGE.2022.27.S.051
- Received on Jun 17, 2022
- Revised on Jun 22, 2022
- Accepted on Jul 18, 2022
 Services
Services
Shared
 Correspondence to
Correspondence to
- Hee Sun Moon
-
1Groundwater Environment Research Center, Climate Change Response Division, Korea Institute of Geoscience and Mineral Resources (KIGAM)
2Geological Science, University of Science and Technology (UST) - E-mail: hmoon@kigam.re.kr