- Review on the Remediation Method for Groundwater Contaminated with Cadmium
JongBeom Kwon1·Sunhwa Park1·Deok Hyun Kim1·JongHyun Yoon1·Hyeonhee Choi1·Moonsu Kim1·Young Kim2·Sun-Kyoung Shin1·Hyun-Koo Kim1*
1National Institute of Environmental Research, Incheon 22689, Korea
2Korea University, Sejong 30019, Korea- 지하수 중 카드뮴 저감 방안에 대한 고찰
권종범1·박선화1·김덕현1·윤종현1·최현희1·김문수1·김 영2·신선경1·김현구1*
1국립환경과학원
2고려대학교 환경시스템공학과This article is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Cadmium is a class 1 carcinogen classified by the International Agency for Research on Cancer (IARC) and has a high potential for leaching into groundwater. Therefore, it is necessary to address cadmium contamination by employing adequate treatment methodologies. Although various methods have been suggested to reduce cadmium in groundwater, their applications often suffer from various limitation arising from heterogeneous field conditions and technical difficulties. In this work, several in-situ technologies to treat cadmium contaminated groundwater were reviewed and discussed by separately addressing physicochemical, chemical and biological methods. In particular, the optimum cadmium remediation strategies that involve physical removal of source area → physicochemical and chemical remediation → biological remediation were proposed by considering reduction efficiency, adsorption rate, economic feasibility and ease of field application in groundwater.
Keywords: Heavy metal, Cadmium, Remediation technology, Reduction, Precipitation
중금속은 다양한 금속을 가공하는 제련소, 화학공업, 전기 및 전자 산업, 신소재 개발 산업 등 산업 활동과정에서 발생되는 폐수가 생태계에 지속적으로 노출되고 있지만, 자연적으로 분해되지 않고 먹이사슬을 통해 생물 농축이 유발되어 단기간 및 장기간에 걸쳐 독성을 유발할 가능성이 큰 물질이다(Mohammed et al., 2011). 이에 따라 고농도의 중금속이 지하수를 통해 자연으로 유입되는 경우를 방지하기 위해 현장에 최적화된 지하수 중 중금속 저감방법 통해 관리가 필요하다. 특히, 카드뮴은 국제암연구소(International agency for research on cancer; IARC)에서 지정된 1급 발암물질이며, 지하수 중 용출 가능성이 높아 지하수 중 카드뮴 오염에 대응하는 방법론 검토를 통한 중·장기적인 대안 마련이 필요하다. 카드뮴의 주요 유출원은 PVC 제품 안정제, 착색 안료, 제련 활동 등과 같이 산업활동에 의해 자연계에 고농도로 유출된다(Kubier et al., 2019). 하지만 인구밀도가 높은 도심이나 산간지방에서 지하수가 카드뮴으로 고농도 오염되었을 경우 부지활용과 교통 등의 문제에 의해 정화공법은 제한적일 수밖에 없어 기존 지하수 내 중금속 저감방법 검토를 통해 효율적인 카드뮴 저감 방법 검토가 필요하다.
지하수 내 중금속 저감을 위해서는 크게 물리·화학적, 화학적, 생물학적 원리를 활용한 다수의 기술이 존재하며, 기술들은 대표적으로 오염물질을 완전히 파괴 및 분해하는 방법, 정화처리장에서 오염된 지하수를 정화하는 방법, 오염물질을 이동성과 독성이 낮은 물질로 안정화하는 방법, 오염된 지하수에서 오염성이 없는 물질을 분리하여 재활용하는 방법, 외부 환경오염을 방지하기 위해 오염물질의 이동을 봉쇄하는 방법으로 총 5가지 방법으로 분류할 수 있다(Hashim et al., 2011). 저감공법으로는 화학적 방법을 활용한 환원, 화학적 Flushing, 화학적 고정법 등이 있으며, 물리·화학적 방법에서는 PRBs(Permeable reactive barriers), 흡착, 흡수, 필터 그리고 동전기법 등이 있고 마지막 생물학적 방법에서는 식생 이용공법, 생물학적 복원, 생물학적 흡착으로 구분할 수 있다(Hashim et al., 2011; Kubier et al., 2019; Mohammed et al., 2011).
중금속 저감방법 및 공법은 서로 구분하여 설명하고 있지만, 현장에 공법을 적용하는 경우 단일 원리만을 이용해 저감효과를 기대하지는 않으며 침전, 흡착, 흡수, 복합체 등 다양한 과학적 원리를 이용해 적용한다. 하지만 대규모 저감 공정은 부지 활용, 교통 등의 문제가 있을 경우 적용하기 어려워 지하수 중 카드뮴이 고농도로 오염되어 있을 경우 원위치 지하수 저감 방법이 적용 대안이 될 수 있다. 따라서 본 연구에서는 지하수 중 카드뮴 저감을 위한 물리적, 화학적 생물학적 방법을 검토하기 위해 문헌조사를 수행하였다. 이후 카드뮴 오염현장에서 적용 가능한 저감방법을 선정하기 위해 저감방법의 제거효율 및 흡착능력 등을 평가한 연구와 경제성을 평가하여 카드뮴 오염 지하수를 관리하기 위한 단계적 적용방안을 제시하였다.
2.1. 대표적 중금속 저감방법 및 공법
2.1.1. 화학적 저감방법
지하수 오염은 일반적으로 넓게 영역을 이루고 있거나, 지표면 아래로 깊게 퍼져있어 오염 이전의 상태로 정화하기에는 어려운 특징이 있다. 이러할 경우 화학적 저감기술을 활용하는 것이 가장 좋은 선택이며, 화학적 저감방법은 주로 오염도와 이동성을 낮춰 비활동적인 상태로 만들 때 활용된다(Hashim et al., 2011). 중금속을 제거하기 위한 다양한 저감기술들은 중금속이 자연으로 유입되기 이전부터 발전되어 왔고(Clifford et al., 1986; Rao et al., 2010), 기작은 산화‧환원과 중성화 반응이며 이 중 환원반응을 이용하는 것이 일반적이다.
대수층을 환원상태로 만들기 위해서는 액체 환원제, 기체 반응물질 또는 콜로이드형 환원제 주입방법을 활용할 수 있으며 디티오나이트, H2S 가스 그리고 철을 활용하는 방법을 예로 들 수 있다(Hashim et al., 2011). 디티오나이트의 경우 실험실 및 현장실험을 수행한 결과 약 일 년 동안 반응 영역에 저감 조건을 유지하는 것으로 연구되었다(Amonette et al., 1994; Fruchter et al., 1997; Hashim et al., 2011). 디티오나이트는 다양한 반응을 통해 설포옥실 라디칼(SO2-•), 티오황산염(S2O32-), 아황산수소(HSO3-)를 생성하며(Saikhao et al., 2017; Sedlazeck et al., 2020) Cr(VI)를 Cr(III)로 저감시키는 반응을 유도한다(Kaprara et al., 2018; Sedlazeck et al., 2020). 알칼리조건 및 투수율이 높은 토양에서 활용할 수 있으며, 넓은 지역에 활용할 수 있고 유지력이 좋은 장점이 있다. 하지만 중간물질로 유독가스가 발생하는 단점이 있다.
Thornton and Jackson(1994)은 크롬산염으로 오염된 토양을 현장에서 부동화하는 실험을 수행하기 위해 황화수소 가스를 주입하였다. 황화수소 가스는 Cr(VI)를 Cr(III)로 저감시키고 수산화물 형태의 고체상으로 침전시키는 역할을 하며(Eq. 1), 생성된 황산염들과 수산화물 형태의 Cr(III)는 용해도가 낮아 지하수 내 2차 오염을 방지할 수 있다. 하지만 중간물질로 유독가스가 발생하며 대수층에 직접 주입하기에 어려움이 있다.
8CrO42- + 3H2S + 4H2O → 8Cr(OH)3 + 3SO42- (1)
오염된 지하수와 토양의 정화를 위해 철을 활용한 저감기술은 실험실 규모와 현장 규모에서 오랫동안 입증되어왔다. ZVI의 경우 강력한 환원제로 활용되며 대부분의 이동성 산화음이온을 산화양이온으로 환원시켜 이동성을 낮 출수 있다(Tandon and Singh, 2016). Fe와 ZVI를 활용하여 대수층 내의 중금속을 흡착하거나 환원 침전하는 방법은 As와 반응하면 중간 산물로 dihydrogen arsenate (H2AsO4-)라는 유해물질이 발생하는 단점이 있으며(Joo et al., 2004), 철염을 활용할 경우 Cr(VI)를 Cr(OH)3, FexCr1-x (OH)3로 환원 침전시켜 이동성을 줄일 수 있다(Puls et al., 1999). 하지만 Cr(III)는 산화될 때 유독성을 띠며, Cr(VI)는 알칼리조건에서 이동성을 띌 수 있는 단점도 존재한다(Bewley, 2007). 화학적 고정화의 경우 농업토양을 대상으로 실험한 사례가 있으며 다양한 안정화제와 적토(red mud)를 혼합하여 중금속 산화시키면서 안정화제 및 red mud와 구조적으로 결합하여 안정화하는 방법을 활용하였다(Lombi et al., 2002; Yang et al., 2007). 이 밖에도 화학적 세척 방법을 적용한 토양 세척, 킬레이트 세척, 이온교환과 같은 화학적 저감 방법이 있으며, 중금속을 산화시키고 구조적으로 가둠으로써 안정화시키는 고정화 방법이 있다.
2.1.2. 물리·화학적 저감법
물리적 저감방법은 대부분의 경우 단일 공정으로 활용하지는 않으며 화학적 저감방법을 함께 활용하여 중금속 저감에 활용된다. 그리고 물리·화학적 저감방법은 물리적인 방법 또는 벽 구조물, 물리적 흡수 또는 흡착, 화학적 과정 등 다양한 방법을 활용한다.
투수성반응벽(Permeable reaction barrier; PRB)을 활용한 방법은 크게 흡착제 활용, 침전법, 생물학적투수벽 형태로 적용되며 흡착제는 적토(Red mud), 활성탄, 제올라이트, 철 흡착제(Zero-Valent Iron; ZVI, 황철광 등) 등이 활용될 수 있다. 적토의 경우 보크사이트로부터 알루미늄을 뽑아내는 과정에서 발생하는 물질이며 자연계에서는 약 pH 8~10.5 정도의 알칼리 물질이다(Obiri-Nyarko et al., 2014). 그리고 켄크리나이트가 구조적으로 음전하를 띄어 양이온 흡착에 유리하다(Li et al., 2022; Mucsi et al., 2021). 또한, 가격이 저렴하고 중금속 흡착능이 좋으며 탈착이 잘 이루어지지 않아 효율적으로 부동화시킬 수 있는 장점이 있다. Lapointe et al.(2006)에 따르면 Fe, Cu, Zn, Ni, Pb 제거율 99% 가능하다는 연구 결과가 있으며 그 이외에도 Pb, As, Cd, Zn의 흡착도 가능한 것으로 보고되었다(Hashim et al., 2011; Lapointe et al., 2006; Wang and Liu, 2021). 하지만 pH에 의존적인 것이 사실이며 이온반지름이 작은 양이온들도 흡착하는 단점이 있다(Hanumantha Rao and Gangadhara Reddy, 2017; Hashim et al., 2011; Lockwood et al., 2014; Rubinos and Spagnoli, 2019).
활성탄 중 GAC(Granular activated carbon)가 PRBs 형태로 가장 많이 활용되며 PABs(Permeable adsorptive barriers)로도 불려지고 있다(Erto et al., 2011; Falciglia et al., 2020; Ghaeminia and Mokhtarani, 2018). 매우 넓은 표면적(약 1000 m2/g)과 AC 내에 잘 발달한 공극은 적은 비용으로 다양한 오염물질들을 효율적으로 제거한다(Falciglia et al., 2020; Hashim et al., 2011; Marsh and Reinoso, 2006; Mohan and Pittman Jr, 2006; Montaña et al., 2013). 활성탄은 Cr, Cd, As, Pb, Zn 등 다양한 중금속 제거 흡착제로 활용되고 있으나(Egirani et al., 2020; Hashim et al., 2011; Huggins et al., 2016) As 제거에 관해서는 아직 연구된 자료가 적고 만족스러운 연구 결과들이 부족하다(Caccin et al., 2013; Falciglia et al., 2020; Li et al., 2014; Liu et al., 2014; Vanderheyden et al., 2016).
제올라이트는 3-D 형태의 다공성 알루미노실리케이트(알칼리 혹은 알칼리성 물질) 골조를 가지며 가격이 저렴한 친수성 물질로써 높은 이온교환 능력과 선택적 흡착이 가능하다. 그리고 화학적 및 기계적 안정성과 pH에 독립적인 특성을 가진다(Burakov et al., 2018; Hong et al., 2019; Ibrahimi and Sayyadi, 2015; Moraci and Calabrò, 2010; Taamneh and Sharadqah, 2017; Tasharrofi et al., 2020; Weber et al., 2013; Zhou et al., 2014). 제거 가능한 중금속으로는 Cd, Cu, Ni, Cr, As, Zn, Mn, Co 등이 있으나 경험적으로 알고 있는 Pb2+ > Cu2+ > Ni2+순의 선택적 흡착 경향은 아직 완벽히 해석되지 않았다(Hashim et al., 2011; Hong et al., 2019; Taamneh and Sharadqah, 2017). 이외에도 앞서 언급한 철 흡착제(ZVI, 황철광, S-ZVI), 복합 알칼리 시약, 부식성 산화마그네슘, 분말 슬래그, 바이오차, 키토산 등 다양한 흡착제를 활용한 PRBs 형태가 존재한다(Hashim et al., 2011; Obiri-Nyarko et al., 2014; Song et al., 2021).
2.1.3. 생물학적 저감법
생물학적 저감방법은 생물화학적, 생물학적 흡착 공정을 포함하고 있으며, 자연적으로 발생하는 생물학적 기작을 활용하는 방법이며, 저감공법의 예로는 현장 생물학적 침전공법, 탈황 미생물을 활용한 중금속 환원 공법, 식물체를 활용한 중금속 침전, 산화, 생물 농축 방법 등이 있다(Ali Redha, 2020; Bashir et al., 2019; Hashim et al., 2011).
생물학적 침전공법은 ISBP(In-situ bioprecipitation)로 불리며 지하수 내에 중금속을 고체 형태로 침전시키는 방법으로 부동화시키는 것을 의미하며 대부분의 경우 황화물을 활용한 방법이 주를 이룬다(Hashim et al., 2011). 황산염은 자연수에 풍부하게 존재하는 음이온이며 황산염 저감현상은 지하수 시스템에서 광범위하게 일어나는 자연스러운 반응이다(Hem, 1985; Miao et al., 2012). 황산염의 환원반응은 ORP를 기준으로 Fe 환원 및 메탄 생성 반응조건 사이에 이루어지며 이러한 황산염의 자연저감은 지하수 시스템에서 두 번째로 흔히 볼 수 있는 현상이다(Miao et al., 2012). 황산염 저감 반응에 관여하는 SRB(Sulfate-reducing bacteria)을 활용하는 저감방법은 BSR(Biological sulfate reduction)로 불리며, 전자공여체인 탄소원(당밀, 락테이트, 아세테이트 등)을 관정에 직접 주입하는 방법과 PRBs내에서 지하수 방향 반대 방향으로 탄소원을 주입하여 SRB의 증식을 돕는 방식으로 활용된다(Amos and Younger, 2003; Angelov and Georgiev, 1998; Benner et al., 1999; Canty, 2000; Kiran et al., 2017; Kovar and Herbert, 1998; Waybrant et al., 1998). Canty(2000)의 연구에 의하면 수직 갱도에 흐르는 광산 폐수를 유기물질과 접촉되면서 흐르도록 만들 경우 폐수 내 pH가 상승하면서 용존되어 있는 Al, Cd, Zn를 효과적으로 제거하는 것을 확인하였고, Al, Cd, Zn 이외에도 2가 형태의 중금속(Cu, Zn, Ni, Co, Fe, Cr, As) 제거에 효과가 있는 것으로 보고됐다(Canty, 2000; Geets et al., 2003; Hashim et al., 2011). ISBP, BSR이외에도 대수층에 적용할 수 없는 식물체를 활용한 중금속 제거방법과 생물학적 흡착 방법(생물학적 계면활성제, 유기물 내 흡수, 셀룰로오즈 소재 및 농업 쓰레기 활용)이 있다(Hashim et al., 2011).
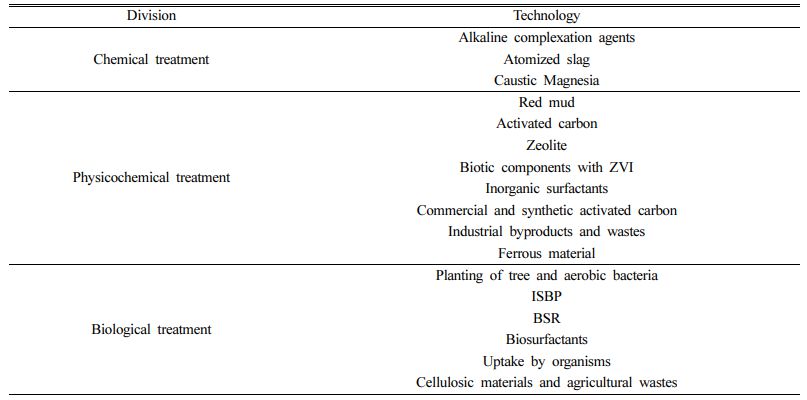
정리된 화학적, 물리·화학적, 생물학적 중금속 처리공법 중 Cd 저감이 확인되고 원위치 정화공법으로 활용가능한 방법은 pH를 직접적으로 조절하는 알칼리 시약, 산화제, 흡착제, 환원조건 조성을 통한 생물학적 침전, 개질된 분자구조를 통한 생물학적 흡착으로 요약할 수 있다(Table 1).
3.1. 지하수 내 카드뮴 저감을 위한 현장적용 방법
카드뮴으로 지속적으로 오염되고 있는 지하수의 경우 물리적 및 화학적 흡착제, pH 조절용 시약, 현장 대수층 조건에 따른 생물학적 저감방법을 고려하는 것이 합리적이며, 국내에서 대량으로 쉽게 구입할 수 있고 개질을 쉽게 할 수 있는 소재를 활용하는 것이 경제적이다. 그리고 지하수가 카드뮴으로 고농도 오염되었지만 부지 활용 등에 대한 문제점을 해결하기 어려운 지역일 경우 적용이 가능한 정화공법은 제한적일 수밖에 없다. 따라서 관정 내에 직접 설치가 가능하며, 교체가 자유로운 흡착제 및 중화용 시약을 활용하는 방법과 오염부지 내 지배적인 음이온의 종류와 양에 따른 생물학적 저감공법 등이 현장적용 가능한 원위치 저감방법 후보군으로 볼 수 있다.
물리·화학적 및 화학적 원리를 응용한 중금속 저감방법 중 활성탄은 폐수처리의 카드뮴 제거에 많이 활용되고 있으며, 대체재로는 바이오 차가 있다(Hashim et al., 2011; Mariana et al., 2021). 이외에도 저렴하고 구입하기 쉬운 흡착제로 키토산, 제올라이트가 있다. 활성탄은 형태에 따라 분말형(Powder activated carbon; PAC), 과립형(Granular activated carbon; GAC), 섬유형(Activated carbon fiber; ACF), 옷형(Activated carbon cloth; ACC) 총 4가지로 구분되어 있으며, 이 중에서도 섬유형의 경우 활성탄 표면 내 Micropore 내로 중금속 이온이 접근하기 좋은 평평한 구조로 되어 있어 음전하와 중금속의 양전하 간의 이온교환을 통한 흡착이 용이하다(Hashim et al., 2011; Mandal et al., 2019; Wang and Wu, 2006).
키토산 및 키틴질은 셀룰로오즈 다음 2번째로 가장 풍부한 천연 고분자 물질(Shahidi et al., 1999) 로 가격이 저렴하고 활용하기 쉬운 물질이다. 그리고 유사한 분자구조를 가진 키토산 또한 효율 좋은 흡착제로 많은 연구가 진행 중에 있으며, 또한 바이오차와 같은 식생 및 동물 소재를 활용한 흡착제도 높은 흡착효율을 보이는 것으로 보고되었다(Inyang et al., 2016).
제올라이트는 자연상 존재하는 광물에서 얻을 수 있고 적은 금액으로 경제적이며 알칼리물질로 pH 조절 능력을 가지고 있어 pH가 낮은 중금속 오염현장에서 좋은 효율을 보여준다(Mochida et al., 2000; Motsi, 2010).
ZVI는 높은 효율에 비해 저렴한 가격으로 수십 년간 연구됐고, 폐수처리를 위해 상업적으로 활용되고 있다. 또한 PRBs 개념의 공법적용 시 ZVI를 활용하여 중금속 제거를 위해 많이 연구되어왔으며, 제올라이트, 활성탄소와 라임과 같은 pH 조절 시약 또한 활용됐다(Jun et al., 2009). ZVI 중 나노 직경을 가진 nZVI(Nanoscale zero-valent iron)는 가장 광범위하게 활용되고 있으며, 생산에 필요한 비용적 효율성뿐만 아니라 입자가 나노 크기로 작아 입자 크기가 비교적 큰 ZVI보다 오염물질 제거에 있어 좋은 효과를 기대할 수 있다(Stefaniuk, M. et al., 2016). nZVI 표면을 황으로 개질한 S-nZVI의 경우 넓은 비표면석. 생산 용이성, 다양한 오염물질(카드뮴, 크롬산 염 등)과 기존 nZVI보다 높은 반응성을 보이는 것으로 연구되어 있으며 오염물질을 선택적으로 저감하는 것이 가능하여 많은 관심을 받고 있다(Su et al., 2015; Su et al., 2019).
생물학적 처리공법에 활용할 수 있는 방법은 지하수 내 고농도의 카드뮴을 저감한 이후 낮은 농도를 관리하는 데 필요하며 ISBP, BRS을 고려할 수 있다. 그리고 현장의 조건에 따라 공법 적용방식을 판단해야 한다. 일예로 주변 관정 모니터링 결과 지하수 내 SO42- 농도가 고농도 검출될 경우, BRS를 이용한 생물학적 저감공법을 적용하는 것이 바람직하다. 이외에도 식물체를 활용하는 방법과 생물학적 계면활성제 및 유기물 내 흡수 방법 또한 존재하지만(Hashim et al., 2011), 식물체를 활용하는 방법은 대수층 대상이 아니며 이외의 방법은 실험실 규모 단계에 머물러 있어 제외하였다. 마지막으로 위에 언급한 물리·화학적, 화학적, 생물학적 지하수 내 카드뮴 저감을 위한 현장적용 후보군을 다음 Table 2와 같이 정리하였다.
3.2. 흡착공법 및 침전법 적용을 위한 흡착제 종류 및 효율, 경제성 검토
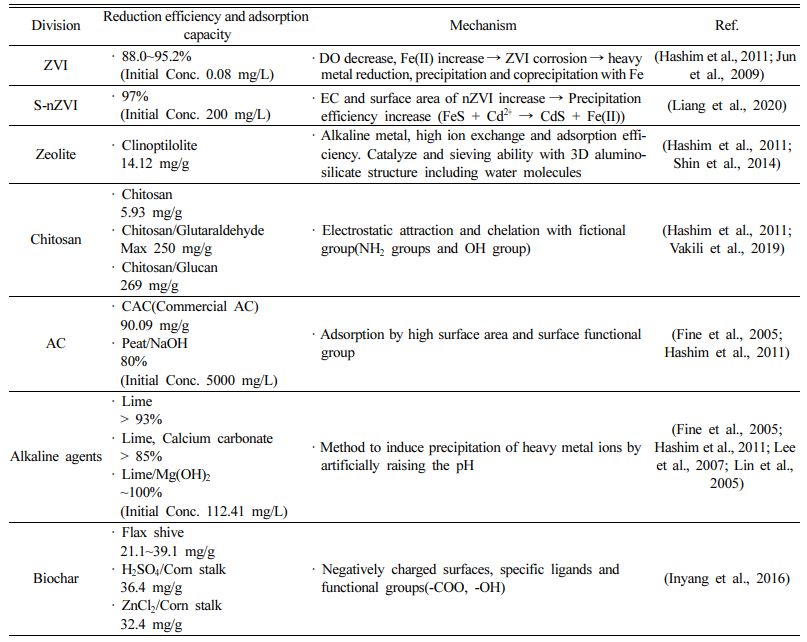
현장 저감 적용이 용이한 흡착제(nZVI, S-nZVI, 제올라이트, 키토산, 활성탄, Biochar)와 알칼리 시약 그리고 SRB에 대한 효율을 정리하였으며, 구매가 가능한 대중적인 흡착제의 경우 가격을 함께 정리하였다. 각각의 흡착제 및 알칼리 시약을 이용한 제거효율 및 흡착능력과 주요 기작은 Table 3과 같다.
3.2.1. ZVI
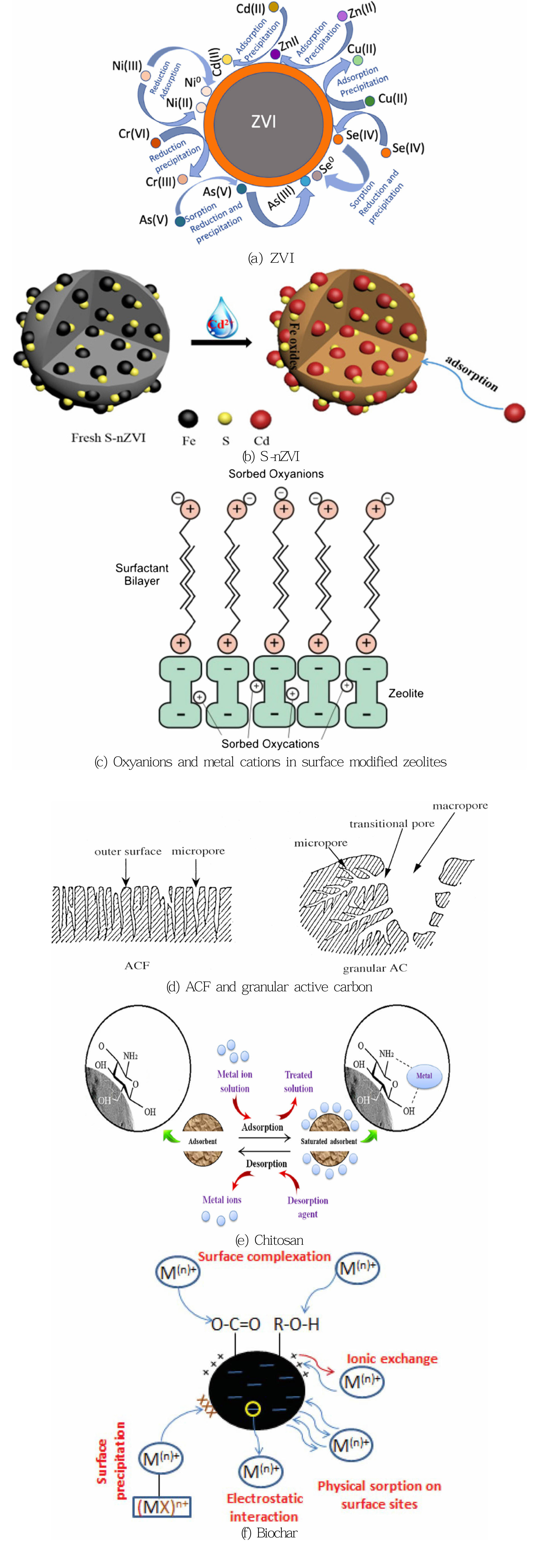
ZVI는 US $ 1.1~1.4/kg로 비교적 저렴한 것으로 알려져 있으며, 중금속, 유기물질, 무기물질로 오염된 지하수를 정화하기 위해 많은 연구가 진행되어왔다. 그리고 카드뮴 이외에도 다양한 오염물질에 대해 좋은 저감 효율을 가지고 있는 것으로 알려져 있다. 주요기작으로는 지하수 내에서 ZVI가 산화에 의한 붕괴가 일어나면서 주변 중금속들을 환원시켜 흡착, 침전을 유도하는 원리이다(Ullah et al., 2020) (Fig. 1 (a)).
ZVI는 다양한 중금속으로 오염된 상태에서 전체적인 저감에 유리하지만, 선택적으로 중금속을 제거하지는 못하는 것으로 알려져 있다. 일 예로 실험실에서 같은 조건의 2개 반응조를 이용해 Zn, Mn, Ca, Mg, Cd, Sr, Al의 제거효율을 평가한 결과 46.7~99.6%의 효율을 보였으며, 카드뮴의 경우 2개의 반응조 각각 88.0, 95.9% 의 제거효율을 보여 높은 저감 효율을 보였다(Jun et al., 2009).
3.2.2. S-nZVI
S-nZVI는 Fe(0) 표면의 전자 전달을 가속화하며, 외부 물질에 대한 전정기적인력을 증가시키는 것으로 알려져 있으며 nZVI보다 높은 반응성을 가지는 것이 특징이다. 금속 이온 제거의 경우 기존 nZIV보다 높은 중금속 저감 효율을 보이며 표면에 부착된 황화물은 제거된 금속이온의 안정성도 향상시키는 것으로 알려져있다. 또한 불균질하게 nZVI 표면에 부착된 황화물들은 Fenton 반응과 유사한 화학적 반응을 보이며 용존 산소가 없는 상태에서 nZVI보다 많은 OH• 생성에 유리하다(Su et al., 2019). 제조 방법으로는 염화제이철(FeCl3)을 녹인 Fe3+ 수용액을 제조한 후 수소화붕소나트륨(NaBH4)과 환원제인 디티온산나트륨(Na2S2O4)을 첨가한 NaBH4-Na2S2O4 수용액을 혼합하여 표면에 황화철 침전물이 코팅된 S-nZVI를 제조한다. 이후 S-nZVI에 초음파를 가한 후, 질소 퍼징한 증류수로 세척하여 표면의 불순물을 제거하여 순도를 높이는 작업이 필요하다(Liang et al., 2020). 지하수 내에서의 Cd2+의 제거기작은 FeS의 Fe가 Cd로 교체되면서 제거된다(Ullah et al., 2020)(Fig. 1 (b))(Eq. 2).
FeS + Cd2+ → CdS + Fe(II) (2)
S-nZVI를 가공하여 판매하는 곳은 찾기 어려워 현장 적용이 필요할 시 다량의 nZVI를 개질해야 하지만 Liang el al.(2020)의 실험에 따르면 Cd의 초기농도가 81.8 mg/L인 반응조에서 nZVI는 1시간 동안 10%를 제거했지만 S-nZVI는 30분 동안 97%를 제거하여 반응성이 좋으며 흡착능력 또한 우수한 것으로 연구되어 충분히 고려 가능한 흡착제이다.
3.2.3. 제올라이트
제올라이트는 알칼리 금속으로 이온교환 능력과 흡착능력이 우수한 것으로 알려져 있으며(Hashim et al., 2011), 양이온을 교화시켜 흡착 및 촉매작용을 증가시키는 방향으로 많이 활용되고 있다(Shin et al., 2014). 촉매작용의 원인으로는 제올라이트 내 물 분자를 포함하고 있은 3D Aluminosilicate 구조에 의해 발생되는 것으로 알려져 있으며 이러한 구조가 분자를 걸러주는 능력을 가지고 있는 것으로 알려져 있다(Hashim et al., 2011)(Fig. 1 (c)). 최근에는 제올라이트를 이용한 이온교환수지를 이용하여 공장에서 배출되는 중금속 폐수 내 중금속을 95~98%까지 회수하여 폐수를 리사이클하는 처리방법을 사용하기도 한다(Shin et al., 2014). 중금속 제거능력은 Pb2+ > Cd2+ > Co2+ > Cr2+ > Zn2+ > Ni2+ > Hg2+ 순으로 높으며 반응조에서 제올라이트의 Pb, Cd, Cu 흡착 정도를 실험한 결과 각각 15.13, 14.12, 12.64 mg/g 정도의 흡착능력을 보이는 것으로 확인됐다(Shin et al., 2014). 그리고 NJ 제올라이트를 활용하여 pH 3, 초기농도 30 mg/L 조건에서 5시간 내에 약 96%의 Cd을 제거했으며 흡착능력은 0.24 mg Cd/g로 평가되었다(Baker et al., 2009; Taamneh and Sharadqah, 2017). 이외에도 NaOH 처리한 클리놉틸로라이트 및 차바이트는 100100 mg Cd/g 이상의 흡착능력을 가진 것으로 알려져 있으며, Crosfields Ltd.,UK에서 개질한 Zeolite -4A, -P, -Y의 경우 각각 100 mg/g, 50 mg/g, 20 mg/g의 카드뮴 흡착능력을 가지고 있는 것으로 보고되었다(Singh et al., 2000). 마지막으로 제올라이트의 가격은 $2.0/kg 이하로 일반 GAC보다 저렴한 가격으로 시장이 형성되어 있다.
3.2.4. 활성탄
활성탄는 $ 20.0~22.0/kg 정도의 가격이 형성되어 있으며, 넓은 표면적과 표면에 hydroxyl, carbonyl, lactone, carboxylic acid와 같은 기능성 작용기들이 있어 흡착능력이 좋고(Hashim et al., 2011), 가격 또한 저렴하여 다방면으로 활용되고 있다. GAC는 물질이 macropore를 지나 micropore로 이동하기 위한 힘이 필요하나 ACF의 경우 macropore 부분이 없어 바로 micropore로 물질이 이동하여 이동에 필요한 에너지 사용이 감소되고(Fig. 1 (d)), 일반 CAC(실린더형)이 GAC보다 더 넓은 가용면적을 가지고 있어 흡착속도와 탈착 속도가 빠른 장점이 있다(Mochida et al., 2000; Zaini et al., 2010). 땅콩껍질로 제조한 활성탄(Prepared activated carbon; PAC)과 상업용 활성탄(Commercial activated carbon; CAC) 그리고 각각을 황으로 개질한 활성탄(Sulfurized PAC; SPAC, Sulfurized CAC; SCAC) 총 4가지 활성탄에 대해서 Cd2+ 흡착능력을 비교한 결과 황 개질 활성탄의 흡착능력이 약 40% 증가한 것을 확인하였고(Tajar et al., 2009). 물이끼를 활용한 상업용 활성탄인 SPM(Sphagnum peat moss)을 1N NaOH 용액에 노출한 활성탄은 SPM의 약산성 부분이 해리되어 H+을 이온교환이 용이한 Na+로 바꾸어 흡착능력을 높일 수 있으며, 전처리 방법에 따른 Cd 제거 능력을 비교해본 결과 NaOH로 활성화된 SPM이 초기농도가 5,000 mg/L인 Cd을 80% 흡착(1:25 peat to water ratio)하는 것을 확인했다(Fine et al., 2005).
3.2.5. 키토산
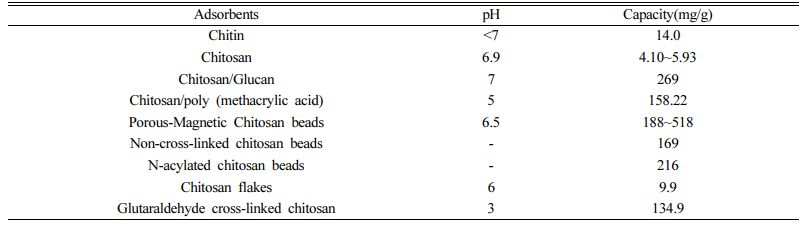
키토산은 매우 흔한 자연 중합체로 낮은 가격, 항균성, 비독성, 생물학적으로 거부반응이 없어 생물학적저감이 가능하며, macro 정도의 공극 구조와 친수성을 가지고 있는 등 장점이 되는 많은 특징을 가지고 있다. 하지만 오염물질로 포화된 키토산의 경우 독성이 있어 생물학적 저감이 힘들고 흡착된 오염물질이 환경으로 다시 방출될 가능성 가지고 있다(Vakili et al., 2019). 키토산의 흡착능력은 주로 표면의 NH2 그룹이 중금속 흡착을 일으키는 주요 반응기며 OH 그룹도 흡착에 기여하는 반응기다(Fig. 1 (e)). 이 밖의 기작은 전정기적인력과 킬레이드화이며 pH에 영향을 많이 받는다(Vakili et al., 2019). 일반적으로 키토산은 입자의 크기에 따라 다를 수 있지만 5.93 mg/g 정도의 흡착능력을 지니고 있으며 개질하여 활용할 경우 100 mg/g 이상의 흡착능력을 가진다. 자세한 사항은 아래 Table 4에 정리하였다. 마지막으로 키토산은 상용화된 활성탄(PAC, $ 20.0~22.0/kg)과 가격이 유사하며 약 $ 15.43/kg 정도로 가격이 형성되어 있다.
3.2.6. 바이오차(Biochar)
바이오차는 탄소가 많은 바이오매스를 열분해하여 만들어진 검은색 탄소이며, 가격은 다른 흡착제와 같이 종류에 따라 다르지만 $ 2.58/kg 정도로 저렴하다. 최근에는 토양의 비옥도를 증진하고 바이오에너지 생산에 사용되며 환경 개선 분야에도 사용되는 등 다방면으로 활용할 수 있어 많은 관심을 받고 있다(Inyang et al., 2016). 바이오차도 여타 흡착제와 같이 단일 기작이 아니라 침전, 복합체 형성, 이온교환, 정전기적 인력, 물리적 흡착과 같이 복합 기작을 통해 중금속을 제거한다(Fig. 1 (f)).
중금속을 흡착하는 세부적인 원리 중 물리적 흡착은 바이오차도 불규칙한 표면 때문에 발생하며(Kasozi et al., 2010), 추가로 대부분의 바이오차가 micropore, mesopore, macropore의 분포가 다채롭게 형성되어 있어 넓은 표면적을 가지고 있다고 확인됐다(Mukherjee et al., 2011). 그리고 표면은 음전하를 띄고 있어 전정기적 인력을 통해 흡착도 가능하며, 표면 리간드와 기능성 그룹이 있어 중금속과 복합체를 이루는 것에도 용이하다(Dong et al., 2011; Wang et al., 2015).
바이오차 또한 다른 흡착제들과 함께 종류가 다양하며 Flax shive를 이용한 바이오차의 카드뮴 흡착 능력은 21.1~39.1 mg/g, Corn stalk를 H2SO4, ZnCl2로 처리할 경우 각각 36.4, 32.4 mg/g 정도 흡착하는 것으로 확인됐다(Inyang et al., 2016). pH에 흡착능력이 여타 흡착제와 같이 민감하며, SA6(Pig manure)를 카드뮴 수용액 내에 혼합하고 pH 변화에 따른 흡착정도를 평가한 결과 pH 5에서 최대 흡착능(16.60 mg/g)을 보였다(Wang et al., 2015).
3.2.7. 알칼리 시약
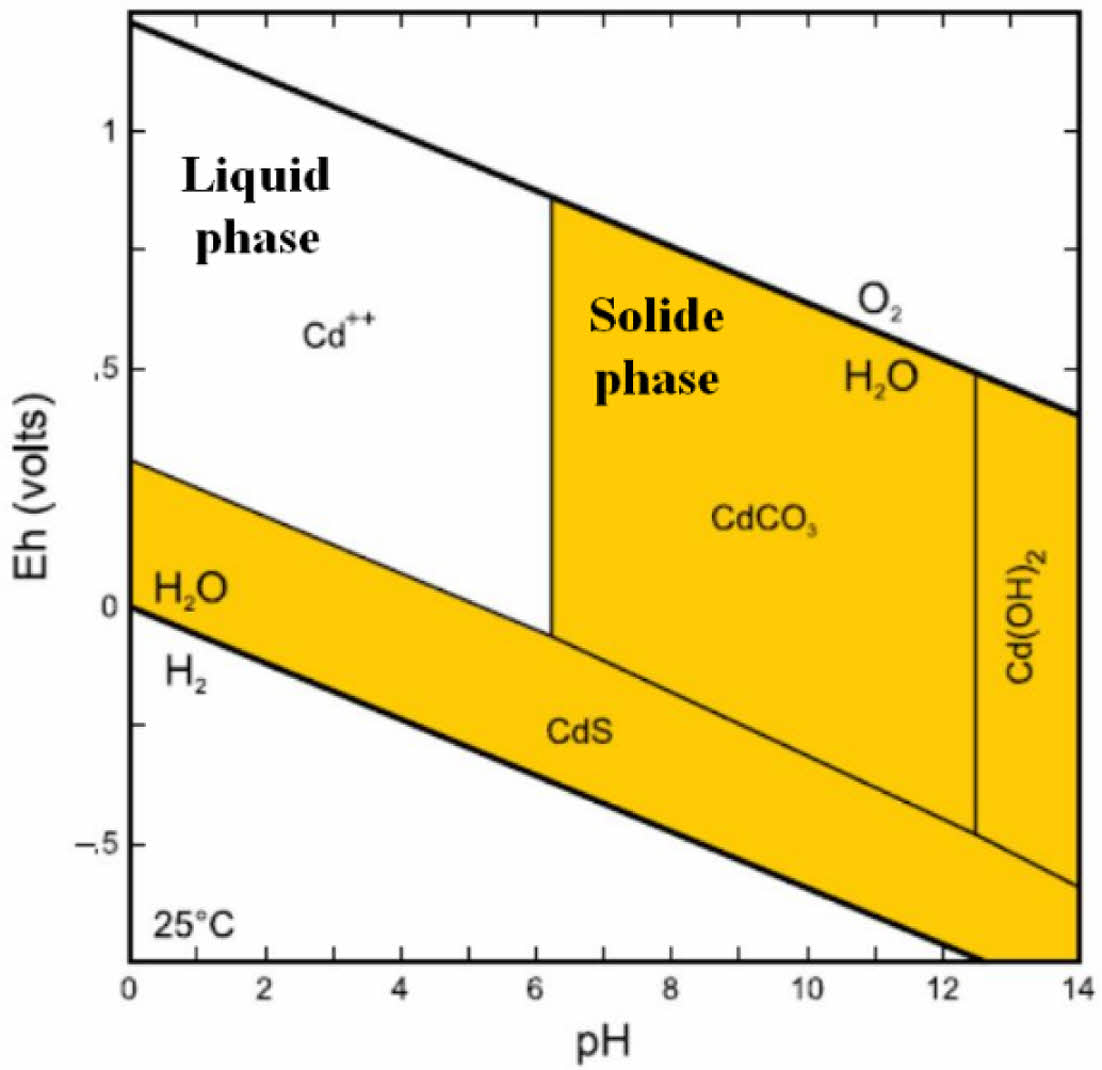
알칼리 시약을 사용할 경우 중금속 침전 공정이 간단하고 Lime, Quick Lime 등 다양한 상품이 저렴하게 구성되어 있어 중금속 저감시 가장 일반적으로 고려되는 저감 방법이다(Rao et al., 2010). 알칼리 시약을 지하수 내 중금속 저감에 사용할 경우 수화학에 따라 형상이 결정되며 일 예로 Lime을 사용하여 pH는 12까지 상승 시키면 중금속 수화물이 형성되어 중금속의 용해도가 감소하는 것을 알 수 있다(Hashim et al., 2011)(Fig. 2). Lime, Lime-stone, CaCO3, 수산화물을 이용한 중금속 침전 방법은 지하수를 양이온 및 음이온 오염 없이 저감 가능한 방법이다. Lime과 Lime + CaCO3를 이용한 Cd(초기농도 4 mg/L) 제거 컬럼 실험을 진행한 결과 각각 93%, 85% 이상 제거되었으며 주입용액을 컬럼의 공극부피의 180배 주입을 진행한 시점에서도 두 가지 시약 모두 약 80% 이상 효율을 보였다(Lee et al., 2007).
3.2.8. Sulfate reduction
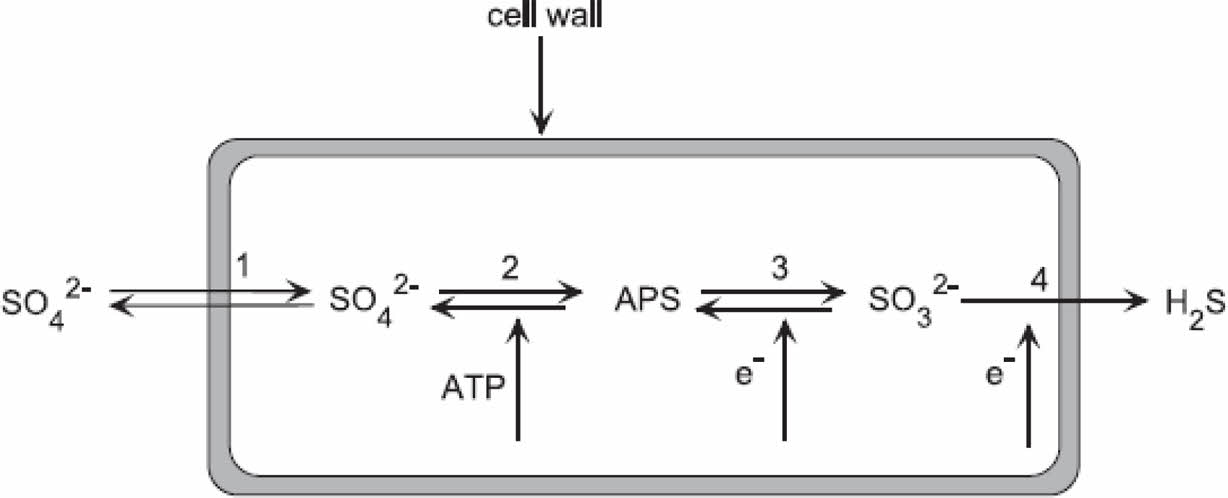
황산염 환원 반쪽 반응식은 자연 pH에서 수소이온을 활용하여 HS-로 환원시키는 반응이며 황산염 환원 미생물은 일반적으로 유기물 산화를 통해 에너지를 얻어 최종산물로 H2S가 생성된다. 그리고 수소 분자 또한 황산염의 환원작용에서 전자공여체로 이용된다. 따라서 수소이온이 소비되고 중탄산염이 생성되어 pH가 상승하는 효과를 볼 수 있다(Miao et al., 2012; Shen and Buick, 2004) (Fig. 3)(Eq. 3, 4, 5).
SO42- + 9H+ + 8e- → HS- + 4H2O (3)
SO42- + CH2O → H2S + HCO3- (4)
SO42- + H2 → H2S + H2O (5)
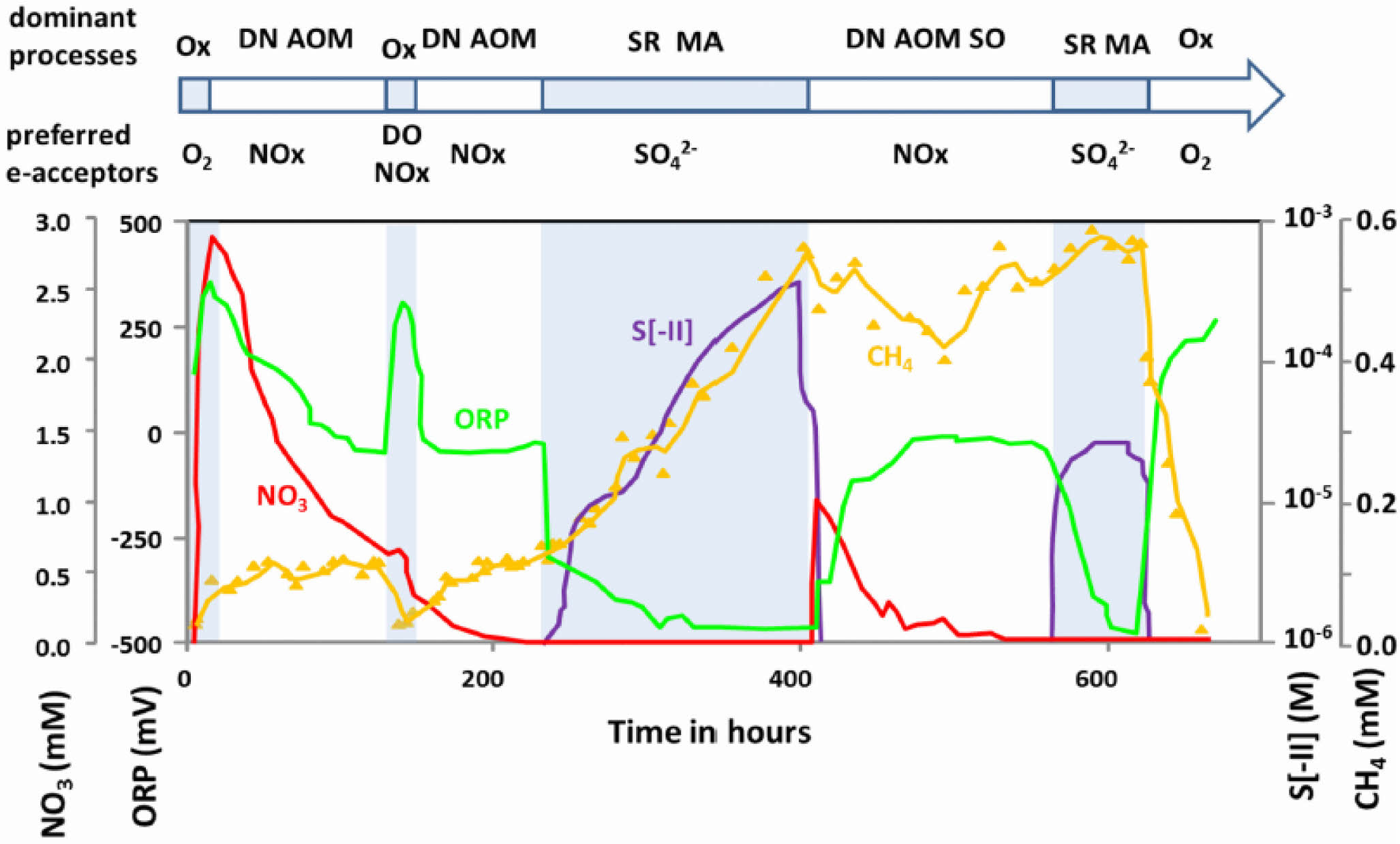
황산염 저감 미생물의 ORP 조건은 -40 ~ -500 mV 범위에서 급격히 증가하는 것으로 연구되었으며(Fig. 4) 앞서 말했던 것과 같이 황산염 환원에 따라 중탄산염이 발생하면서 pH가 조절되어 SRB의 성장을 최적화시키고 최종산물로 생성된 H2S는 금속 이온과 반응하여 용해도가 낮은 중금속 황화물을 형성하게 된다(Frindte et al., 2015; Ludwig et al., 2002)(Eq. 6).
Me2+ + H2S → MeS↓+2H+ (6)
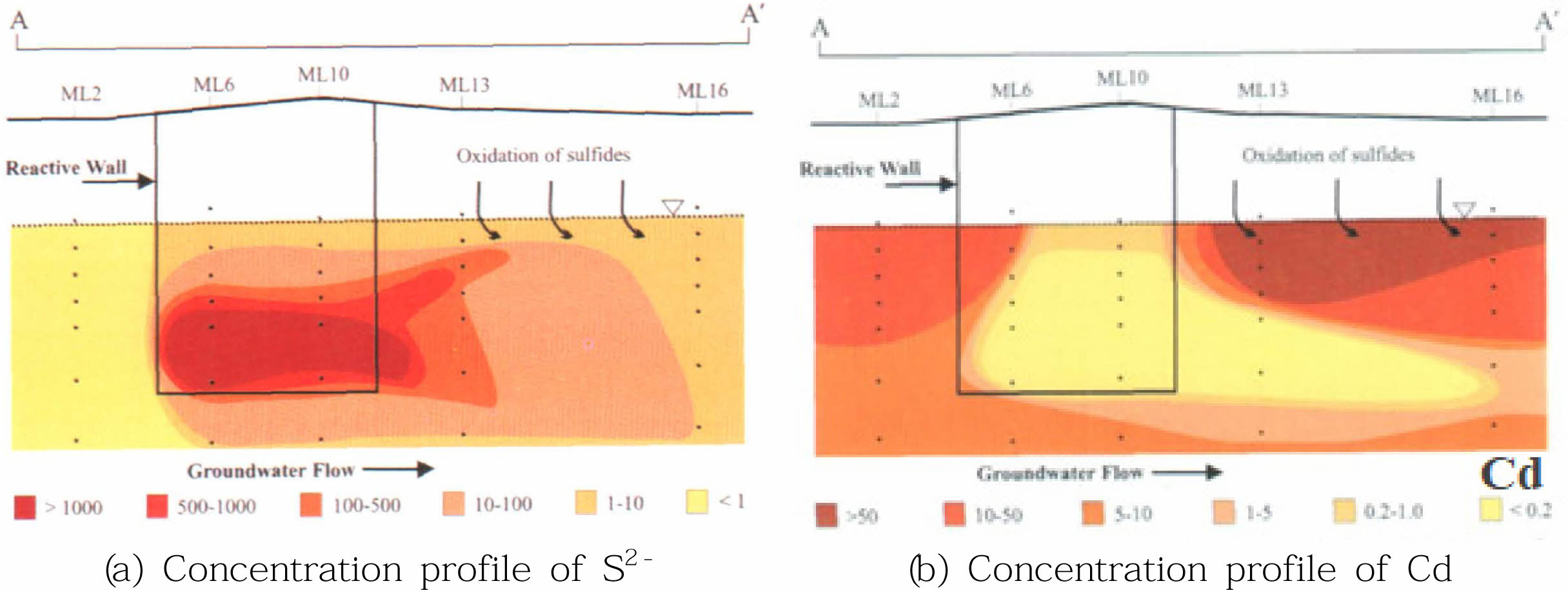
유기탄소를 PRB 형태로 대수층에 주입하여 황화물 저감 조건을 유도하는 것은 중금속을 효율적으로 침전시키며 PRB 내 반응성 물질에 중금속이 흡착되는 효과가 있다. 위와 같은 방법으로 현장에서 실시한 Pilot 실험 결과 PRB에 유입되는 지하수 내 Cd 농도(15.6 μg/L; 8.0~21.4 μg/L)가 PRB을 통과한 이후의 모니터링 지점에서 대부분 정량한계 이하(<0.1 μg/L)로 검출된 사례가 있다(Ludwig et al., 2002)(Fig. 5).
|
Fig. 1 Introduction of the mechnism each adsorbent(Inyang et al., 2016; Liang et al., 2020; Ludwig et al., 2002; Mochida et al., 2000; Scherer et al., 2000; Shen and Buick, 2004; Ullah et al., 2020; Vakili et al., 2019). |
|
Fig. 2 Eh-pH diagram of cadmium (Fine et al., 2005). |
|
Fig. 3 Dissimilatory sulfate reduction (Ludwig et al., 2002). |
|
Fig. 4 Hydrochemicalchanges in the overlying water of an incubated sediment core during redox succession (Ox : Oxygen consumption; DN : Denitrification; AOM : Anaerobic oxidation of methane; MA : Methane accumulation; SR : Sulfate reduction; SO : Sulfide oxidation) (Shen and Buick, 2004). |
|
Fig. 5 Cross-sectional profile of dissolved sulfide (S2-, Cd) 21 months after barrier installation. All units in μg/L (Ludwig et al., 2002). |
|
Table 3 Summary of adsorbents and alkaline agents’ efficiency and adsorption capacity to remediate cadmium |
|
Table 4 Adsorption capacity of various adsorbent related with chitosan for cadmium (Benguella and Benaissa, 2002; Bhatnagar and Sillanpää, 2009; Hasan et al., 2006; Jha et al., 1988; Vakili et al., 2019) |
지하수 중 카드뮴이 고농도로 오염되었지만, 부지 활용 문제 등을 해결하기 어려운 지역일 경우 원위치 공정을 통한 정화방법 적용이 필요하다. 문헌 연구를 통해 다양한 종류의 화학적, 물리·화학적, 생물학적 지하수 내 카드뮴 저감방법을 검토한 결과 앞서 언급한 부지특이적 상황을 극복하기 위해 적용이 용이한 방법은 제올라이트, 활성탄, 키토산 등과 같은 흡착제를 활용한 물리·화학적 흡착 방법과 알칼리시약을 활용한 화학적 침전방법 그리고 SRB를 활용한 생물학적저감 방법이 원위치 지하수 저감 형태로 활용할 수 있는 예이다. 하지만 대부분의 총설 논문에서는 다양한 종류의 저감방법 기작과 적용 방법 등에 대한 사실만을 검토할 뿐 실제 현장에서 적용하는 방식에 대한 논의가 부족하다. 따라서 본 연구를 통해 선정된 카드뮴 저감방법을 활용하여 현장에 적용할 수 있는 단계적 접근방법에 대한 예시를 언급하고자 한다.
실제 현장에서 오염이 확인되었을 경우에는 앞서 언급한 방법을 접목하기에는 상당히 고농도로 오염되었을 확률이 높아 오염원 및 오염정도를 파악한 이후 오염원을 물리적으로 제거하는 것을 우선적으로 추진 해야 한다. 오염원을 제거한 이후 대수층 내 공극에 남아있는 고농도의 중금속 이동을 막기 위해 물리·화학 및 화학적 저감방법을 고려해야 하며 이후 남아있는 저농도 중금속은 생물학적방법을 활용하여 장기적 관리가 필요하다. 하지만 강우 등에 의한 지하수 내 pH 변동이 중금속 용출(Colombani et al., 2020) 등 다양한 관리상 문제점을 야기할 수 있으므로 중금속 저감과정은 지속적인 관리와 모니터링이 필요하다. 따라서, 중금속 오염부지 저감을 위해 단일 공정을 활용한 접근보다는 물리·화학 및 화학적 그리고 생물학적저감 방법을 오염농도 수준에 따라 단계적으로 적용해야 한다(Hashim et al., 2011; Obiri-Nyarko et al., 2014).
본 논문은 환경부의 재원으로 국립환경과학원의 지원을 받아 수행하였습니다(NIER-RP-2020-220).
- 1. Ali Redha, A., 2020, Removal of heavy metals from aqueous media by biosorption, A. J. Bas. Appl. Sci., 27(1), 183-193.
-

- 2. Amonette, J., Szecsody, J., Schaef, H., Gorby, Y., Fruchter, J. and Templeton, J., 1994, Abiotic Reduction of Aquifer Materials by Dithionite: A Promising In-situ Remediation Technology, Pacific Northwest Lab.
-

- 3. Amos, P.W. and Younger, P.L., 2003, Substrate characterisation for a subsurface reactive barrier to treat colliery spoil leachate, W. Re., 37(1), 108-120.
-

- 4. Angelov, A. and Georgiev, P., 1998, In situ Treatment of Groundwater at Burgas Copper Mines, Bulgaria, by Enhancing Microbial Sulphate Reduction, p. 249, IAHS Press.
- 5. Baker, H.M., Massadeh, A.M., and Younes, H.A., 2009, Natural Jordanian zeolite: removal of heavy metal ions from water samples using column and batch methods, Envi. moni. assess., 157(1), 319-330.
-

- 6. Bashir, A., Malik, L.A., Ahad, S., Manzoor, T., Bhat, M.A., Dar, G., and Pandith, A.H., 2019, Removal of heavy metal ions from aqueous system by ion-exchange and biosorption methods, Envi. Chemi. Letter., 17(2), 729-754.
-

- 7. Benguella, B. and Benaissa, H., 2002, Cadmium removal from aqueous solutions by chitin: kinetic and equilibrium studies, W. Re., 36(10), 2463-2474.
-

- 8. Benner, S., Blowes, D.W., Gould, W.D., Herbert, R.B., and Ptacek, C.J., 1999, Geochemistry of a permeable reactive barrier for metals and acid mine drainage, Envi. Sci. & Tech., 33(16), 2793-2799.
-

- 9. Bewley, R., 2007, Treatment of chromium contamination and chromium ore processing residue, Tech. Bulletin., 14.
- 10. Bhatnagar, A. and Sillanpää, M., 2009, Applications of chitin-and chitosan-derivatives for the detoxification of water and wastewater-a short review, Advan. Inter. Science., 152(1-2), 26-38.
-

- 11. Burakov, A.E., Galunin, E.V., Burakova, I.V., Kucherova, A.E., Agarwal, S., Tkachev, A.G., and Gupta, V.K., 2018, Adsorption of heavy metals on conventional and nanostructured materials for wastewater treatment purposes: A review, Ecotoxic. Envi. Safety., 148, 702-712.
-

- 12. Caccin, M., Giacobbo, F., Da Ros, M., Besozzi, L., and Mariani, M., 2013, Adsorption of uranium, cesium and strontium onto coconut shell activated carbon, J. Radi. Nu. Chemi., 297(1), 9-18.
-

- 13. Canty, M., 2000, Innovative in situ treatment of acid mine drainage using sulfate-reducing bacteria, Fifth International Conference on Acid Rock Drainage (ICARD) Proceedings, 2, pp. 1139-1148.
- 14. Clifford, D., Subramonian, S., and Sorg, T.J., 1986, Water treatment processes. III. Removing dissolved inorganic contaminants from water, Environ. Sci. Tech., 20(11), 1072-1080.
-

- 15. Colombani, N., Gervasio, M.P., Castaldelli, G., and Mastrocicco, M., 2020, Soil conditioners effects on hydraulic properties, leaching processes and denitrification on a silty-clay soil, Sci. Envi., 733, 139342.
-

- 16. Dong, X., Ma, L.Q., and Li, Y., 2011, Characteristics and mechanisms of hexavalent chromium removal by biochar from sugar beet tailing, J. Hazard. Mater., 190(1-3), 909-915.
-

- 17. Egirani, D., Poyi, N., and Shehata, N., 2020, Preparation and characterization of powdered and granular activated carbon from Palmae biomass for cadmium removal, Envi. Sci. & Tech., 17(4), 2443-2454.
-

- 18. Erto, A., Lancia, A., Bortone, I., Di Nardo, A., Di Natale, M., and Musmarra, D., 2011, A procedure to design a Permeable Adsorptive Barrier (PAB) for contaminated groundwater remediation, J. Envi. Manage., 92(1), 23-30.
-

- 19. Falciglia, P.P., Gagliano, E., Brancato, V., Malandrino, G., Finocchiaro, G., Catalfo, A., De Guidi, G., Romano, S., Roccaro, P., and Vagliasindi, F.G., 2020, Microwave based regenerating permeable reactive barriers (MW-PRBs): proof of concept and application for Cs removal, Chemo., 251, 126582.
-

- 20. Fine, P., Scagnossi, A., Chen, Y., and Mingelgrin, U., 2005, Practical and mechanistic aspects of the removal of cadmium from aqueous systems using peat, Envi. Pollu., 138(2), 358-367.
-

- 21. Frindte, K., Allgaier, M., Grossart, H.-P., and Eckert, W., 2015, Microbial response to experimentally controlled redox transitions at the sediment water interface, PLoS One, 10(11), e0143428.
-

- 22. Fruchter, J., Cole, C., and Williams, M., 1997, Creation of a Subsurface Permeable Treatment Barrier Using In situ Redox Manipulation, US Department of Energy (USDOE), Washington DC (United States).
-

- 23. Geets, J., Diels, L., Geert, K.V., Brummeler, E.T., Broek, P.v.d., Ghyoot, W., Feyaerts, K., and Gevaerts, W., 2003, Proceedings Consoil 2003, Place, Published.
- 24. Ghaeminia, M. and Mokhtarani, N., 2018, Remediation of nitrate-contaminated groundwater by PRB-Electrokinetic integrated process, J. Envi. Manage., 222, 234-241.
-

- 25. Hanumantha Rao, B. and Gangadhara Reddy, N., 2017, Geoenvironmental Practices and Sustainability, pp. 69-89, Springer.
-

- 26. Hasan, S., Krishnaiah, A., Ghosh, T.K., Viswanath, D.S., Boddu, V.M., and Smith, E.D., 2006, Adsorption of divalent cadmium (Cd (II)) from aqueous solutions onto chitosan-coated perlite beads, Ind. Eng. Chem. Res., 45(14), 5066-5077.
-

- 27. Hashim, M.A., Mukhopadhyay, S., Sahu, J.N., and Sengupta, B., 2011, Remediation technologies for heavy metal contaminated groundwater, J. Envi. Manage., 92(10), 2355-2388.
-

- 28. Hem, J.D., 1985, Study and Interpretation of the Chemical Characteristics of Natural Water, Department of the Interior, US Geological Survey, Place, Published.
- 29. Hong, M., Yu, L., Wang, Y., Zhang, J., Chen, Z., Dong, L., Zan, Q., and Li, R., 2019, Heavy metal adsorption with zeolites: The role of hierarchical pore architecture, Chemi. Engin. J., 359, 363-372.
-

- 30. Huggins, T.M., Haeger, A., Biffinger, J.C., and Ren, Z.J., 2016, Granular biochar compared with activated carbon for wastewater treatment and resource recovery, W. Re., 94, 225-232.
-

- 31. Ibrahimi, M.M. and Sayyadi, A.S., 2015, Application of natural and modified zeolites in removing heavy metal cations from aqueous media: an overview of including parameters affecting the process, J. Geo. Agri. Envi. Sci., 3(2), 1-7.
- 32. Inyang, M.I., Gao, B., Yao, Y., Xue, Y., Zimmerman, A., Mosa, A., Pullammanappallil, P., Ok, Y.S., and Cao, X., 2016, A review of biochar as a low-cost adsorbent for aqueous heavy metal removal, Envi. Sci. & Tech., 46(4), 406-433.
-

- 33. Jha, I., Iyengar, L., and Rao, A.P., 1988, Removal of cadmium using chitosan, J. Envi. Engin., 114(4), 962-974.
-

- 34. Joo, S.H., Feitz, A.J., and Waite, T.D., 2004, Oxidative degradation of the carbothioate herbicide, molinate, using nanoscale zero-valent iron, Environ. Sci. Technol., 38(7), 2242-2247.
-

- 35. Jun, D., Yongsheng, Z., Weihong, Z., and Mei, H., 2009, Laboratory study on sequenced permeable reactive barrier remediation for landfill leachate-contaminated groundwater, J. Hazard. Mater., 161(1), 224-230.
-

- 36. Kaprara, E., Pinakidou, F., Paloura, E.C., Zouboulis, A.I., and Mitrakas, M., 2018, Continuous flow process of Cr (VI) removal from drinking water through reduction onto FeOOH by inorganic sulfur reductants, W. Sci. Tech.: W. Su., 18(2), 737-744.
-

- 37. Kasozi, G.N., Zimmerman, A.R., Nkedi-Kizza, P., and Gao, B., 2010, Catechol and humic acid sorption onto a range of laboratory-produced black carbons (biochars), Environ. Sci. Technol., 44(16), 6189-6195.
-

- 38. Kiran, M.G., Pakshirajan, K., and Das, G., 2017, An overview of sulfidogenic biological reactors for the simultaneous treatment of sulfate and heavy metal rich wastewater, Chemi. Engin. Sci., 158, 606-620.
-

- 39. Kovar, K. and Herbert, M., 1998, Groundwater Quality: Remediation and Protection: Proceedings of the GQ'98 Conference Held in Tübingen, Germany, from 21 to 25 September, IAHS Press, Place, Published.
- 40. Kubier, A., Wilkin, R.T., and Pichler, T., 2019. Cadmium in soils and groundwater: a review, Appl. Geochemi., 108, 104388.
-

- 41. Lapointe, F., Fytas, K., and McConchie, D., 2006, Efficiency of Bauxsol¢â in permeable reactive barriers to treat acid rock drainage, M. W. Envi., 25(1), 37-44.
-

- 42. Lee, M., Paik, I.S., Kim, I., Kang, H., and Lee, S., 2007, Remediation of heavy metal contaminated groundwater originated from abandoned mine using lime and calcium carbonate, J. Hazard. Mater., 144(1-2), 208-214.
-

- 43. Li, D., Kaplan, D.I., Knox, A.S., Crapse, K.P., and Diprete, D.P., 2014, Aqueous 99Tc, 129I and 137Cs removal from contaminated groundwater and sediments using highly effective low-cost sorbents, J. Envi. Radio., 136, 56-63.
-

- 44. Li, Z., Gu, H., Hong, B., Wang, N., and Chen, M., 2022, An innovative process for dealkalization of red mud using leachate from Mn-containing waste, J. Envi. Chemi. Engin., 10(2), 107222.
-

- 45. Liang, L., Li, X., Lin, Z., Tian, C., and Guo, Y., 2020, The removal of Cd by sulfidated nanoscale zero-valent iron: The structural, chemical bonding evolution and the reaction kinetics, Chemi. Engin. J., 382, 122933.
-

- 46. Lin, X., Burns, R.C., and Lawrance, G.A., 2005, Heavy metals in wastewater: the effect of electrolyte composition on the precipitation of cadmium (II) using lime and magnesia, Water, Air, and Soil Pollution, 165(1), 131-152.
-

- 47. Liu, X., Chen, G.-R., Lee, D.-J., Kawamoto, T., Tanaka, H., Chen, M.-L., and Luo, Y.-K., 2014, Adsorption removal of cesium from drinking waters: A mini review on use of biosorbents and other adsorbents, Bio. Tech., 160, 142-149.
-

- 48. Lockwood, C.L., Mortimer, R.J., Stewart, D.I., Mayes, W.M., Peacock, C.L., Polya, D.A., Lythgoe, P.R., Lehoux, A.P., Gruiz, K., and Burke, I.T., 2014, Mobilisation of arsenic from bauxite residue (red mud) affected soils: effect of pH and redox conditions, Appl. Geochemi., 51, 268-277.
-

- 49. Lombi, E., Zhao, F.-J., Zhang, G., Sun, B., Fitz, W., Zhang, H., and McGrath, S.P., 2002, In situ fixation of metals in soils using bauxite residue: chemical assessment, Envi. Pollu., 118(3), 435-443.
-

- 50. Ludwig, R.D., McGregor, R.G., Blowes, D.W., Benner, S.G., and Mountjoy, K., 2002, A permeable reactive barrier for treatment of heavy metals, Ground., 40(1), 59-66.
-

- 51. Mandal, S., Muralidharan, C., and Mandal, A.B., 2019, Water pollution remediation techniques with special focus on adsorption, Advanced Research in Nanosciences for Water Technology, pp. 39-68, Springer.
-

- 52. Mariana, M., HPS, A.K., Mistar, E., Yahya, E.B., Alfatah, T., Danish, M., and Amayreh, M., 2021, Recent advances in activated carbon modification techniques for enhanced heavy metal adsorption, J. W. Proc. Engin., 43, 102221.
-

- 53. Marsh, H. and Reinoso, F.R., 2006, Activated Carbon, Elsevier, Place, Published.
- 54. Miao, Z., Brusseau, M., Carroll, K.C., Carreón-Diazconti, C., and Johnson, B., 2012, Sulfate reduction in groundwater: characterization and applications for remediation, Envi. Geochemi. Heal., 34(4), 539-550.
-

- 55. Mochida, I., Korai, Y., Shirahama, M., Kawano, S., Hada, T., Seo, Y., Yoshikawa, M., and Yasutake, A., 2000, Removal of SOx and NOx over activated carbon fibers, Carbon., 38(2), 227-239.
-

- 56. Mohammed, A. S., Kapri, A., and Goel, R., 2011, Heavy metal pollution: Source, impact, and remedies, Biomanage. Metal-con. Soil., 20, 1-28
-

- 57. Mohan, D. and Pittman Jr, C.U., 2006, Activated carbons and low cost adsorbents for remediation of tri-and hexavalent chromium from water, J. Hazard. Mater., 137(2), 762-811.
-

- 58. Montaña, M., Camacho, A., Serrano, I., Devesa, R., Matia, L., and Vallés, I., 2013, Removal of radionuclides in drinking water by membrane treatment using ultrafiltration, reverse osmosis and electrodialysis reversal, J. Envi. Radio., 125, 86-92.
-

- 59. Moraci, N. and Calabrò, P.S., 2010, Heavy metals removal and hydraulic performance in zero-valent iron/pumice permeable reactive barriers, J. Envi. Manage., 91(11), 2336-2341.
-

- 60. Motsi, T. 2010 Remediation of Acid Mine Drainage using Natural Zeolite, University of Birmingham.
- 61. Mucsi, G., Halyag, N., Kurusta, T., and Kristály, F., 2021, Control of carbon dioxide sequestration by mechanical activation of red mud, Wa. Bio. Valori., 12(12), 6481-6495.
-

- 62. Mukherjee, A., Zimmerman, A., and Harris, W., 2011, Surface chemistry variations among a series of laboratory-produced biochars, Geoderma, 163(3-4), 247-255.
-

- 63. Obiri-Nyarko, F., Grajales-Mesa, S.J., and Malina, G., 2014, An overview of permeable reactive barriers for in situ sustainable groundwater remediation, Chemo., 111, 243-259.
-

- 64. Puls, R.W., Paul, C.J., and Powell, R.M., 1999, The application of in situ permeable reactive (zero-valent iron) barrier technology for the remediation of chromate-contaminated groundwater: a field test, Appl. Geochemi., 14(8), 989-1000.
-

- 65. Rao, K., Mohapatra, M., Anand, S., and Venkateswarlu, P., 2010, Review on cadmium removal from aqueous solutions, J. Engin. Sci. Tech., 2(7).
-

- 66. Rubinos, D.A. and Spagnoli, G., 2019, Assessment of red mud as sorptive landfill liner for the retention of arsenic (V), J. Envi. Manage., 232, 271-285.
-

- 67. Saikhao, L., Setthayanond, J., Karpkird, T., and Suwanruji, P., 2017, Comparison of sodium dithionite and glucose as a reducing agent for natural indigo dyeing on cotton fabrics, MATEC Web of Conferences., 108, 03001, EDP Sciences.
-

- 68. Scherer, M.M., Richter, S., Valentine, R.L., and Alvarez, P.J., 2000, Chemistry and microbiology of permeable reactive barriers for in situ groundwater clean up, Critical Reviews in Microbiology, 26(4), 221-264.
-

- 69. Sedlazeck, K.P., Vollprecht, D., Müller, P., Mischitz, R., and Gieré, R., 2020, Impact of an in-situ Cr (VI)-contaminated site remediation on the groundwater, Envi. Sci. Pollu. Re., 27(13), 14465-14475.
-

- 70. Shen, Y. and Buick, R., 2004, The antiquity of microbial sulfate reduction, Earth-Sci. Review., 64(3-4), 243-272.
-

- 71. Shin, E.C., Park, J.J., Jeong, C.G., Kim, S.H., 2014, Adsorption characteristics evaluation of natural zeolite for heavy-metal contaminated material remediation, J. Korea. Geo. Soci., 13(2), 59-67.
-

- 72. Singh, B., Alloway, B., and Bochereau, F., 2000, Cadmium sorption behavior of natural and synthetic zeolites, Communi. S. Sci. P. A., 31(17-18), 2775-2786.
-

- 73. Song, J., Huang, G., Han, D., Hou, Q., Gan, L., and Zhang, M., 2021, A review of reactive media within permeable reactive barriers for the removal of heavy metal (loid) s in groundwater: Current status and future prospects, J. Clean. Pro., 319, 128644.
-

- 74. Stefaniuk, M., Oleszczuk, P., Ok, Y.S., 2016, Review on nano zerovalent iron (nZVI): From synthesis to environmental applications, Chemi. Engin. J., 287, 618-632.
-

- 75. Su, Y., Adeleye, A.S., Keller, A.A., Huang, Y., Dai, C., Zhou, X., and Zhang, Y., 2015, Magnetic sulfide-modified nanoscale zerovalent iron (S-nZVI) for dissolved metal ion removal, W. Re., 74, 47-57.
-

- 76. Su, Y., Lowry, G.V., Jassby, D., Zhang. Y., 2019, Sulfide-modified NZVI(S-NZVI): Synthesis, characterization, and reactivity, Nano. Zero. I. Parti. Envi. Re., 359-386.
-

- 77. Taamneh, Y. and Sharadqah, S., 2017, The removal of heavy metals from aqueous solution using natural Jordanian zeolite, Appl. W. Sci., 7(4), 2021-2028.
-

- 78. Tajar, A.F., Kaghazchi, T., and Soleimani, M., 2009, Adsorption of cadmium from aqueous solutions on sulfurized activated carbon prepared from nut shells, J. Hazard. Mater., 165(1-3), 1159-1164.
-

- 79. Tandon, P.K. and Singh, S.B., 2016, Redox processes in water remediation, Envi. Chemi. Letter., 14(1), 15-25.
- 80. Tasharrofi, S., Rouzitalab, Z., Maklavany, D.M., Esmaeili, A., Rabieezadeh, M., Askarieh, M., Rashidi, A., and Taghdisian, H., 2020, Adsorption of cadmium using modified zeolite-supported nanoscale zero-valent iron composites as a reactive material for PRBs, Sci. Envi., 736, 139570.
-

- 81. Thornton, E. and Jackson, R., 1994, Laboratory and Field Evaluation of the Gas Treatment Approach for Insitu Remediation of Chromate-contaminated Soils, Westinghouse Hanford Co.
-

- 82. Ullah, S., Faiz, P., and Leng, S., 2020, Synthesis, Mechanism, and Performance Assessment of Zero‐Valent Iron for Metal‐Contaminated Water Remediation: A Review, CLEAN–S. A. W., 48(9), 2000080.
-

- 83. Vakili, M., Deng, S., Cagnetta, G., Wang, W., Meng, P., Liu, D., and Yu, G., 2019, Regeneration of chitosan-based adsorbents used in heavy metal adsorption: A review, Se. Purifi. Tech., 224, 373-387.
-

- 84. Vanderheyden, S., Van Ammel, R., Sobiech-Matura, K., Vanreppelen, K., Schreurs, S., Schroeyers, W., Yperman, J., and Carleer, R., 2016, Adsorption of cesium on different types of activated carbon, J. Radio. Nu. Chemi., 310(1), 301-310.
-

- 85. Wang, M. and Liu, X., 2021, Applications of red mud as an environmental remediation material: A review, J. Hazard. Mater., 408, 124420.
-

- 86. Wang, S., Gao, B., Zimmerman, A.R., Li, Y., Ma, L., Harris, W.G., and Migliaccio, K.W., 2015, Physicochemical and sorptive properties of biochars derived from woody and herbaceous biomass, Chemo., 134, 257-262.
-

- 87. Wang, S. and Wu, H., 2006, Environmental-benign utilisation of fly ash as low-cost adsorbents, J. Hazard. Mater., 136(3), 482-501.
-

- 88. Waybrant, K., Blowes, D., and Ptacek, C., 1998, Selection of reactive mixtures for use in permeable reactive walls for treatment of mine drainage, Environ. Sci. Technol., 32(13), 1972-1979.
-

- 89. Weber, A., Ruhl, A.S., and Amos, R.T., 2013, Investigating dominant processes in ZVI permeable reactive barriers using reactive transport modeling, J. Contami. Hydro., 151, 68-82.
-

- 90. Yang, L., Donahoe, R.J., and Redwine, J.C., 2007, In situ chemical fixation of arsenic-contaminated soils: An experimental study, Sci. Envi., 387(1-3), 28-41.
-

- 91. Zaini, M.A.A., Amano, Y., and Machida, M., 2010, Adsorption of heavy metals onto activated carbons derived from polyacrylonitrile fiber, J. Hazard. Mater., 180(1-3), 552-560.
-

- 92. Zhou, D., Li, Y., Zhang, Y., Zhang, C., Li, X., Chen, Z., Huang, J., Li, X., Flores, G., and Kamon, M., 2014, Column test-based optimization of the permeable reactive barrier (PRB) technique for remediating groundwater contaminated by landfill leachates, J. Contami. Hydro., 168, 1-16.
-

 This Article
This Article
-
2022; 27(4): 22-36
Published on Aug 31, 2022
- 10.7857/JSGE.2022.27.4.022
- Received on Jul 25, 2022
- Revised on Aug 4, 2022
- Accepted on Aug 22, 2022
 Services
Services
Shared
 Correspondence to
Correspondence to
- Hyun-Koo Kim
-
National Institute of Environmental Research, Incheon 22689, Korea
- E-mail: khk288@korea.kr