- Stabilization Mechanisms of Powdered and Bead Type Stabilizer Made of Mg-Fe Layered Double Hydroxide (LDH) for the Arsenic Contaminated Soil
Seonhee Kim1·Kyeongtae Kim1·Yuna Oh1·Yikyeong Han2·Minhee Lee2*
1Major of Earth and Environmental Sciences, Division of Earth Environmental System Science, Pukyong National University, Busan 48513, Korea
2Major of Environmental Geosciences, Division of Earth Environmental System Science, Pukyong National University, Busan 48513, Korea- Mg-Fe 이중층수산화물로 제조한 분말상과 입상 안정화제의 비소 오염토양 안정화 기작
김선희1·김경태1·오유나1·한이경2·이민희2*
1부경대학교 지구환경시스템과학부 지구환경과학전공
2부경대학교 지구환경시스템과학부 환경지질과학전공This article is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
The magnesium and iron-based layered double hydroxide (Mg-Fe LDH) was synthesized by the co-precipitation process and the bead type LDH (BLDH, 5~6 mm in diameter) was manufactured by using the Mg-Fe LDH and the starch as a binder. To evaluate the feasibility of the BLDH as the As stabilizer in the soil, various experiments were performed and the As stabilization efficiency of the BLDH was compared to that of powdered type LDH (PLDH, <149 μm in diameter). For the As sorption batch experiment, the As sorption efficiency of both of the PLDH and the BLDH showed higher than 99%. For the stabilization experiment with soil, the As extraction reducing efficiency of the PLDH was higher than 87%, and for the BLDH, it was higher than 80%, suggesting that the BLDH has similar the feasibility of As stabilization for the contaminated soil, compared to the PLDH. From the continuous column experiments, when more than 7% BLDH was added into the soil, the As stabilization efficiency of the column maintained at over 91% for 7 pore volume flushing (simulating about 21 months of rainfall) and slowly decreased down to 64% after that time (to 36 months) under the non-equilibrium conditions. Results suggested that more than 7% of BLDH added in As-contaminated soil could be enough to stabilize As in soil for a long time. The main As fixation mechanisms on the LDH were also identified through the X-ray fluorescence (XRF), the X-ray diffraction (XRD), and the Fourier transform infrared (FT-IR) analyses. Results showed that the LDH has enough of an external surface adsorption capacity and an anion exchange capability at the interlayer spaces. Results of SEM/EDS and BET analyses also supported that the Mg-Fe LDH used in this study has sufficient porous structures and outer surfaces to fix the As. The reduction of carbonate (CO32-) and sulfate (SO42-) anions in the LDH after the reaction between As and the LDH was observed through the FT-IR, the XRF, and the XRD analyses, suggesting that the exchange of some of these anions with the arsenate (H2AsO4- or HAsO42-) occurs at the LDH interlayers during the stabilization process in soil.
Keywords: arsenic, LDH, Mg-Fe LDH, soil pollution, sorption, stabilization
비소(arsenic: 이하 ‘As’로 표기)는 대표적인 국내외 토양오염 물질로 알려졌으며, 토양 내 As를 고정하기 위해 안정화공법(stabilization)이 많이 적용되어왔다(Nriagu et al., 2007; USEPA, 2002; USEPA, 2012; WHO, 2019). 안정화공법은 오염물질을 토양으로부터 직접적으로 제거하지는 않지만, 오염물질의 잠재적인 위해성을 감소시키는 공법으로, 안정화제와 토양 내 오염물질간의 산화/환원, 중화, 이온교환, 침전/공침, 광물화 등 다양한 반응기작들을 통하여 오염물질의 유동성, 독성, 용해성을 감소시켜 주변 환경으로의 확산을 방지함으로써, 부지를 적절하게 활용할 수 있는 방법이다(MOE, 2007). 지금까지 국내에서 수행된 As에 대한 안정화공법은 제강슬래그와 같은 제한된 안정화제만을 사용하고, 주로 폐광산 주변 중금속 오염 농경지의 토양개량복원사업에 적용하는 수준에 머물러 있어서, 사실상 국내의 As로 오염된 토양에 대한 안정화공법 관련 기술과 새로운 안정화제의 개발은 매우 부진한 실정이다(Lee at al., 2016; USEPA, 2007).
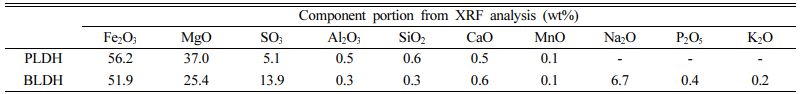
본 연구에서는 As로 오염된 토양 정화를 위한 토양 안정화제로서 이중층수산화물(layered double hydroxide: 이하 ‘LDH’로 표기)의 적용 가능성을 검증하였으며, 기존의 분말형이 아닌 입상형태의 LDH를 새로운 토양 안정화제로 개발하였다. 상용화된 LDH의 일반적인 분자식은 [(M2+)1-x(M3+)x(OH)2]x+(An-)x/n·mH2O이며, M2+과 M3+는 각각 2가 양이온(Mg2+, Zn2+, Ni2+, and Fe2+, etc.) 과 3가 양이온(Al3+, Mn3+, Fe3+, and Cr3+, etc.)을 의미하고, An-는 브루사이트 층 사이에 존재하는 음이온(CO32-, NO3-, SO42- and Cl-, etc.)을 의미한다(Kang et al., 2013; Prasanna and Kamath, 2009). LDH는 중심에 금속 양이온과 꼭지점에 음이온인 OH기를 가지는 팔면체가 2차원으로 확장된 층상구조로 이루어져 있고, 이 중에서 양전하를 띠는 브루사이트계열의 층구조와 층간에 존재하는 음이온들로 구성되어 있다(Mills et al., 2012). LDH는 비표면적이 크고, 층 사이에 존재하는 음이온과 오염물질 간의 이온교환이 발생하여 수계로부터 여러 오염물질을 제거하는 소재로 사용되어 왔으며(Goh et al., 2008; Jiang et al., 2015; Koilraj and Sasaki, 2016; Li et al., 2021; Luengo et al., 2017; Otgonjargal et al., 2012; Wang et al., 2009), 제조방법이 쉽고, 가격도 비교적 저렴하며, 독성이 거의 없다는 장점이 있어서, 토양 안정화제로서의 사용 가능성이 연구되어왔다(Ha et al., 2016). 본 연구에서는 마그네슘(Mg2+)과 철(Fe3+)을 팔면체 중심 양이온으로 활용한 LDH(이하 ‘Mg-Fe LDH’로 표기)를 제조하여(Choong et al., 2021; KIPO, 2018), 토양 내 As를 고정시키는 토양 안정화제로 사용하고자 하였다. 제조한 LDH의 구조를 Fig. 1에 나타내었다. 기존 연구들에서는 As 안정화 효율을 높이기 위하여, 주로 분말상의 안정화제를 사용하였으나(Hudcová et al., 2018; Jung et al., 2021; Kang et al., 2013), 분말상의 안정화제는 실제 오염부지에 적용 시, 분진 발생 및 잘 혼합되지 않아 안정화 효과의 지속성이 떨어지는 등 한계가 있었다(Jo et al., 2021). 따라서 본 연구에서는 분말상의 LDH 안정화제(powdered LDH: 이하 ‘PLDH’로 표기)와 친환경적이고 가격도 저렴한 산업용 전분을 바인더로 활용하여 새롭게 제조한 입상 LDH 안정화제(bead type LDH: 이하 ‘BLDH’로 표기)에 대하여, 두 안정화제의 As 용출저감효율과 안정화 효율을 비교하는 회분식 실험과 연속컬럼실험을 수행하였다. 다양한 실내실험과 분석을 통해 실제 As 오염부지에 대한 BLDH 안정화제의 적용 가능성을 검증하고자 하였으며, 본 연구에서 제조한 Mg-Fe LDH의 As 고정기작을 규명하고자 하였다.
|
Fig. 1 Schematic illustration of the prepared LDH structure. |
2.1. 실험 재료
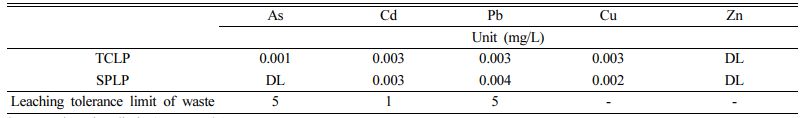
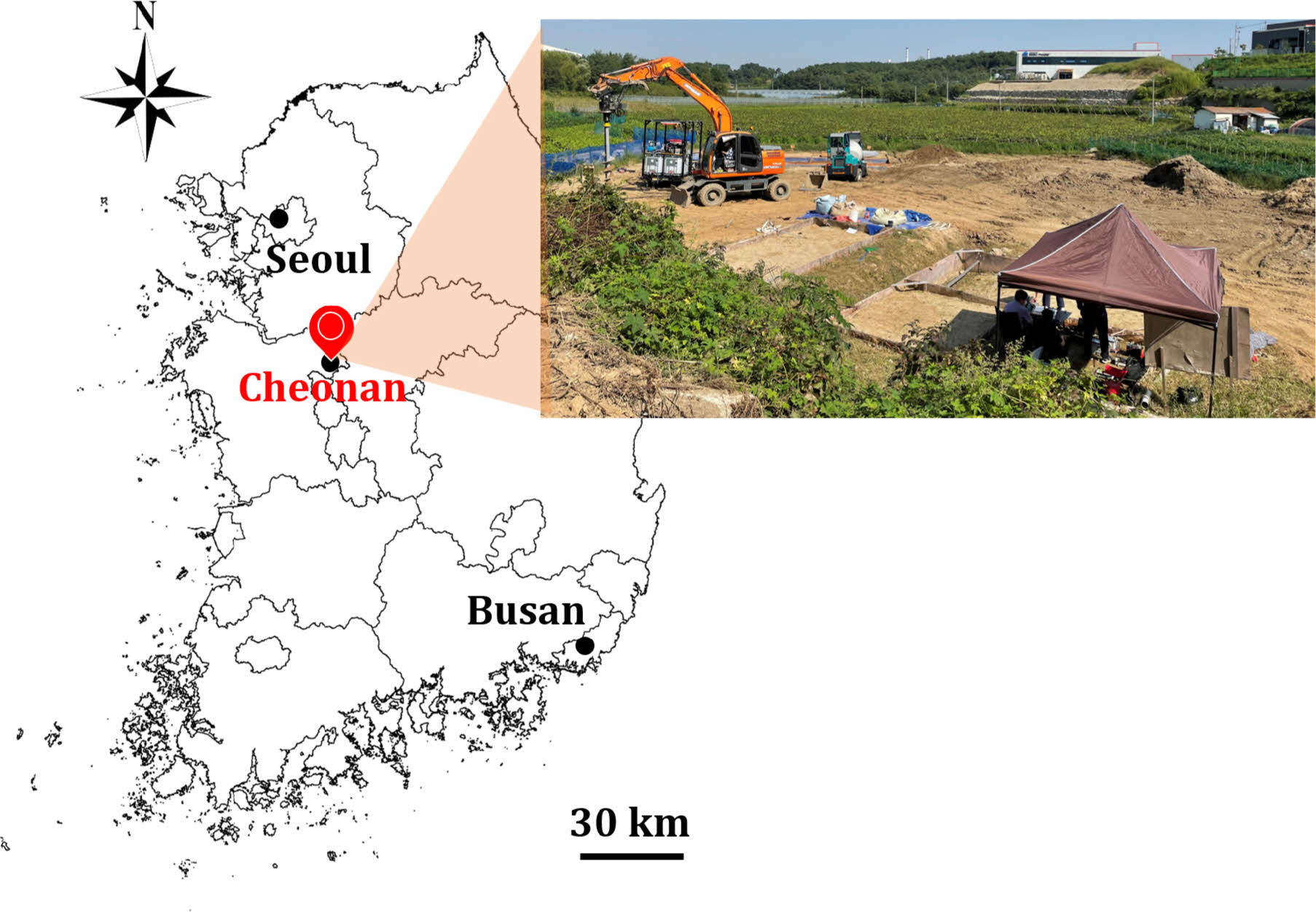
Mg-Fe LDH를 제조하기 위하여 고상의 황산철(Fe2 (SO4)3·5H2O; 60~80%), 황산마그네슘(MgSO4·7H2O; 99.5%), 그리고 수산화나트륨(NaOH; 98%)을 각각 Kanto Che- mical Co., K+S KALI, 영진화학에서 구입하여 사용하였다. 실제 As로 오염된 고농도의 오염수를 확보하기 어려워, 1000 mg/L 농도를 가지는 As 표준용액(2% 질산용액: Sigma Aldrich 회사 제품)을 증류수에 희석하여 인공오염수로 사용하였다. 본 연구에서 사용한 As 오염토양은 충청남도 천안시의 폐금광산 주변에 위치하며, 광산활동에 의해 생성된 다량의 광미 유입으로 오염된 농경지에서 채취하였다(Fig. 2)(Park et al., 2018). 오염토양 시료는 오염 농경지에 세 곳을 지정하여 30~60 cm 깊이의 표토를 채취하였으며, 50oC 이하에서 건조한 후 체거름을 실시하여 10번체(직경 <2 mm)를 통과한 토양시료를 혼합하여 실험에 사용하였다. 토양 내 As 농도를 측정하기 위해 환경부에서 지정한 강산추출법을 적용하였으며(NIER, 2018), ICP-OES(Inductively coupled plasma optical emission spectroscopy: Optima 7000 DV; Perkin Elmer)를 활용하여 As 농도를 측정한 결과 토양의 평균 As 농도는 112 mg/kg으로, 토양오염우려기준(KSPWL: Korean Soil Pollution Warning Limit)을 초과하는 것으로 나타났다(Table 1).
2.2. Mg-Fe LDH를 사용하여 제조한 입상 및 분말상 안정화제 특성 규명
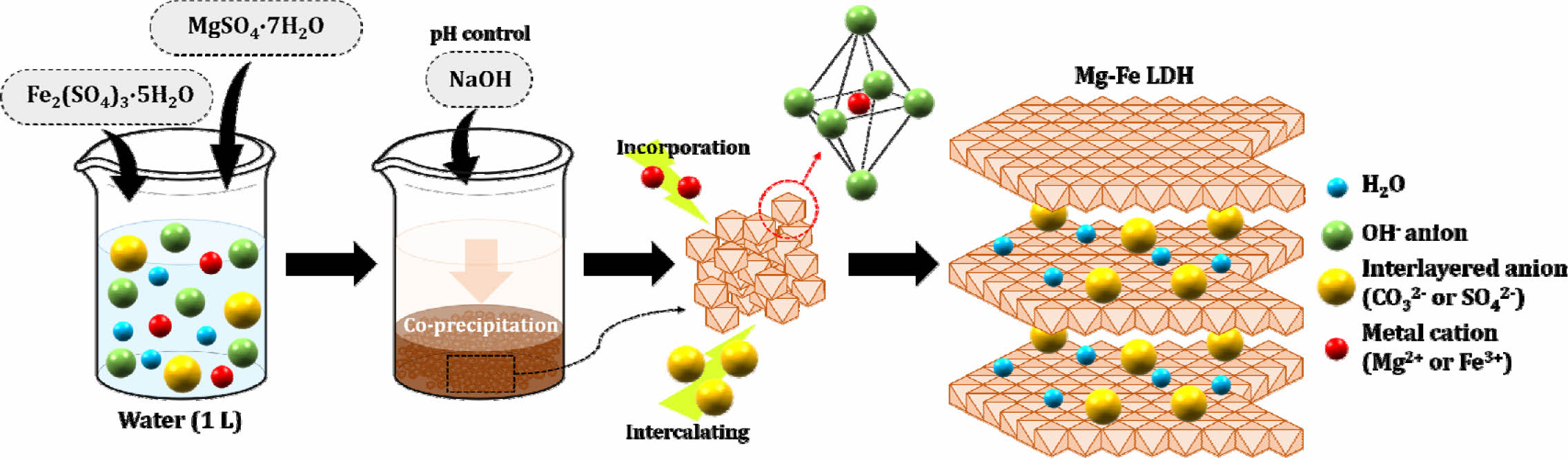
Mg-Fe LDH는 선행연구를 참고하여 공침법을 사용하여 제조되었으며(Choong et al., 2021; Kang et al., 2013), 제조 과정을 Fig. 3에 모식도로 나타내었다(KIPO, 2018). 물 1 L에 황산철 200 g과 황산마그네슘 500 g을 첨가하여 1시간 동안 60 rpm으로 교반시킨 후(‘용액 1’), ‘용액 1’에 수산화나트륨 180 g을 첨가하여 2시간 동안 교반하였다(‘용액 2’). 수산화나트륨을 사용하여 ‘용액 2’의 pH를 10으로 적정한 후, 공침으로 인해 침전된 시료를 150~ 160oC의 조건에서 24시간 동안 건조시켜 Mg-Fe LDH(이후로는 ‘LDH’로 표기)를 제조하였다. 제조한 LDH를 분쇄기를 사용하여 10분 동안 분쇄 후, 100번체(직경 <149 μm)를 사용하여 체를 통과한 분말시료를 실험에 사용하였으며, 분말상의 LDH를 ‘PLDH(powdered LDH)’로 명명하였다. 본 연구를 통해 국내 특허를 취득한 제조방법에 따라, 산업용 전분(starch: 밀가루)을 바인더로 사용하여 5~6 mm 직경의 입상 LDH(bead type LDH: 이하 ‘BLDH’로 표기)를 제조하였으며, 두 안정화제의 제조 과정을 도식화하여 Fig. 4 에 나타내었다. LDH 안정화제의 광물학적 특성을 규명하기 위하여 XRD(X-ray diffracto- meter: X'Pert3 Powder; PANalytical) 분석과 XRF(X-ray fluorescence spectrometer: XRF-1800; Shimadzu) 분석을 수행하였으며, LDH 구조 내 As 고정기작을 규명하기 위하여 FT-IR(Fourier transform infrared spectro- meter: Vertex80v; Bruker) 분석을 수행하였다. LDH의 중금속 용출 특성을 이해하고, 실제 오염부지에 적용 시 부지 및 주변 수계 오염 가능성을 평가하기 위하여 독성용출시험(TCLP: toxicity characteristic leaching procedure)과 인공강우용출시험(SPLP: synthetic precipitation leaching procedure)을 수행하였다(USEPA, 1992; USEPA, 1994).
Fig. 4 table 1
2.3. 회분식 As 수착실험
As 오염토양 안정화제로서 LDH의 사용 가능성을 검증하기 위하여 안정화제의 As 수착능력을 규명하고자, As 인공오염수를 사용하여 회분식으로 수착실험을 수행하였다. 2차 증류수와 As 농도가 1,000 mg/L인 표준용액(Sigma-Adrich 제품)을 사용하여 As 초기농도가 1 mg/L인 인공오염수를 제조하였다. 두 종류 LDH(PLDH와 BLDH)의 As 수착능력을 파악하기 위하여, As 농도 1 mg/L의 인공오염수 100 mL에 안정화제를 용액에 대해 0, 3, 5, 7, 10%(wt%) 첨가하여 2시간 동안 150 rpm으로 교반 후, 24시간 동안 정치시켰다. 정치 후 시료의 상등액을 마이크로 필터기(0.8 μm syringe filter: 16592-K; Sartorius)가 부착된 주사기를 이용하여 10 mL 채수한 후, ICP-OES를 활용하여 용액 내 As 농도를 측정하였다. 분석결과로부터 안정화제를 첨가하지 않은 대조구(0%)와 안정화제를 첨가한 경우의 인공오염수 내 As 농도 값을 비교하여, As 수착효율(sorption efficiency: %)을 식(1)을 사용하여 계산하였다.
Sorption efficiency (%) = (C0 - Ce) / C0 × 100 (1)
여기서 C0는 안정화제를 첨가하지 않은 경우의 오염수 내 초기 As 농도(mg/L), Ce는 안정화제와 반응 후 오염수 내 As 농도(mg/L)를 의미하며, 위 실험은 안정화제 첨가량별로 3회 반복실험을 수행하였다. PLDH와 BLDH의 As 수착능력을 수착효율 값으로 나타내어 비교함으로써, 입상으로 제조한 BLDH에 대하여 토양 안정화제로써 사용 가능성을 규명하고자 하였다.
2.4. 회분식 As 용출실험
안정화제를 실제 As 오염토양에 적용하였을 때 As의 용출저감효과를 파악하기 위하여 회분식으로 용출실험을 수행하였다(Yang et al., 2021a). As 오염토양 시료 50 g에 증류수 150 mL와 안정화제를 토양 시료에 대해 0, 3, 5, 7, 10%(wt%) 첨가하여 2시간 동안 교반 후, 24시간 동안 정치시켰다. 정치 후 시료의 상등액을 마이크로 필터기가 부착된 주사기를 이용하여 10 mL 채수한 후, ICP-OES를 활용하여 용출액 내 As 농도를 측정하였다. 분석결과로부터 안정화제를 첨가하지 않은 대조구(0%)와 안정화제를 첨가한 경우의 용출액 내 As 농도 값을 비교하여, As 용출저감(안정화)효율(the extraction reducing (stabilization) efficiency: %)을 식(2)를 사용하여 계산하였다.
The extraction reducing (stabilization) efficiency (%) = (C0 - Ce) / C0 × 100 (2)
여기서 C0는 안정화제를 첨가하지 않은 오염토양 대조구 시료의 용출액 내 As 농도(mg/L), Ce는 안정화제를 첨가한 시료의 용출액 내 As 농도(mg/L)를 의미하며, 위 실험은 안정화제 첨가량별로 3회 반복실험을 수행하였다. PLDH와 BLDH의 용출저감(안정화)효율을 계산하여 실제 As 오염토양에 대하여 안정화제로써 적용 가능성을 평가하고자 하였다.
2.5. 연속컬럼실험
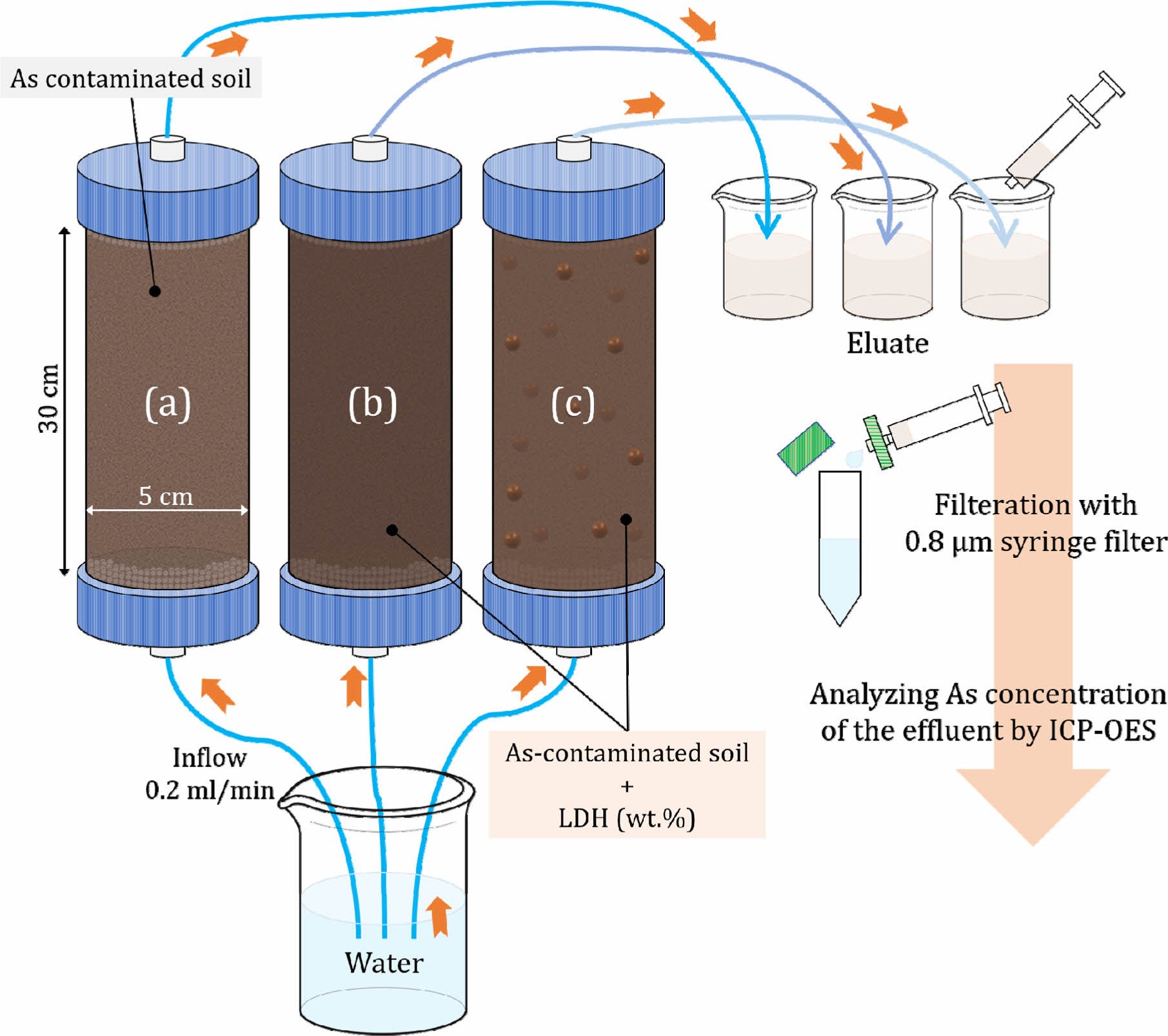
회분식 실험은 평형상태(equilibrium status)를 모사하여 수행하였으므로, 대부분 비평형 조건이 유지되는 실제 오염부지환경에서 안정화제의 적용 가능성을 파악하기 위한 연속컬럼실험을 수행하였다. 본 연구에서는 컬럼실험기준(ISO, 2019)에 맞춰 직경 5 cm, 길이 30 cm의 유리컬럼을 사용하여, 1) As 오염토양으로만 충진된 컬럼, 2) As 오염토양시료와 토양시료에 대해 5%의 PLDH로 충진된 컬럼, 3) As 오염토양시료와 토양시료에 대해 각각 5, 7, 10%의 BLDH로 충진된 컬럼을 제작하여, 증류수가 연속으로 통과하는 조건에서 컬럼 유출수의 As 용출저감효율을 측정하였다. 모든 컬럼은 2차 증류수로 1 공극체적(pore volume)량 만큼 상향식(up-flow)으로 0.2 mL/min 속도로 흘려보내 컬럼을 증류수로 포화시킨 후, 약 14 공극체적(약 2 L; 한국의 연간 강수량 기준으로 약 3년에 해당) 이상 추가로 통과시켰다. 증류수 세정 시간 간격에 따라 컬럼 상부로부터 용출수를 채취하여 As 농도를 측정한 후, 세정 시간에 따른 As 용출저감(안정화)효율을 계산하였다. 연속컬럼실험 과정은 Fig. 5에 모식도로 나타내었으며, 실험조건은 Table 2에 나타내었다. 컬럼실험 과정에서 얻어진 PLDH와 BLDH의 As 안정화효율을 비교함으로써, 입상 BLDH 안정화제의 실제 오염부지 적용 가능성을 판단하였다.
2.6. LDH의 As 고정기작 규명을 위한 회분식 수착실험
안정화 효과를 나타내는 LDH의 As 고정기작을 규명하기 위하여, 고농도(100 mg/L)의 As 인공오염수를 사용한 회분식 수착실험을 수행하였다. 2차 증류수와 As 농도가 1,000 mg/L인 표준용액을 사용하여 As 초기농도가 100 mg/L인 인공오염수를 제조하였다. As 농도 100 mg/L의 인공오염수 100 mL에 두 종류의 LDH(PLDH와 BLDH) 안정화제를 용액대비 0, 3, 5, 7, 10%(wt%) 첨가하여 2시간 동안 150 rpm으로 교반 후, 24시간 동안 정치시켰다. 5B 필터지를 활용하여 안정화제와 용액을 분리하였으며, 분리한 안정화제를 23oC에서 건조시켰다. 반응 전/후 LDH 표면 관찰과 PLDH와 BLDH에 대한 As의 고정형태를 파악하기 위하여, SEM-EDS(Scanning electron microscope-energy dispersive X-ray spectrometer: VEGA II LSU; Tescan) 분석을 실시하였으며, 안정화 과정 전/후 LDH의 성분 변화가 있는지 알아보기 위하여 XRF 분석을 실시하였다. 안정화 과정 동안 LDH의 광물학적 특성과 반응기 변화를 규명하기 위하여 회분식 수착실험 전/후 XRD 분석과 FT-IR 분석을 실시하였다. 위의 분석결과들을 해석하여 LDH에 대한 주된 As의 고정기작(표면흡착, 이온교환 등)을 규명하고자 하였다.
|
Fig. 2 Sampling location of the As-contaminated soil. |
|
Fig. 3 Schematic of the synthesis process for the Mg-Fe LDH. |

|
Fig. 4 The manufacturing process of the PLDH and the BLDH. |
|
Fig. 5 Schematic illustration of column experiments (packed with only the As-contaminated soil (a); packed with the soil+PLDH (b); packed with the soil+BLDH (c)). |
|
Table 1 Results of the aqua regia extraction method for the soil sample |

*KSPWL: Korean soil pollution warning limit (MOE, Ministry of Environment in Korea, 2022) |
3.1. PLDH와 BLDH의 물리적/화학적 특성 및 적용가능성 규명
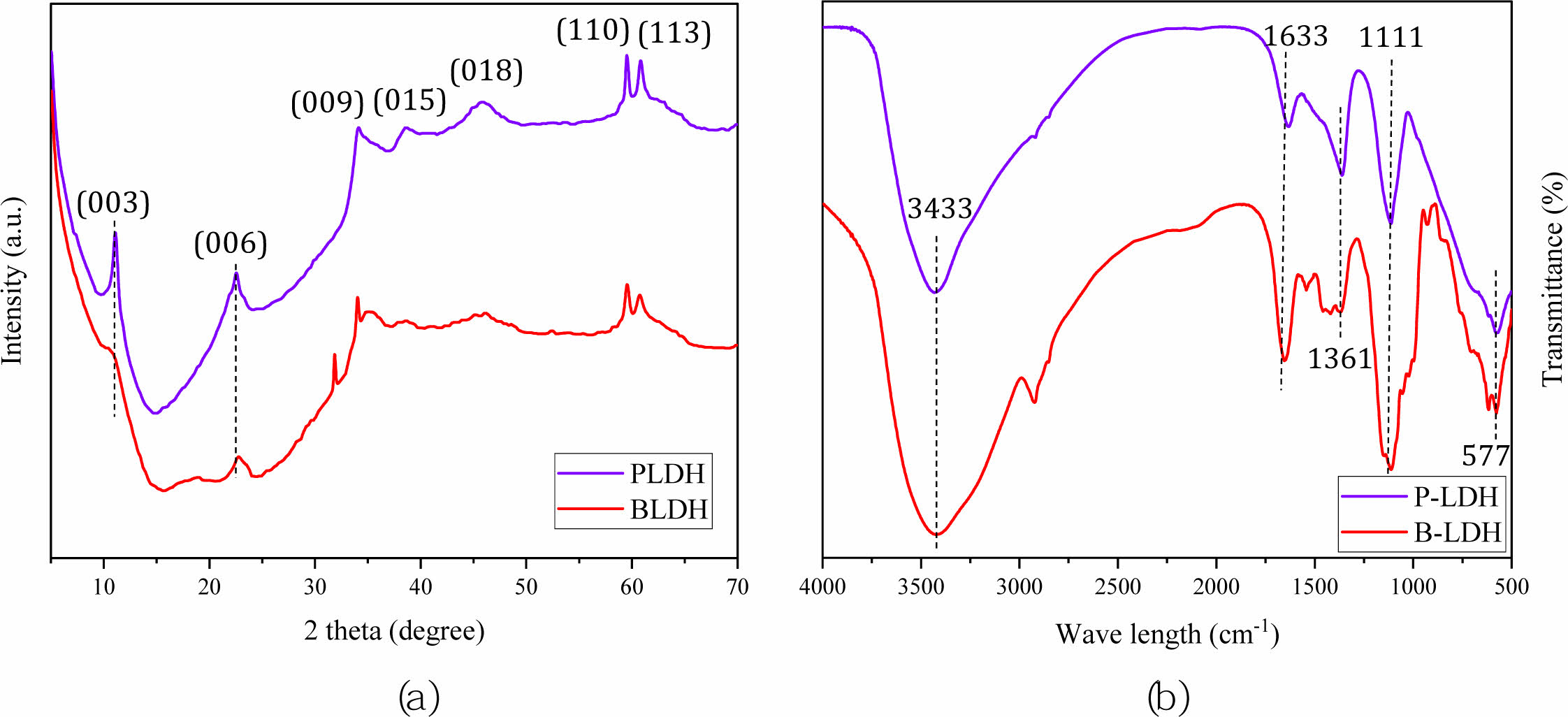
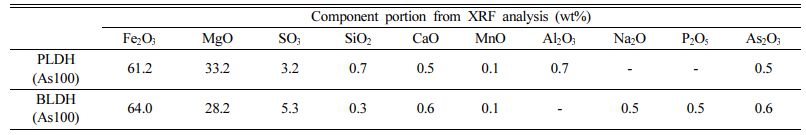
안정화제의 광물학적 특성을 규명하기 위하여, XRD와 XRF 분석을 수행하였다. XRD 분석결과를 Fig. 6a에 나타내었다. 두 안정화제의 XRD 분석결과, (003), (006), (009), (015), (018), (110), (113)과 같은 피크를 가지는(Jiang et al., 2015; Kang et al., 2013), 일반적인 LDH의 광물학적 특징을 보이는 것을 확인하였다(Jatav et al., 2016). XRF 분석결과, 본 연구에서 사용한 LDH는 철과 마그네슘을 다량 함유하는 Mg-Fe LDH인 것을 확인하였다(Table 3). 철산화물이 존재하는 경우, 철산화물과 As 산화음이온(arsenate) 사이의 리간드 교환에 의해 complex가 형성되며 As 산화음이온이 고정되는 것으로 알려져있다(Fendorf et al., 1997; Kim et al., 2003). Mg-Fe LDH 성분 중 철산화물의 존재를 통해, LDH 표면에 As 산화음이온의 고정을 예상할 수 있다. LDH가 실제 오염부지에 적용 가능한 안정화제인지 검증하기 위하여 수행한 독성용출실험 결과들을 Table 4에 나타내었다. 두 종류 안정화제의 TCLP와 SPLP 분석결과, 모두 중금속 용출기준 이하를 나타내어 Mg-Fe LDH 자체는 안정화제로서 오염 토양에 적용할 수 있을 것으로 판단되었다.
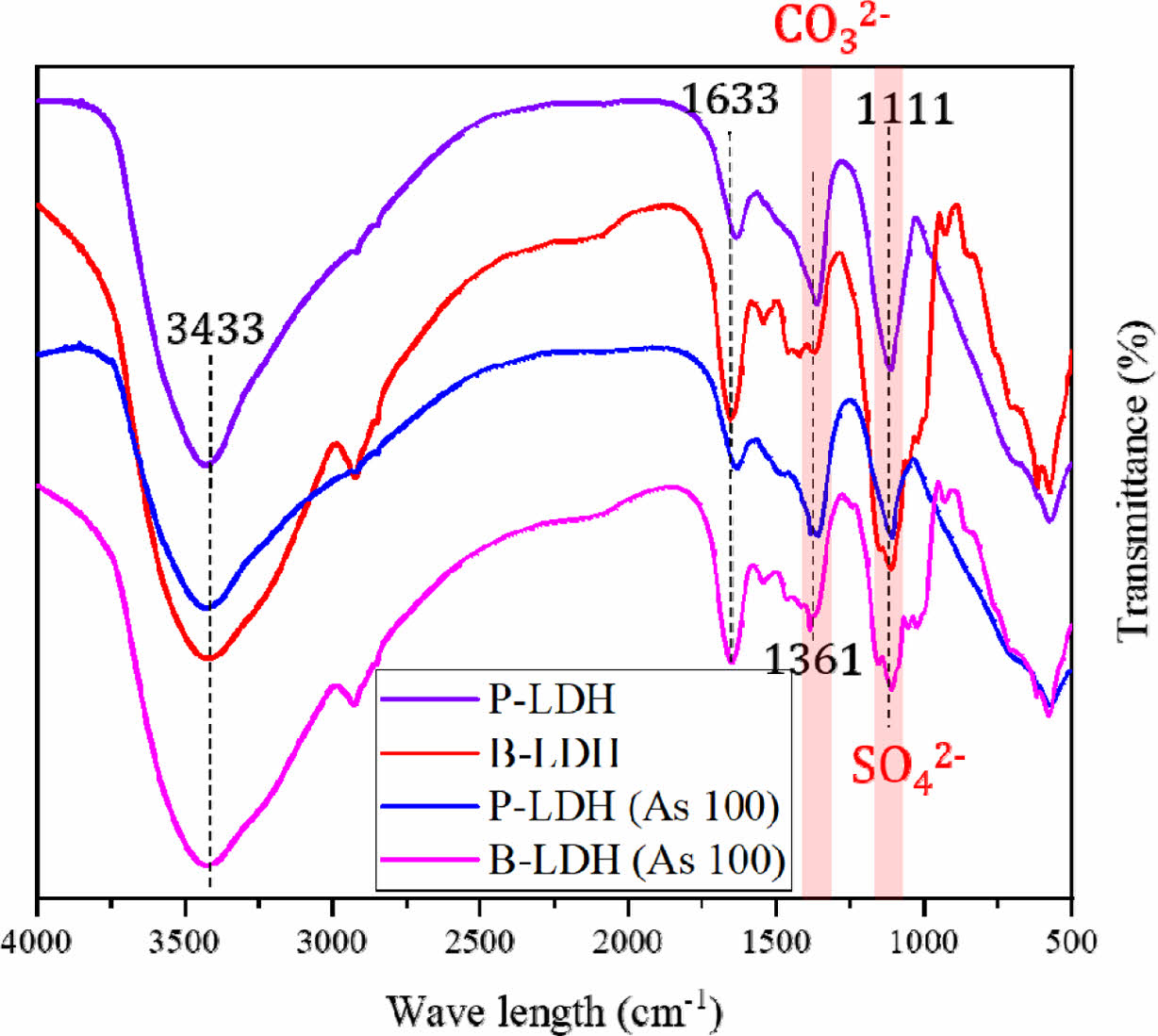
안정화제의 As 고정을 유도할 수 있는 작용기의 유무를 규명하여 As 안정화제로서의 가능성을 평가하기 위하여 수행한 FT-IR 분석결과를 Fig. 6b에 나타내었다. 두 종류의 LDH 분석에서 나타나는 3500~3300 cm-1와 1633 cm-1 파장에서의 피크는 LDH 층간 물분자의 O-H기와 H-O-H기 존재를 의미하며(Kang et al., 2013; Zhang et al., 2013), 1361 cm-1와 1111 cm-1 피크는 각각 층간에 존재하는 탄산염이온(CO32-)과 황산염이온(SO42-)을 의미한다(Wang et al., 2020; Zhang et al., 2007; Zhang et al., 2015). 800~500 cm-1에 존재하는 피크는 M-O와 M-OH기를 의미하며, 여기서 M은 2가 마그네슘이온(Mg2+)과 3가 철이온(Fe3+)의 피크이다(Guo et al., 2012; Zhang et al., 2015). XRD와 FT-IR 분석결과로부터 수용액 내 존재하는 As 산화음이온(arsenate; H2AsO4- or HAsO42-)이 LDH 층간에 존재하는 CO32-와 SO42-와의 이온교환반응을 통하여, LDH에 고정될 수 있을 것으로 판단되었다(Kang et al., 2013; Wang et al., 2021). 이러한 음이온 교환반응에 의한 LDH의 As 고정 기작은 3.5 부분에서 추가로 설명하였다.
3.2. 회분식 As 수착실험 결과
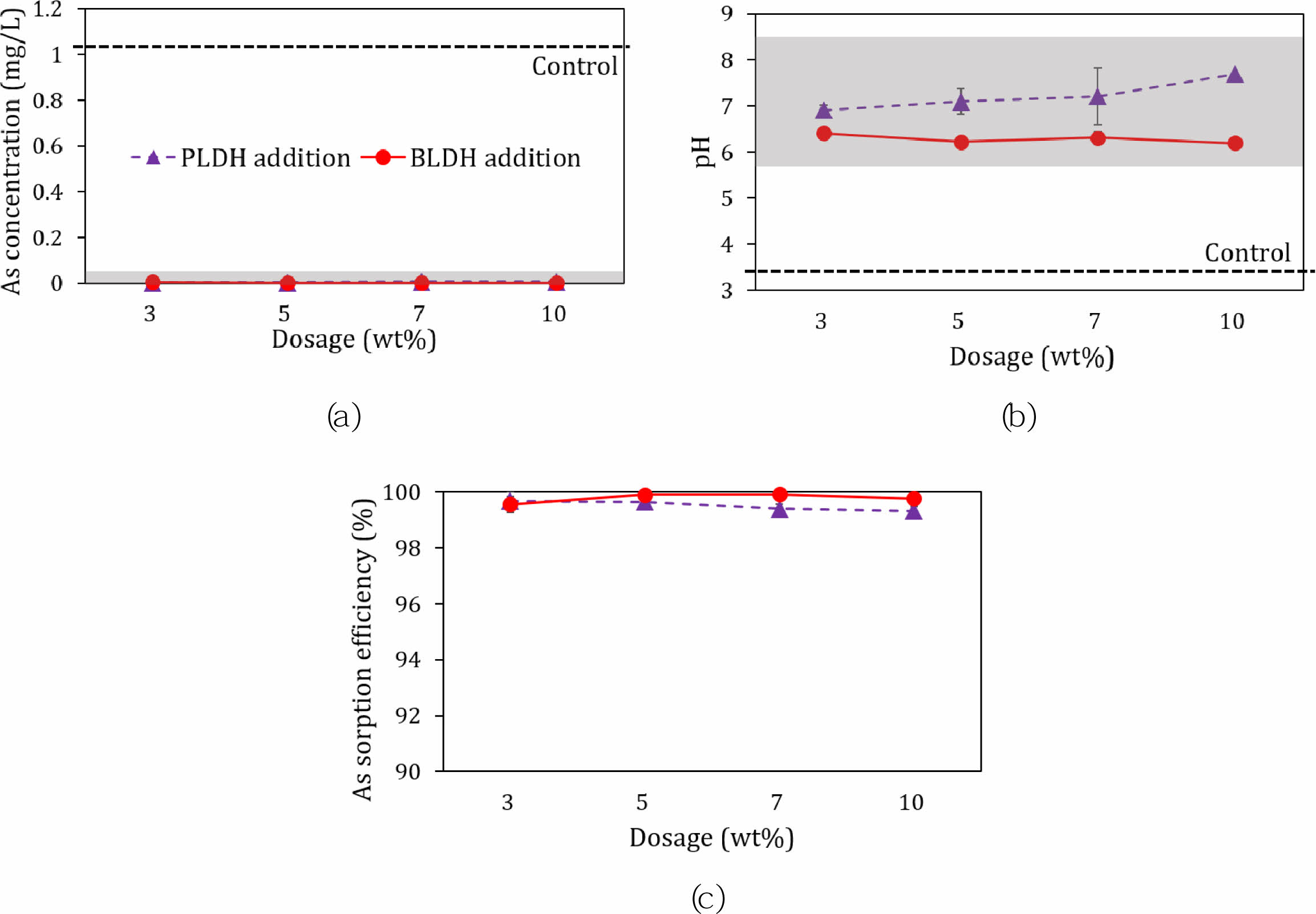
두 종류의 안정화제를 제조하여 사용하는 경우 안정화제의 As 수착능력을 규명하는 회분식 수착실험 결과(초기 As 농도: 1 mg/L; LDH 안정화제 첨가량: 0, 3, 5, 7, 10%; 수착 반응시간: 2시간; 정치시간: 24시간)를 Fig. 7에 나타내었다. 안정화제를 첨가한 경우, 안정화제를 첨가하지 않은 대조구(control)에 비해 수용액의 As 농도와 pH 범위는 각각 <0.01 mg/L와 6.2~7.7로 나타나(Fig. 7a, 7b), 반응 전 수용액의 As 초기농도가 1 mg/L인 경우에도 LDH 첨가에 의해 국내 지하수 수질기준 중 생활용수 기준(As 농도: <0.05 mg/L; pH범위: 5.8~8.5)을 만족하였다(MOE, 2021). As 수착효율은 두 종류의 LDH에서 모두 99% 이상을 보여(Fig. 7c), PLDH와 BLDH 모두 As를 고정시키는 안정화제로써 사용 가능성이 높은 것으로 밝혀졌다.
3.3. 회분식 As 용출실험 결과
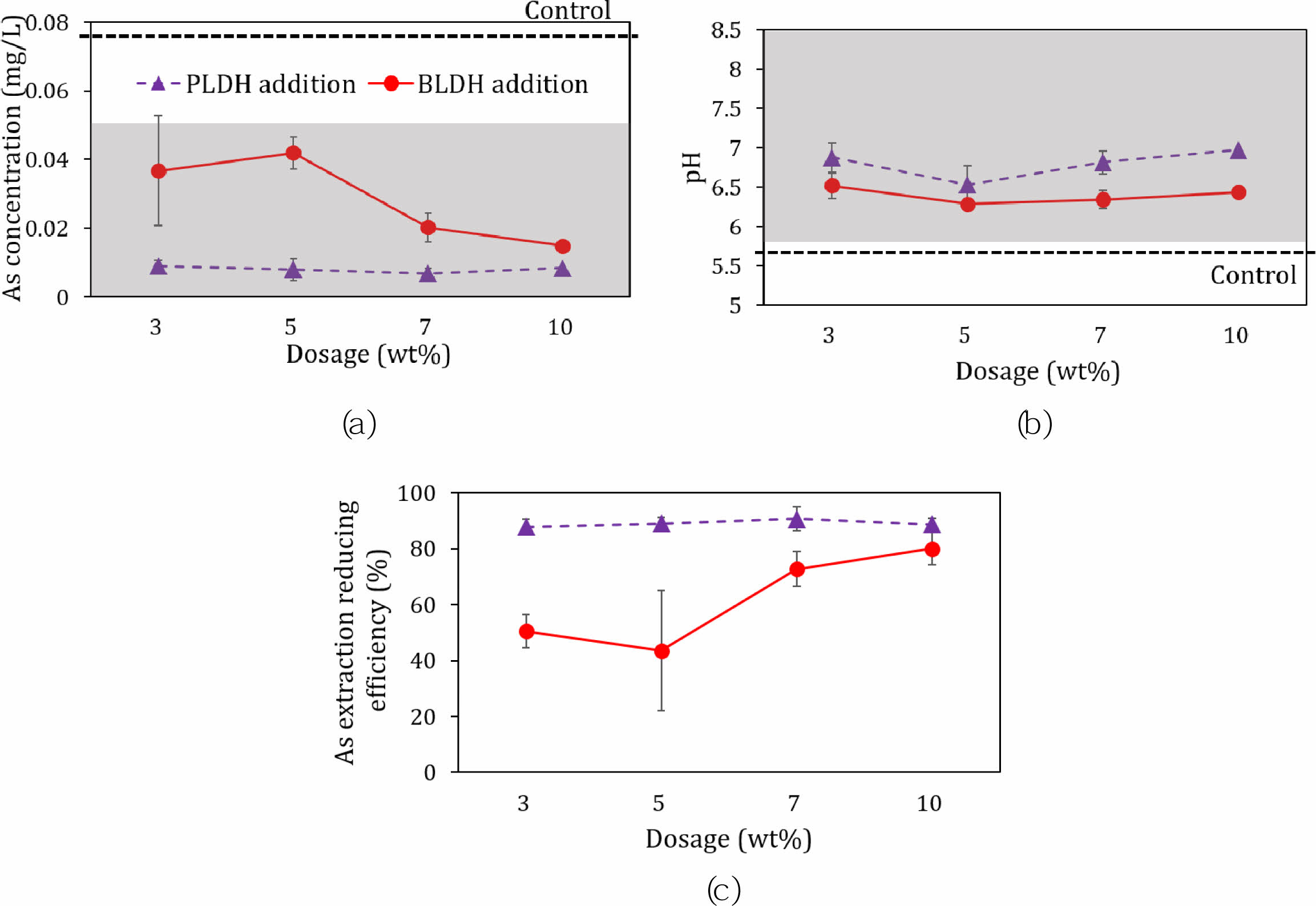
실제오염토양에 PLDH와 BLDH를 적용 시, As 안정화 효과가 있는지 규명하는 회분식 용출실험 결과(토양시료 첨가량: 50 g; LDH 안정화제 첨가량: 0, 3, 5, 7, 10%; 반응시간: 2시간; 정치시간: 24시간)를 Fig. 8에 나타내었다. PLDH와 BLDH를 첨가한 경우, 용출액 내 As 농도가 각각 <0.01 mg/L와 <0.05 mg/L로 대조구의 As 용출농도보다 낮게 유지되었으며(Fig. 8a), 안정화제 첨가 후 용출액의 pH 범위는 6.5~7.0과 6.3~6.5로 나타나, 지하수 생활용수기준을 만족하였다(Fig. 8b). Fig. 8c는 As로 오염된 토양시료에 안정화제를 적용하였을 때의 As 용출저감효율을 보여주는데, 분말상인 PLDH를 적용한 경우에 As 용출저감효율이 88% 이상으로 높게 나타났으며, 입상인 BLDH의 경우에도 첨가량이 7% 이상인 경우 저감효율이 72% 이상으로 높게 나타났다. 회분식 용출실험 결과 As 오염토양시료에 대하여 PLDH는 3% 이상, BLDH는 7% 이상 첨가하는 경우 높은 As 안정화효율을 유지할 수 있을 것으로 기대된다.
3.4. 연속컬럼실험 결과
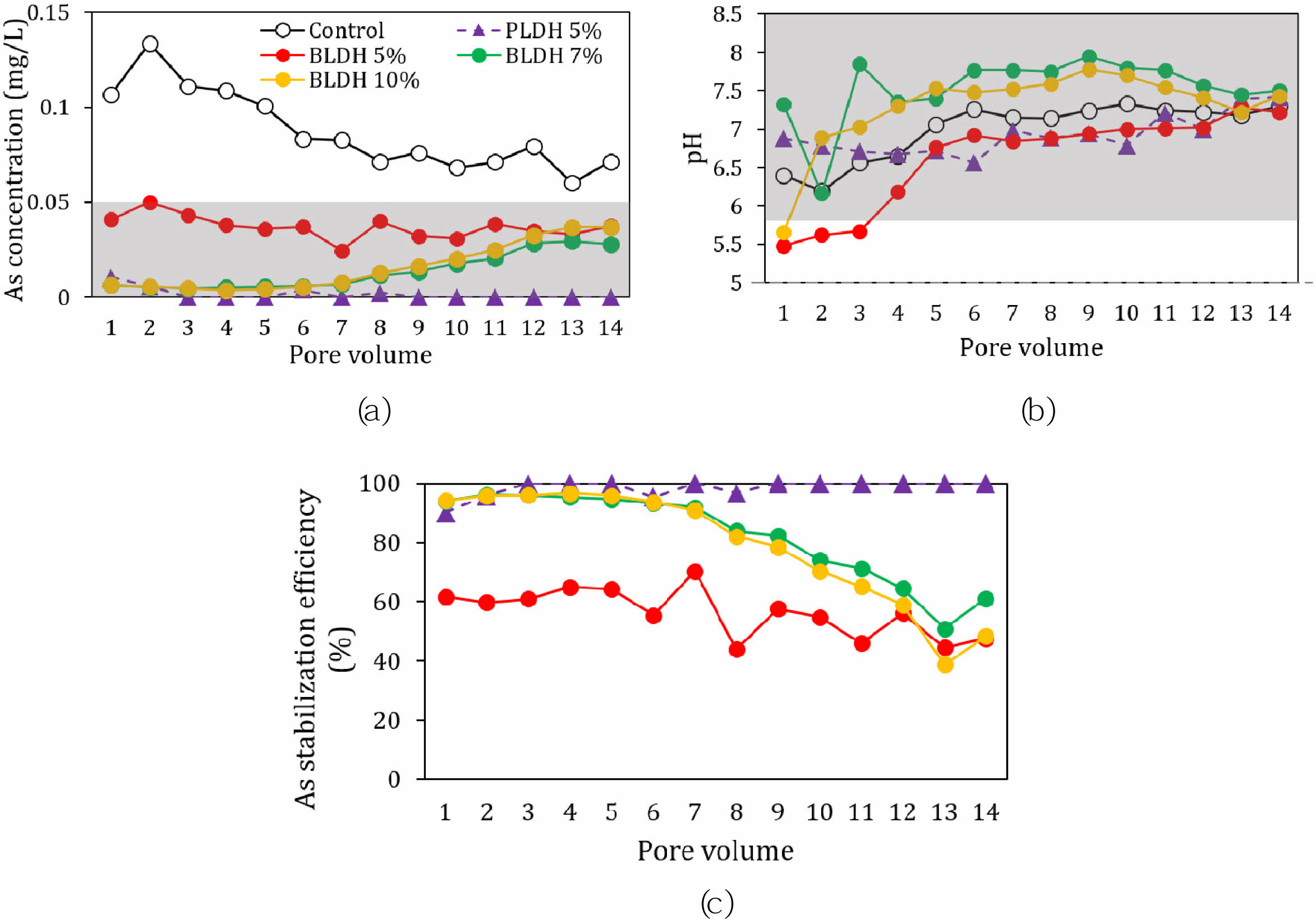
토양에 LDH 안정화제를 첨가한 이후에 비평형상태 반응조건에서 토양 내 As의 이동성과 안정화 효율을 규명하기 위하여, 연속컬럼실험(오염 토양에 대한 BLDH 첨가량: 5, 7, 10%)을 수행하였다. 컬럼상부로부터 배출된 용출액의 As 농도로부터 계산한 처리수량(pore volume: ‘공극체적’으로 표기)에 따른 As 안정화효율을 정리하여 Fig. 9에 나타내었다. 안정화제를 첨가하지 않은 대조구 컬럼(control)의 경우 컬럼 유출수의 As 농도가 0.06~0.13 mg/L으로 지하수 생활용수기준보다 높았으나, LDH를 첨가한 경우 컬럼 유출수의 As 농도는 대조구 컬럼보다 뚜렷이 감소하였다(Fig. 9a). 오염토양시료에 PLDH를 5% 첨가한 경우 유출수의 As 농도가 0.01 mg/L 이하로 검출되었으며(Fig. 9a), pH 범위는 6.6~7.5로 나타났고(Fig. 9b), 실험과정 동안 안정화효율은 95% 이상으로 높게 유지되었다(Fig. 9c). 오염토양 시료에 BLDH를 5% 첨가한 경우, 용출액 내 As 농도는 0.05 mg/L 이하로 검출되었으며(Fig. 9a) pH 범위는 5.5~7.3으로 나타났다(Fig. 9b). 실험 초기에는 대략 60%의 안정화효율을 보이며, 10 공극체적 이후에는 45%로 안정화효율이 감소하였다(Fig. 9c). BLDH를 7%와 10% 첨가한 경우, As 농도와 pH 범위가 생활용수기준(As 농도: <0.05 mg/L; pH범위: 5.8~8.5)을 만족하며(Fig. 9a, 9b), 7 공극체적(평균강수량기준 21개월)까지 91% 이상의 안정화효율을 유지하다가 8 공극체적(평균강수량기준 24개월) 이후에는 60%를 유지하였다(Fig. 9c). 비평형상태에서도 오염토양에 BLDH를 7% 이상 첨가한 경우, 7 공극체적(21개월)까지 91% 이상의 효율을 유지하며, 12 공극체적(36개월)까지 64%의 안정화 효율을 유지하는것으로 보아, 입상인 BLDH를 7% 이상 첨가하면 장기간 동안 As 안정화효과가 있을 것으로 판단되었다.
3.5. LDH의 As 고정기작 규명을 위한 회분식 수착실험
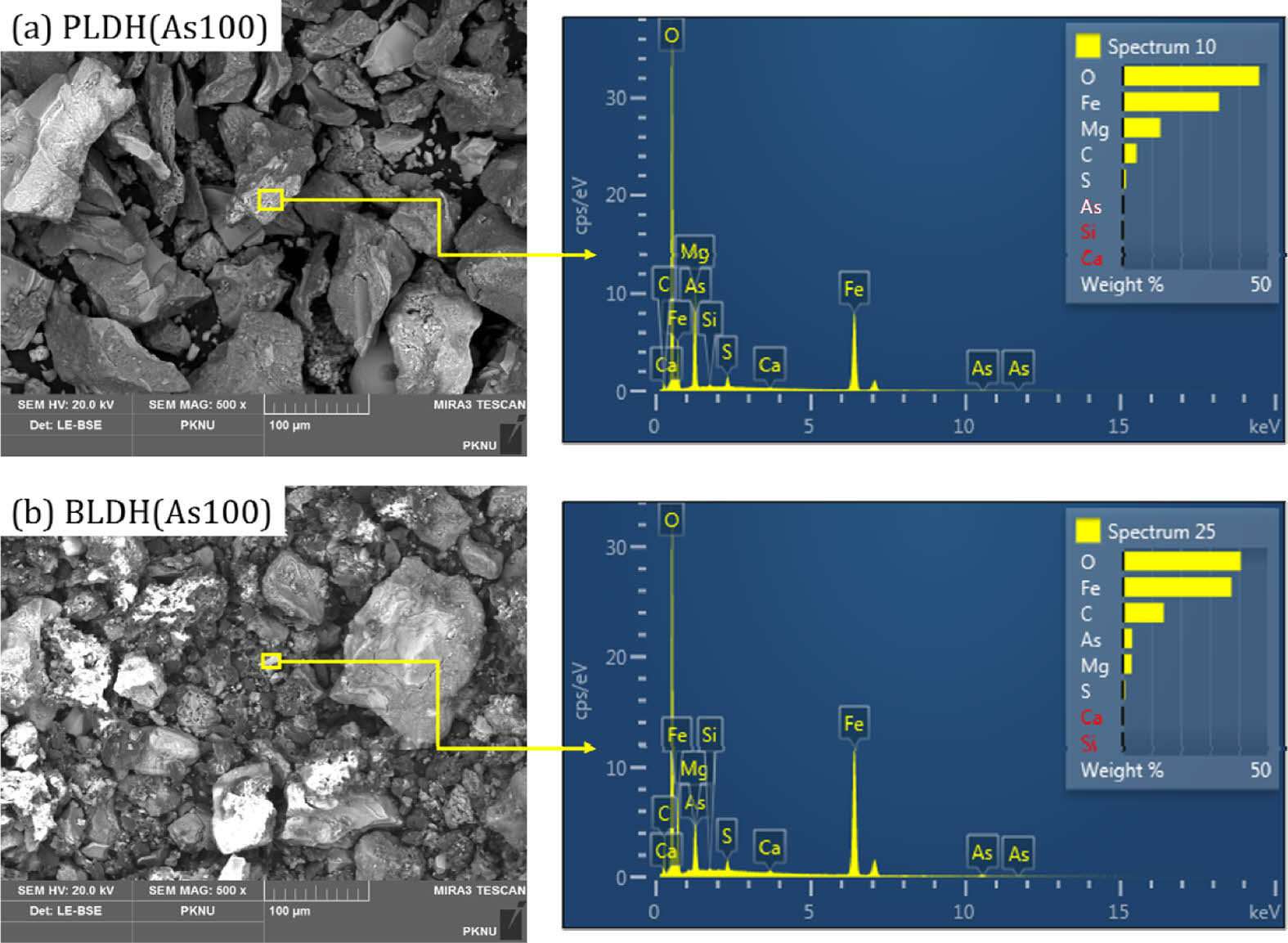
안정화제에 As가 어떤 기작으로 고정되었는지를 알아보기 위하여, 회분식 As 수착실험 후 LDH에 대하여 XRF분석을 수행한 결과를 Table 5에 나타내었다. As와 반응 후 두 LDH 안정화제 모두 황화합물의 함량이 감소하였으며, 대신 As 화합물이 검출되었다(Table 3과 Table 5 비교). 이는 LDH가 첨가된 토양-수용액 반응에서 As 산화음이온(H2AsO4- or HAsO42-)과 LDH 층간에 존재하는 황산염이온(SO42-)과의 이온교환의 결과로 판단된다. 이온교환 외에 As가 LDH 표면에 흡착되었는지를 규명하기 위하여 As와 LDH 반응 후 LDH 입자의 EDS 분석을 수행한 결과를 Fig. 10에 나타내었다. 두 LDH 표면에서 모두 As가 검출되었으며, 이를 통해 LDH의 철산화물과 As 산화음이온(arsenate) 사이의 리간드 교환에 의해 complex가 형성되어 LDH 표면에 As 산화음이온이 고정되는 것으로 판단되었다.
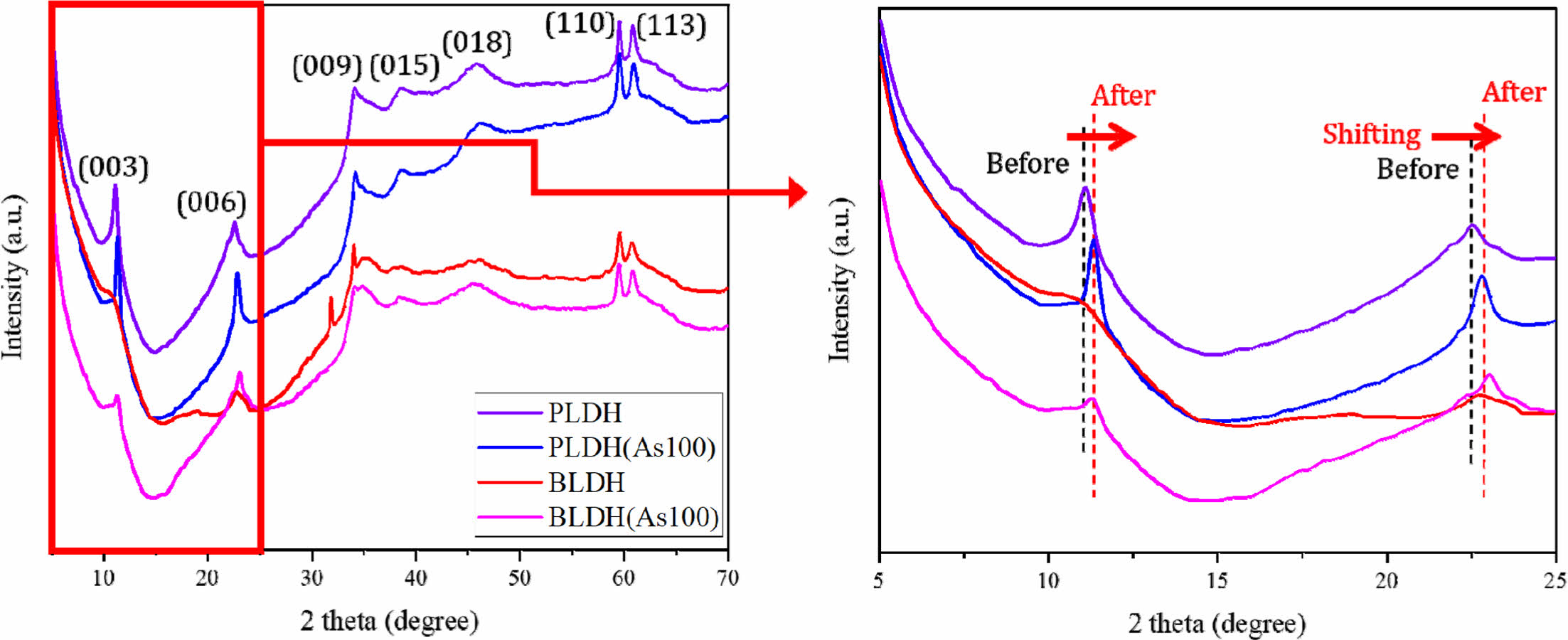
100 mg/L 농도의 As 수용액과 반응시키기 전과 후, 두 안정화제의 XRD 분석결과를 비교하여 Fig. 11에 나타내었다. (003)과 (006) 피크의 위치가 As 수용액과의 반응 후 오른쪽으로 이동한 것을 볼 수 있는데, 이러한 피크의 이동현상(peak shifting)을 통해 As와 LDH 반응에 의한 LDH의 구조적 변화를 유추할 수 있다(Jung et al., 2021).
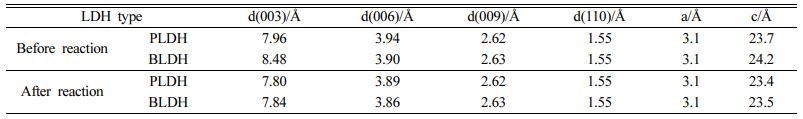
As 수용액과 반응 후 LDH 층간거리의 변화를 규명하기 위하여 XRD 분석결과를 활용하여 격자상수(lattice parameter)를 계산하였다. 격자상수 a와 c는 각각 양이온-양이온 간의 거리와 d-spacing을 의미하며, (003), (006), (009), (110) 피크의 값을 활용하여 계산이 가능하다(Hudcová et al., 2017; Paikaray et al., 2013). 격자상수 값을 계산하는 공식을 식(3)과 식(4)에 나타내었다.
격자상수 a = 2d (110) (3)
격자상수 c = d (003) + 2d (006) + 3d (009) (4)
위 식들로부터 격자상수 값을 계산 결과를 Table 6에 나타내었다. As 수용액과 반응 전/후에 LDH 격자상수 a값의 변화는 거의 없었으며, 이를 통해 브루사이트계열 층의 양이온-양이온 간의 거리는 변화가 없었음을 알 수 있었다(Kang et al., 2013). 반면에 As 수용액과 반응 후 LDH 격자상수 c값이 감소하였으며, 격자상수 c값은 양전하를 띠는 브루사이트계열의 층 간격을 나타내며, 층간 영역의 특성에 영향을 끼치는 수화도, 층사이에 존재하는 음이온, 금속 양이온의 전하, 정전기반응(electrostatic inter- action) 등에 의해 변하는 것으로 알려져 있다(Cavani et al., 1991). 이러한 격자상수 c값의 감소로부터 As 반응 후 LDH 층의 d-spacing이 감소하였음을 알 수 있었으며, 이러한 d-spacing의 변화로부터 As 수용액과의 반응 과정 동안 LDH 층간에 존재하던 기존 음이온들인 탄산염이온(CO32-), 황산염이온(SO42-)과 As 산화음이온(H2AsO4- or HAsO42-) 간의 음이온 교환이 발생하였음을 유출할 수 있었다(Jung et al., 2021). 이러한 XRD 분석 결과들을 비교함으로써, LDH 층 간에 존재하는 CO32-와 SO42-를 대신하여 As 산화음이온(arsenate)의 음이온교환에 의해 As가 LDH에 고정되는 것을 확인할 수 있었다.
As 수용액과 반응 전/후 LDH의 FT-IR 분석결과를 Fig. 12에 나타내었다. As 반응 후 두 LDH에서 FT-IR 스펙트라가 변화가 발생하였는데, 두 안정화제 모두에서 특정 피크의 intensity가 감소하였으며, 이를 통해 As 100 mg/L와 반응 후 LDH의 구조적 변화가 발생한 것을 알 수 있었다. As 수용액과 반응 후 LDH 층간에 존재하는 탄산염이온(CO32-)과 황산염이온(SO42-)을 의미하는 1361 cm-1와 1111 cm-1 피크 intensity가 감소하였으며(Wang et al., 2020; Zhang et al., 2007), 이를 통해 As 반응 동안 음이온교환이 발생하여 As 산화음이온(H2AsO4- or HAsO42-)이 LDH 층간에 존재하는 음이온을 대체하면서 탄산염이온(CO32-)과 황산염이온(SO42-)이 층 사이로부터 빠져나온 것으로 판단되었으며(Hudcová et al., 2017; Wang et al., 2021), 이러한 결과는 반응 전/후 XRF 주 성분 분석 결과와도 일치한다(Table 3과 Table 5 참조). FT-IR 분석결과로부터, As 100 mg/L와 반응 후 BLDH와 PLDH 모두 LDH 기존 층간 음이온의 피크 intensity가 감소한 것을 통해, PLDH 뿐 아니라 입상인 BLDH에서도 LDH 층 사이에 고정된 기존 음이온과 As 산화음이온의 이온교환이 활발하게 발생했음을 알 수 있었다.
|
Fig. 6 XRD (a) and FT-IR (b) analysis results of the PLDH (violet color) and the BLDH (red color). |
|
Fig. 7 The As sorption for the LDHs vs. the LDH dosage (the As concentration (mg/L) in solution (a), the pH of the solution (b), and the As sorption efficiency of LDH after the LDH addition (c). The grey hatched box range represents the municipal groundwater tolerance limit. |
|
Fig. 8 Results of stabilization experiment with different LDH dosages (the As concentration (mg/L) in the extracted solution (a), the pH of the extracted solution (b), and the As extraction reducing efficiency (c). The grey hatched box range represents the municipal groundwater tolerance limit. |
|
Fig. 9 Results of continuous column experiments with different LDH dosages (the As concentration (mg/L) in the effluent solution (a), the pH of the effluent solution (b), and the stabilization efficiency (c). The grey hatched box range represents the municipal water tolerance limit. |
|
Fig. 10 SEM images at 500× magnification and EDS results of the PLDH (a) and the BLDH (b) after reaction with As of 100 mg/L. |
|
Fig. 11 XRD patterns’ shifting of PLDH and BLDH after reaction with 100 mg/L of As. |
|
Fig. 12 FT-IR analysis results of PLDH and BLDH after a reaction with As of 100 mg/L. |
|
Table 5 XRF analysis results of the PLDH and the BLDH after reaction with As of 100 mg/L |
|
Table 6 Values of the d-spacing and lattice parameters for PLDH and BLDH before and after reaction with As of 100 mg/L |
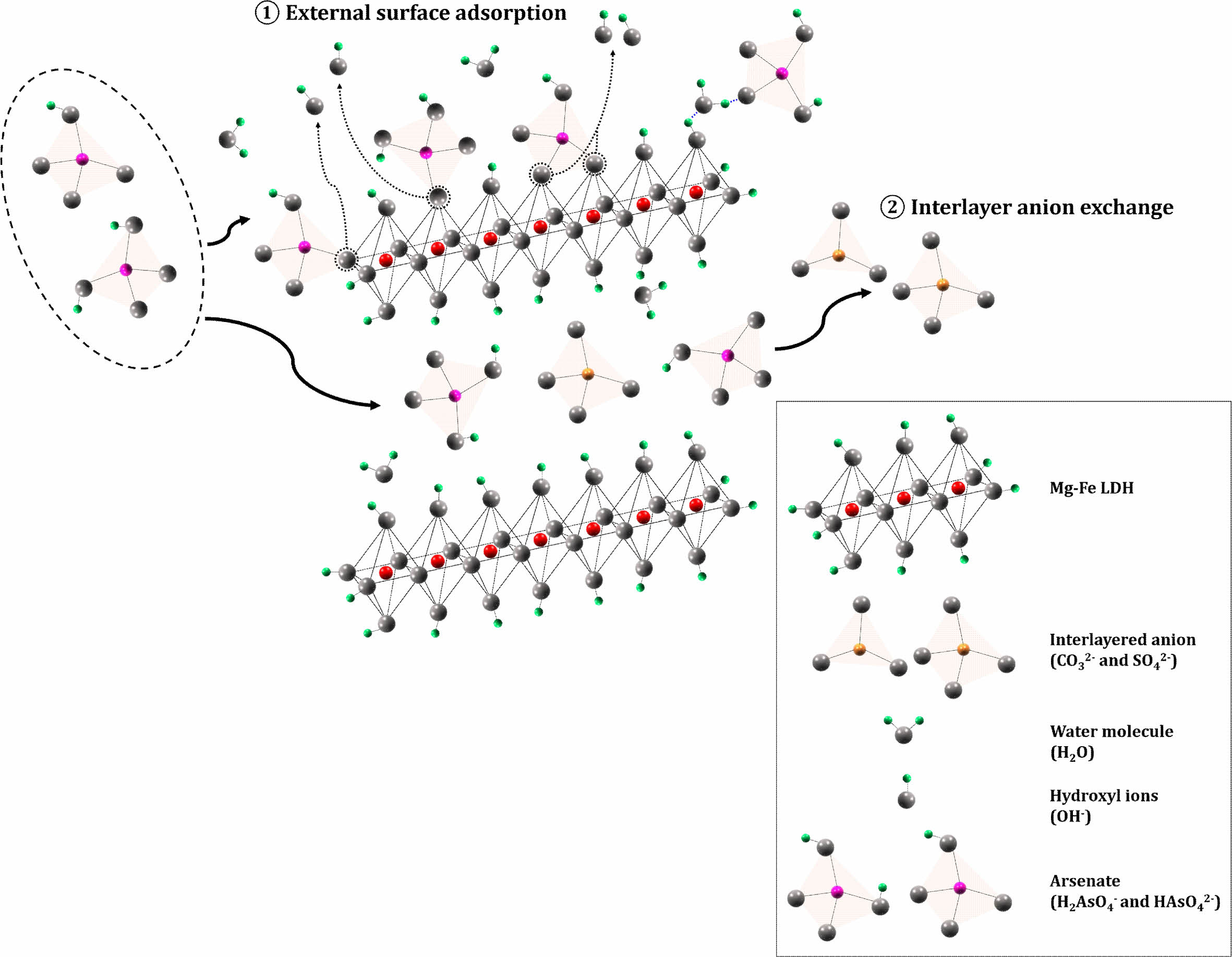
본 연구에서는 다양한 분석과 회분식 실험 및 연속컬럼실험을 통해 As 오염토양에 대한 입상 BLDH의 토양 안정화제로써 사용 가능성을 정량적으로 입증하였다. As 1 mg/L 수용액을 사용하여 회분식 수착실험을 수행한 결과, PLDH와 BLDH 모두 제거효율이 99% 이상으로 나타나, 안정화제로써 사용이 가능한 것으로 판단되었다. 실제 As 오염토양 시료를 사용하여 회분식 As 용출실험을 수행한 결과, 용출저감효율이 PLDH의 경우 87% 이상으로 나타났으며 BLDH는 첨가량이 7% 이상인 경우 80%로 나타나 BLDH가 실제 As 오염토양에 안정화제로써 적용 가능성이 있는 것으로 밝혀졌다. 실제 강수량을 고려하여 3년의 용출 기간을 모사하여 수행한 연속컬럼실험 결과, BLDH의 첨가량이 7% 이상인 경우 As 안정화효율이 2년의 모사기간까지 91%를 유지하였으며, 3년 이후 용출수의 As 농도와 pH 범위도 지하수 생활용수기준(As 농도: <0.05 mg/L; pH범위: 5.8~8.5)을 만족하였다. 실험 결과들로부터 본 연구를 통해 개발한 입상의 BLDH는 토양 내 As를 고정시키는 토양 안정화제로써 사용이 가능할 것으로 기대된다. 본 연구를 통해 As가 LDH에 고정되는 대표적인 기작이 표면흡착과 층간에 존재하는 음이온교환임을 입증하였으며, 이러한 결과는 일부 선행 연구결과들과도 일치한다(Jung et al., 2021; Luengo et al., 2017; Wang et al., 2018; Yang et al., 2021b). 본 연구에서 제조한 Mg-Fe LDH에 대한 As의 고정기작을 Fig.13에 모식도로 나타내었다. 본 연구에서 XRD와 FT-IR 분석결과를 통해, 안정화 과정 동안 표면흡착과 LDH 층간 음이온(CO32-와 SO42-)과의 음이온교환이 발생하여 As 산화음이온(H2AsO4- or HAsO42-)이 LDH에 고정되는 것을 확인하였다. 본 연구를 통해 개발한 입상 BLDH는 기존의 분말상의 LDH와 유사하며 As 안정화효율이 높고, 내구성이 강해 다루기 쉬우며, 실제 오염부지에 적용 시 분진의 우려가 적고 지속성이 뛰어나기 때문에, 도심지나 주거지역 부근 등 다양한 As 오염부지에 적용하기에 큰 장점이 있을 것으로 판단된다.
|
Fig. 13 Schematic illustration of two stabilization mechanisms (① external surface adsorption and ② interlayer anion exchange) for As on the Mg-Fe LDH. |
이 논문은 2021년도 부경대학교 자율창의연구비(2021년)의 지원을 받아 연구되었습니다. 본 논문을 세심하게 심사하여 주신 심사자들께 감사드립니다.
- 1. Cavani, F., Trifirò, F., and Vaccari, A., 1991, Hydrotalcite-type anionic clays: Preparation, properties and applications, Catal. Today, 11(2), 173-301.
-

- 2. Choong, C.E., Wong, K.T., Jang, S.B., Saravanan, P., Park, C., Kim, S.H., Jeon, B.H., Choi, J., Yoon, Y., and Jang, M., 2021, Granular Mg-Fe layered double hydroxide prepared using dual polymers: Insights into synergistic removal of As(III) and As(V), J. Hazard. Mater., 403, 123883.
-

- 3. Fendorf, S., Eick, M.J., Grossl, P., and Sparks, D.L., 1997, Arsenate and Chromate Retention Mechanisms on Goethite. 1. Surface Structure, Environ. Sci. Technol., 31(2), 315-320.
-

- 4. Goh, K.H., Lim, T.T., and Dong, Z., 2008, Application of layered double hydroxides for removal of oxyanions: A review, Water Res., 42(6-7), 1343-1368.
-

- 5. Guo, Y., Zhu, Z., Qiu, Y., and, Zhao, J., 2012, Adsorption of arsenate on Cu/Mg/Fe/La layered double hydroxide from aqueous solutions, J. Hazard. Mater., 239-240, 279-288.
-

- 6. Ha, H.N.N., Phuong, N.T.K., An, T.B., Tho, N.T.M., Thang, T.N., Minh, B.Q., and Du, C.V., 2016, Arsenate removal by layered double hydroxides embedded into spherical polymer beads: Batch and column studies, J. Environ. Sci. Health, Part A-Toxic/Hazard. Subst. Environ. Eng., 51(5), 403-413.
-

- 7. Hudcová, B., Veselská, V., Filip, J., Číhalová, S., and Komárek, M., 2017, Sorption mechanisms of arsenate on Mg-Fe layered double hydroxides: A combination of adsorption modeling and solid state analysis, Chemosphere, 168, 539-548.
-

- 8. Hudcová, B., Veselská, V., Filip, J., Číhalová, S., and Komárek, M., 2018, Highly effective Zn(II) and Pb(II) removal from aqueous solutions using Mg-Fe layered double hydroxides: Comprehensive adsorption modeling coupled with solid state analyses, J. Clean. Prod., 171, 944-953.
-

- 9. ISO (International Organization for Standardization), 2019, Soil quality-Leaching procedures for subsequent chemical and ecotoxicological testing of soil and soil-like materials-Part 3: Up-flow percolation test, 21268-3.
-

- 10. Jatav, J., Jatav, R., Bhardwaj, S.K., Sahu, P.K., and Kumar, K., 2016, Synthesis and characterization of hydrotalcites, J. Chem. Pharm. Res., 8(2), 678-696.
- 11. Jiang, J.Q., Ashekuzzaman, S.M., Hargreaves, J.S.J., McFarlane, A.R., Badruzzaman, A.B.M., and Tarek, M.H., 2015, Removal of Arsenic (III) from groundwater applying a reusable Mg-Fe-Cl layered double hydroxide, J. Chem. Technol. Biotechnol., 90(6), 1160-1166.
-

- 12. Jo, J.Y., Choi, J.H., Tsang, Y.F., and Baek, K., 2021, Pelletized adsorbent of alum sludge and bentonite for removal of arsenic, Environ. Pollut., 277, 116747.
-

- 13. Jung, K.W, Lee, S.Y, Choi, J.W, Hwang, M.J., and Shim, W.G., 2021, Synthesis of Mg–Al layered double hydroxides-functionalized hydrochar composite via an in situ one-pot hydrothermal method for arsenate and phosphate removal: Structural characterization and adsorption performance, Chem. Eng. J., 420(1), 129775.
-

- 14. Kang, D., Yu, X., Tong, S., Ge, M., Zuo, J., Cao, C., and Song, W., 2013, Performance and mechanism of Mg/Fe layered double hydroxides for fluoride and arsenate removal from aqueous solution, Chem. Eng. J., 228, 731-740.
-

- 15. Kim, M.J., An, G.H., and Jeong, Y.J., 2003, Adsorption of Arsenic on Soil: Kinetics and Equilibrium, J. Korean Soc. Environ. Eng., 25(4), 407-407.
- 16. KIPO (Korean Intellectual Property Office), 2018, Korea Patent No. 10-1890910.
- 17. Koilraj, P. and Sasaki, K., 2016, Fe3O4/MgAl-NO3 layered double hydroxide as a magnetically separable sorbent for the remediation of aqueous phosphate, J. Environ. Chem. Eng., 4(1), 984-991.
-

- 18. Lee, J.Y., Lee, M., and Yu, M., 2016, Draft Guideline Matching the Treatment Technology to the Soil Contaminated Site Based on the Site Properties in Korea, J. Soil Groundw. Environ., 21(6), 1-13.
-

- 19. Li, S., Ma, X., Ma, Z., Dong, X., Wei, Z., Liu, X., and Zhu, L., 2021, Mg/Al-layered double hydroxide modified biochar for simultaneous removal phosphate and nitrate from aqueous solution, Environ. Technol. Innov., 23, 101771.
-

- 20. Luengo, C.V., Volpe, M.A., and Avena, M.J., 2017, High sorption of phosphate on Mg-Al layered double hydroxides: Kinetics and equilibrium, J. Environ. Chem. Eng., 5(5), 4656-4662.
-

- 21. Mills, S.J., Christy, A.G., Génin, J.M.R., Kameda, T., and Colombo, F., 2012, Nomenclature of the hydrotalcite supergroup: natural layered double hydroxides, Mineral. Mag., 76(5), 1289-1336.
-

- 22. MOE (Ministry of Environment), 2007, Contaminated soil purification method guideline, 11-1480000-000841-01.
- 23. MOE (Ministry of Environment), 2021, Groundwater Act. No. 17850.
- 24. NIER (National Institute of Environmental Research), 2018, Korean ministry of environment standard, 2018-53.
- 25. Nriagu, J.O., Bhattacharya, P., Mukherjee, A.B., Bundschuh, J., Zevenhoven, R., and Loeppert, R.H., 2007, Arsenic in soil and groundwater: an overview, Trace Metals and other Contaminants in the Environment, 9, 3-60.
-

- 26. Otgonjargal E., Kim, Y.S., Park, S.M., Baek, K., and Yang, J.S., 2012, Mn–Fe Layered Double Hydroxides for Adsorption of As(III) and As(V), Sep. Sci. Technol., 47(14-15), 2192-2198.
-

- 27. Paikaray, S., Hendry, M.J., and Essilfie-Dughan, J., 2013, Controls on arsenate, molybdate, and selenate uptake by hydrotalcite-like layered double hydroxides, Chem. Geol., 345, 130-138.
-

- 28. Park, J.H., Choi, H.I., and Yang, I.J., 2018, Mine Tailings Characteristics with a View of Prevention of Tailings Dam Failure, J. Korean Soc. Miner. Energy Resour. Eng., 55(4), 354-363.
-

- 29. Prasanna, S.V. and Kamath P.V., 2009, Synthesis and characterization of arsenate-intercalated layered double hydroxides (LDHs): Prospects for arsenic mineralization, J. Colloid Interf. Sci., 331(2), 439-445.
-

- 30. USEPA (U. S. Environmental Protection Agency), 1992, SW-846 Test Method 1311: Toxicity Characteristic Leaching Procedure.
- 31. USEPA (U. S. Environmental Protection Agency), 1994, SW-846 Test Method 1312: Synthetic Precipitation Leaching Procedure.
- 32. USEPA (U. S. Environmental Protection Agency), 2002, Arsenic Treatment Technologies for Soil, Waste, and Water, 5102G, EPA-542-R-02-004.
- 33. USEPA (U. S. Environmental Protection Agency), 2007, Treatment Technologies for Site Cleanup: Annual Status Report, Twelfth Edition, 5203P, EPA-542-R-07-012.
- 34. USEPA (U. S. Environmental Protection Agency), 2012, A Citizen's Guide to Solidification and Stabilization, 5102G, EPA-542-F-12-019.
- 35. Wang, J., Zhang, T., Li, M., Yang, Y., Lu, P., Ning, P., and Wang, Q., 2018, Arsenic removal from water/wastewater using layered double hydroxide derived adsorbents, a critical review, RSC Adv., 8(40), 22694-22709.
-

- 36. Wang, Q., Lin, Q., Li, Q., Li, K., Wu, L., Li, S., and Liu, H., 2021, As(III) removal from wastewater and direct stabilization by in-situ formation of Zn-Fe layered double hydroxides, J. Hazard. Mater., 403, 123920.
-

- 37. Wang, S., Liu, C.H., Wang, M.K., Chuang, Y.H., and Chiang, P.N., 2009,. Arsenate adsorption by Mg/Al-NO3 layered double hydroxides with varying the Mg/Al ratio, Appl. Clay Sci., 43(1), 79-85.
-

- 38. Wang, X., Li, Q., Liao, Q., Yan, Y., Xia, J., Lin, Q., Wang, Q., and Liang, Y., 2020, Arsenic(III) biotransformation to tooeleite associated with the oxidation of Fe(II) via Acidithiobacillus ferrooxidans, Chemosphere, 248, 126080.
-

- 39. WHO (World Health Organization), 2019, Preventing disease through healthy environments-Exposure to arsenic: a major public health concern.
- 40. Yang, J., Kim, D., Oh, Y., Jeon, S., and Lee, M., 2021a, Evaluation of Stabilization Capacity for Typical Amendments based on the Scenario of Heavy Metal Contaminated Sites in Korea, Econ. Environ. Geol., 54(1), 21-33.
-

- 41. Yang, X., Kameda, T., Saito, Y., Kumagai, S., and Yoshioka, T., 2021b, Investigation of the mechanism of Cu(II) removal using Mg-Al layered double hydroxide intercalated with carbonate: Equilibrium and pH studies and solid-state analyses, Inorg. Chem. Commu., 132, 108839.
-

- 42. Zhang, H., Wen, X., and Wang, Y., 2007, Synthesis and characterization of sulfate and dodecylbenzenesulfonate intercalated zinc-iron layered double hydroxides by one-step coprecipitation route, J. Solid State Chem., 180(5), 1636-1647.
-

- 43. Zhang, L., Hui, K.N., Hui, K.S., and Lee, H., 2015, Facile synthesis of porous CoAl-layered double hydroxide/graphene composite with enhanced capacitive performance for supercapacitors, Electrochim. Acta, 186, 522-529.
-

- 44. Zhang, Y., Cui, B., Zhao, C., Lin, H., and Li, J., 2013, Co-Ni layered double hydroxides for water oxidation in neutral electrolyte, Phys. Chem. Chem. Phys., 15(19), 7363-7369.
-

 This Article
This Article
-
2022; 27(4): 49-62
Published on Aug 31, 2022
- 10.7857/JSGE.2022.27.4.049
- Received on Aug 3, 2022
- Revised on Aug 16, 2022
- Accepted on Aug 24, 2022
 Services
Services
Shared
 Correspondence to
Correspondence to
- Minhee Lee
-
Major of Environmental Geosciences, Division of Earth Environmental System Science, Pukyong National University, Busan 48513, Korea
- E-mail: heelee@pknu.ac.kr