- Treatment of Phenol Contaminated Soil Using Sulfidated Zero-Valent Iron as a Persulfate Activator for Advanced Oxidation Process
Hyuk Sung Chung·Nguyen Quoc Bien·Jae Young Choi·Inseong Hwang*
Department of Civil & Environmental Engineering, Pusan National University
- 황화영가철 기반의 과황산 고도산화공정을 이용한 페놀 오염토양 처리
정혁성·응우옌 쿠엔 비엔·최재영·황인성*
부산대학교 사회환경시스템공학과
This article is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
A persulfate(PS)/sulfidated microscale zero-valent iron(S-mZVI) system was tested for treating a soil contaminated with phenol. Sulfidation of bare mZVI was conducted using a mechanochemical process utilizing a ball mill in order to improve persulfate activation capacity and stability of unmodified mZVI. The synthesized S-mZVI performed markedly better than the bare mZVI in activating PS. The optimum molar ratio of sulfur to mZVI was around 0.12. In the soil slurry experiments, a very rapid and complete removal of phenol was observed at the optimum molar ratios of PS to S-mZVI of 2:1 and PS to phenol of 16:1. The phenol removal efficiencies decreased as the water content of the slurries decreased. This was believed to be due to increased soil oxidant demand as the amount of soil was increased as relative to the water content. To evaluate the field applicability of the process, slurry experiments adopting high soil contents were carried out that simulated in-situ soil mixing conditions. These experiments resulted in substantially compromised degradation efficiencies of 54.3% and 43.8% within 4 hours. The current study generally shows that the PS/S-mZVI process has a potential to be developed into a remediation technology for soils contaminated with organics.
Keywords: Advanced Oxidation Processes, Sulfidated zero-valent iron, Persulfate, Soil remediation, In-situ Soil Mixing
고도산화공정은 염소화 유기 용제, 석유 및 BTEX와 같은 유기 오염물질로 오염된 토양 및 지하수 처리에 효과적인 기술로 주목을 받아왔다(Hou et al., 2021). 과황산은 높은 표준 산화-환원 전위(Eh = 2.01 V)를 갖는 강력한 산화제로서 열, 전이 금속, 과산화수소, 자외선 또는 기타 수단을 통한 활성화에 의해 다양한 유기 오염물질을 산화시킬 수 있는 황산 라디칼(Eh = 2.6 - 3.1 V)을 생성할 경우 더욱 효과적이다(Siegrist et al., 2011).
과황산이 물에 용해되었을 때 식 (1)과 같이 그 자체로 높은 산화력을 가진다. 영가철(Zero Valent Iron)은 전이금속으로서 비교적 높은 반응성으로 과황산 활성화제로 관심의 대상이 되고 있다(Dong et al., 2019, Kim et al., 2018, Oh et al., 2009). 영가철은 용존 산소(식 2) 또는 과황산(식 3)과 반응하여 용존 2가철 이온을 형성한다(Liang and Guo, 2010). 생성된 2가철 이온에 의한 과황산 활성화 반응이 식 (4)의 과정을 통해 일어난다. 과다한 2가철 이온이 존재할 경우에는 황산라디칼을 제거하는 경우가 있으나(식 5), 적정 농도의 영가철을 사용할 경우 2가철 이온을 비교적 완속으로 생성하여 황산 라디칼의 제거반응을 억제할 수 있다(Rodriguez et al., 2014). 또한, 영가철은 3가철을 2가철로 환원하여 재생성 할 수 있다(식 6)(Liang and Lai, 2008).
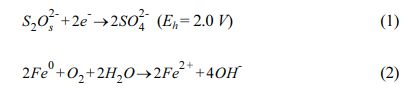
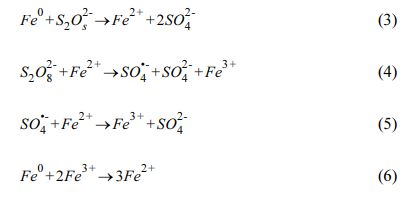
영가철 중 나노 크기의 입자를 가진 나노 영가철은 마이크로 크기의 영가철에 비해 오염물질 제거 효율이 높은 것으로 보고되었다(Ryu et al., 2011). 하지만 나노 영가철의 높은 반응성은 빠른 표면 부식으로 인해 철 산화물이 영가철 표면에 침적되는 부동태화 현상을 유발하며 이는 반응성을 저하시키는 요인이 된다(Song and Carra- way, 2005). 이를 극복하기 위하여 비교적 반응성이 낮은 마이크로 영가철을 사용하는 시도가 있었다(Ma et al., 2016). 하지만 여전히 부동태화 현상이 발생하며 일부연구에서는 이와 같은 현상을 보고했다(Li et al., 2014). 영가철의 부동태화 현상 방지와 반응성을 촉진하기 위해 탄소, 실리카, 점토 광물 또는 폴리머와 같은 다양한 물질을 사용하여 표면을 개질하는 기술이 개발되었다(Crane and Scott et al., 2012; Li et al., 2017; Dong et al., 2020). 최근들어 영가철 표면을 황을 이용하여 개질하는 황화 기술이 고도산화공정에서 주목을 받고 있다(Fan et al., 2017).
황화는 영가철 내부에서 외부로 전자를 효과적으로 전달하기 위해 표면에 FeSx를 생성하여 영가철의 성능을 최대화하는 효과적인 방법으로 대중화되었으며(Dong et al., 2019, Deng et al., 2021) 영가철의 선택도, 안정성 및 반응성을 현저하게 향상시킬 수 있는 개질방법이다(Zou et al., 2019, Jin et al., 2021, Zhang et al., 2021). 또한, 황화영가철의 표면에 결합된 2가 황화물이 3가철 이온에서 2가철 이온으로 재생성(식7-9)을 촉진하는 반응을 통해 철 찌꺼기 생산을 줄일 수 있다.
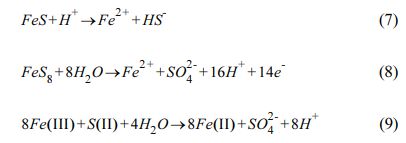
전술한 과황산과 황화영가철을 이용한 고도산화공정은 토양 내 유기오염물질의 처리에 적용될 수 있다. 이 두 가지 반응물질을 이용한 토양오염물질의 처리는 원위치 토양혼합기술을 이용하여 수행될 수 있다. 원위치 토양혼합기술은 반응성 약품을 토양에 주입할 시, 토양혼합을 통해 오염물질과 약품의 접촉을 높여 토양 내에 존재하는 오염물질을 처리하는 기술로서 적절한 토양혼합을 실시하여 현장 토양을 효과적으로 균질화하고 대상 처리 구역 내에 반응성 물질을 균일하게 분포시키는 것이 중요하다. 혼합장치 이외에 토양 내 오염물질의 양, 토양의 부피, 반응성 물질의 양, 주입속도, 토양의 성상에 따라 오염물질의 분해 양상이 달라지기 때문에 해당 오염지역에 대한 자세한 조사와 특성화가 필요하다. 황화영가철을 기반으로한 과황산 고도산화공정의 다양한 가능성에도 불구하고 그 공정을 오염 토양의 처리에 적용한 연구사례는 없는 것으로 보고되고 있다.
본 연구는 황화영가철에 의해 활성화된 과황산을 오염된 토양의 처리에 적용하고 그 처리특성을 평가하는 것을 목적으로 한다. 처리 특성을 고찰하기 위해 황화영가철의 합성조건과 다양한 공정변수의 영향이 페놀 오염토양의 처리에 미치는 영향을 평가하였다. 또한, 실험실 규모에서 실제 원위치 토양혼합기술을 모사한 분해실험을 실시하여 현장 처리에 대한 적용성을 판단하였다.
2.1. 시약 및 재료
대상 오염물질로는 페놀(99.5%, Sigma-Aldrich, USA)을 사용했으며 산화제로는 과황산나트륨(98%, Sigma-Aldrich, USA)을 사용했다. 과황산의 활성화제인 황화영가철을 합성하기 위하여 황(99.5%, Sigma-Aldrich, USA)과 영가철(³99%, Sigma-Aldrich, USA)을 사용하였다. 시료 채취 후 반응 종결제로 에탄올(99.5%, JUNSEI Chemical, Japan)을 사용하였다(Wei et al., 2016). 기타 시약으로는 요오드화 칼륨(99.5%, JUNSEI Chemical, Japan), 중탄산나트륨(99%, JUNSEI Chemical, Japan)을 사용하였다. 토양으로는 부산에서 오염되지 않은 사질양토를 채집하여 사용하였으며 그 성상은 Table 1에 표시하였다. 토양을 105oC에서 건조한 뒤 2 mm 입경 이하로 분리하여 사용했다. 페놀로 인공 오염된 토양은 아세톤(99.3%, J.T Baker, USA)에 용해시킨 3g의 페놀과 1 kg의 토양을 혼합한 후 텀블러를 이용하여 15 rpm의 속도로 48시간 동안 교반하여 제조하였다. 다음으로 인공오염토양은 24시간 동안 흄 후드에서 건조시켜 아세톤이 휘발하도록 하였다(Hancock et al., 1997).
2.2. 실험 방법
2.2.1. 볼밀링을 이용한 황화영가철 합성
볼밀링을통한 황화영가철의 합성은 Gu et al.(2017)이 제안한 solid-solid 방법을 참고하여 실시하였다. 볼밀링을 이용할 경우 기계화학적 반응을 통해 영가철 표면에 황화철을 형성시킴으로써 비교적 반응성이 뛰어난 황화영가철을 합성할 수 있다. 합성을 위하여 먼저 알루미나 도가니 내부에 지르코니아 구슬(3 mm & 5 mm, OEM), 황, 영가철을 옮겨 담은 후 남은 공간을 질소로 채웠다. 외부 공기가 들어오지 못하게 혐기성 챔버 내에서 밀봉한 후, Planetary Ball Mill(SPM-4L, OEM)을 이용하여 400 rpm의 교반속도로 10시간 동안 반응시켜 합성을 실시하였다. 영가철의 양을 10 g으로 고정한 후 황의 양을 조절하여 [S]/[Fe] 비를 0.03, 0.06, 0.12, 0.24, 0.36의 5가지로 변화시키면서 합성하였다. 합성한 황화영가철의 특성평가연구는 현재 수행중으로 일부 도출된 표면분석결과를 살펴보면(Chung et al., 2022)초기에 주입한 황의 대부분은 FeSx 형태의 황화철로 전환되는 것으로 추정된다. 그러나 합성된 황화영가철의 구성성분과 황화철 생성수율에 대한 좀 더 정교한 고찰이 필요하다.
2.2.2. 액상 분해실험
액상 회분식 실험은 황화영가철의 최적 [S]/[Fe] 비율을 결정할 때 125 mL 붕규산 유리병을 이용하여 실시하였다. 전술한 방법으로 황화영가철을 합성한 후, 페놀 및 과황산의 원액을 원하는 농도에 도달하도록 탈이온수에 용해하여 준비했다. 혐기성 챔버 내에서 황화영가철과 페놀 용액을 유리병에 첨가한 후, 반응을 개시하기 위해 과황산 용액을 신속하게 주입하였다. 유리병의 교반은 회전식 진탕기(HB-203S, HANBAEK Co.)를 이용하여 140 rpm의 속도에서 수행되었다. 대조군 실험으로는 볼밀링 하지 않은 영가철을 사용하여 동일하게 실험하였다. 사전에 설정된 시간 간격으로 1 mL 시료를 유리병에서 채취하여 0.22 mm PTFE 필터를 통해 여과 후 40% 에탄올로 반응을 종결시킨 후 페놀을 분석하였다. 각각의 실험은 2회 반복하여 페놀 농도의 평균값을 채택하였다.
2.2.3. 토양슬러리 분해실험
토양을 이용한 모든 실험은 125 mL 붕규산 유리병을 이용하여 수행하였다. 페놀로 인공오염된 토양과 황화영가철을 유리병에 옮겨 담은 후 과황산 용액을 신속하게 주입한 후 회전식 진탕기를 이용하여 140 rpm의 속도로 혼합을 실시하였다. 이후 액상 실험과 동일한 방법으로 페놀시료를 채취하여 분석하였다.
원위치 토양혼합장치인 오거 모사한 분해 실험에서는 토양혼합과 반응성 물질의 주입을 동시에 수행하는 장비의 특성을 반영하기 위한 교반기와 토양:약액 비율을 사용하였다. 3 L 유리병을 반응기로 이용하였고 3중 4날의 임펠러를 사용하여 교반을 실시하였으며, 페놀 인공오염된 토양과 약액의 비율을 1:2로 조절하여 100 rpm에서 4시간 동안 반응을 시켰다.
약품을 토양표면에 분사한 후 토양혼합을 수행하는 원위치 토양혼합장치인 굴삭기의 버킷을 모사하기 위한 실험도 수행하였다. 토양의 혼합이 가능한 최대의 토양과 약액의 비율을 10:1로 선정하였고, 125 mL 붕규산 유리병내 토양과 약액을 옮겨 담은 후 상하 방향으로 뒤집는 간헐적 교반을 수행하여 굴삭기 버킷을 이용한 교반을 모사하였다. 방향을 30분을 주기로 바꿀 때마다 회전식 진탕기에서 100 rpm의 강도로 5분씩 교반을 수행하였다. 토양의 양이 상대적으로 많은 원위치 토양혼합장치 모사 실험에서는 페놀의 추출을 위해서 메탄올을 사용하였다(Hancock et al., 1997).
2.3.분석 방법
페놀은 HPLC(High Performance Liquid Chromato- graph, Ultimate 3000, Shidmadzu)에 장착된 UV검출기(SPD-20A, Shimadzu)와 C18 컬럼(4.6 μm × 250 mm, Poroshell 120, Agilent)을 사용하여 분석하였다. HPLC 측정에 사용된 이동상은 20% 메탄올과 0.5%의 아세트산이었고 유량은 0.15 mL/min로 하였다(Kim et al., 2018). 과황산 이온 농도는 분광광도법을 이용하여 측정하였다. 12 mM Na2S2O8 수용액을 주어진 여러가지 농도로 희석하여 도출된 표준 검량선을 작성하여 정량하였다. 과황산의 발색을 위해 요오드화칼륨(KI, 99.5%, JUNSEI Che- mical, Japan)을 이용하였고 다른 물질과의 반응을 막기 위해 탄산수소나트륨(NaHCO3, 99%, JUNSEI Chemical, Japan)를 사용하였다. NaHCO3 1 g과 KI 20 g을 200 mL의 탈이온수에 넣어 만든 용액 10 mL에 250 μL의 시료를 주입하여 20분간 반응시켰다. 발색 후 UV/Vis 분광광도계(Optizen 3220UV, Mecasys)를 이용하여 400 nm 파장에서 측정하였다(Kim et al., 2018).
2.4. 페놀 분해와 과황산 소모 모델
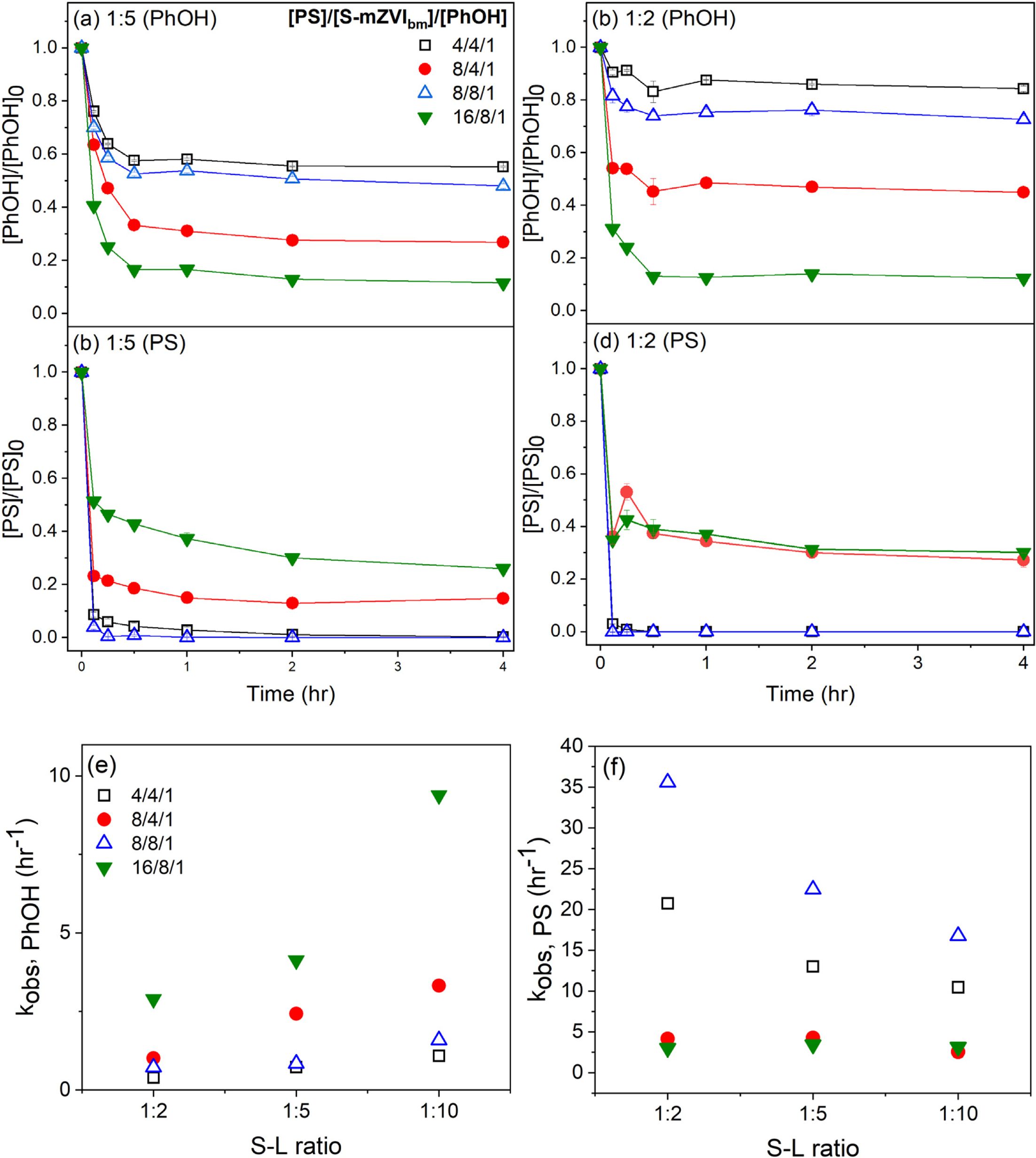
황화영가철을 이용한 과황산의 활성화 시스템에 의한 페놀 제거 과정은 액상실험과 토양슬러리 실험 모두 pseudo-first-order kinetic model을 사용하여 해석하였다.
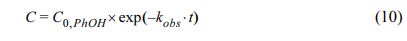
식 (10)에서 C는 시간 t(hr)에서 제거된 페놀의 농도(mM), C0, PhOH는 초기 페놀 농도, kobs는 1차 반응속도 상수이다.

과황산 소모 속도 또한 같은 모델을 통해 해석했다. 식(11)에서 C는 시간 t(hr)에서 소모된 과황산의 농도(mM), C0,PS는 과황산의 초기 농도, kobs는 각각 1차 반응속도 상수이다. 페놀과 과황산의 반응속도 상수는 각 물질의 농도가 5% 미만으로 변경될 때까지 맞춰 분석하였다.
3.1. 황화영가철의 최적 [S]/[Fe] 비율 결정
황화영가철 입자의 [S]/[Fe] 비율 조건을 변화시키면서 황화영가철을 활성화제로 이용한 과황산의 산화공정의 페놀 제거율과 과황산 소모율을 비교하였다. 황화영가철은 모든 실험 조건에서 대조군인 영가철과 비교하여 높은 페놀 제거율과 과황산 소모율을 보였으며, [S]/[Fe] 비가 증가할수록 페놀 제거율이 높아지는 경향이 확인되었다. 페놀 제거 속도는 황비율에 따라 상이함을 확인하였다(Table 2). [S]/[Fe] = 0.36에서 황화영가철의 경우 8시간 내에 페놀을 98.1% 제거하여 시험한 황화영가철 중 분해효율이 가장 높았다(Fig. 1a). 페놀 제거 속도의 경우도 제거율과 [S]/[Fe] = 0.12 조건까지 비례하는 경향이 보이나, [S]/[Fe] = 0.24 조건부터 비교적 낮은 kobs,PHOH 값을 확인할 수 있다(Fig. 1c). 초기 30분 이후 더 이상 페놀 제거가 일어나지 않는 평형 농도에 도달한[S]/[Fe] = 0.03, 0.12 조건에서 [S]/[Fe] = 0.24, 0.36 조건에서 보다 빠르게 페놀이 제거된 것으로 확인된다. 0.24와 0.36 조건에서의 낮은 kobs,PHOH 값은 영가철을 덮고 있는 황화철 층이 비교적 두꺼워 완속으로 2가철이 방출되었기 때문으로 추정되는데 이는 상대적으로 낮은 과황산 제거속도에서 반영되고 있다(실험 4와 5). 이와 같이 낮은 반응속도상수를 보임에도 완속적인 2가철 방출에 의한 지속적인 라디칼 생성을 통해 결과적으로 처리대상물질 제거율이 높아지게 되는 기작은 본 연구진의 선행연구에서 보고된 바가 있으며 후속 연구가 더 필요할 것으로 보인다(Song, 2021).
과황산이 소모되는 농도를 확인한 결과 대조군인 영가철(22.1%)과 비교하여 황화영가철 시스템의 경우 약 85%의 소모율로 과황산의 활성화 촉진이 비교적 활발하였으며, [S]/[Fe] 비율과 관계없이 황화영가철 시스템의 최종 과황산 소모율의 차이는 2% 내외로 크지 않았다(Fig. 1b).
선행연구 결과에 의하면 [S]/[Fe]의 비율이 높을수록 즉, 황이 많을수록 반응 초기 단계에서 영가철 코어에서 과황산으로 전자를 전달하는 역할을 하는 FeSX가 과도하게 생성된다. 이는 황화영가철 표면의 활성지역을 차단하거나 반응종을 제거하여 결과적으로 황화영가철의 반응성을 감소시킬 수 있다(Kim et al., 2011). 본 연구에서는 [S]/[Fe] = 0.36 조건의 황화영가철은 가장 높은 페놀 제거율을 보이지만 [S]/[Fe] 비가 0.24를 초과한 황화영가철은 공기 노출 시 발화하는 위험이 존재하였다. 이처럼 공기 중에 자발적으로 발화할 경우 상당한 양의 열을 방출하고 동시에 부동태화 현상이 발생하여 반응성을 저해한다. 또한, 산화제와 반응하여 유황 산화물의 독성 증기를 방출한다. 공기와의 접촉을 최소화한 혐기성 챔버 내에서 합성을 실시했기에 자발적 발화를 통한 부동태화 현상이 억제되어 반응성을 유지하는 데 영향을 끼치는 것으로 보인다.
목표로 하는 오염물질에 따라 최적의 [S]/[Fe] 값은 다양할 수 있다(Li et al., 2017). 비교적 공기에 노출이 많은 큰 반응기 실험이나 현장을 고려하여 황화영가철의 부동태화 현상을 막고 이를 통한 오염 물질과 낮은 반응성을 방지하기 위해 본 연구에서는 자발적 발화가 발생하지 않는 [S]/[Fe]=0.12 조건을 황화영가철의 최적 비율로 결정하여 이후 실험을 진행하였다.
3.2. 과황산과 황화영가철 주입량의 영향
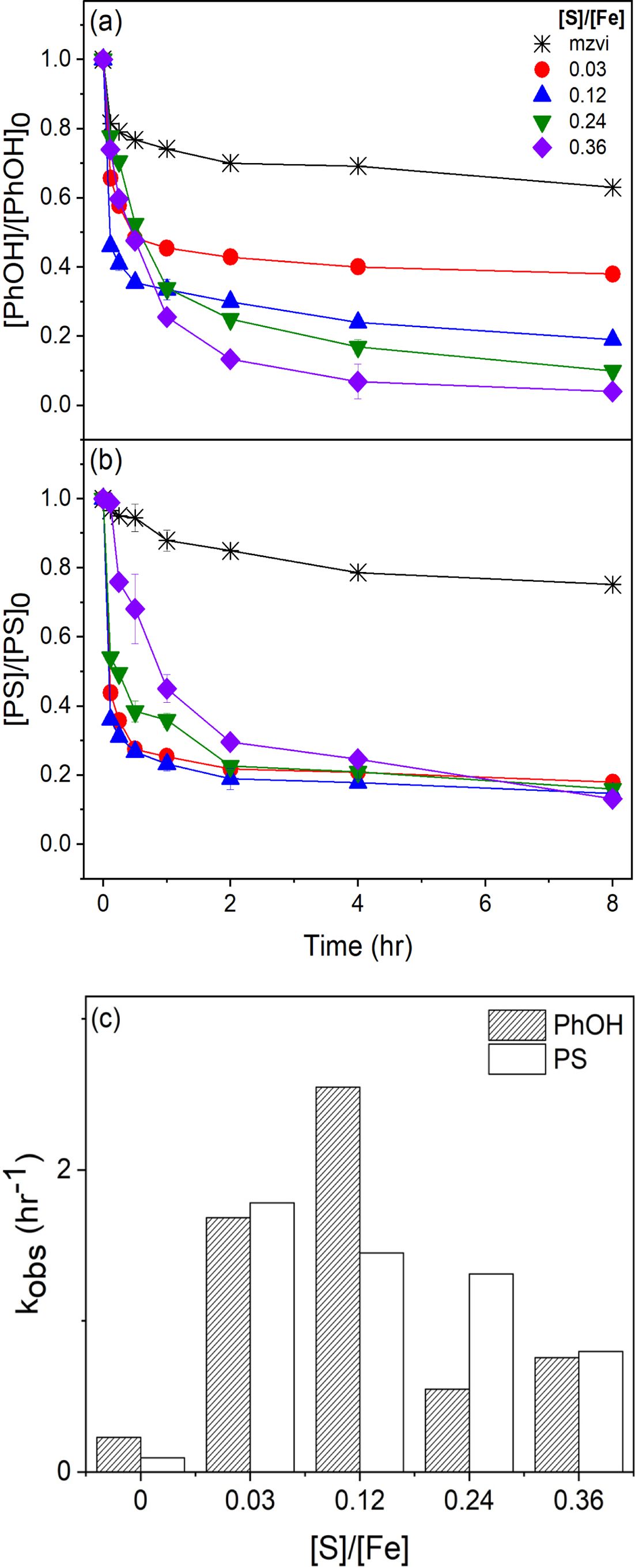
토양과 약액과의 질량비인 함수비를 1:10 조건으로 선정하여 [S]/[Fe] = 0.12 황화영가철과 과황산의 다양한 주입농도에 따른 페놀 제거율과 과황산 소모율을 비교하였다. Fig. 2a, c에 나타난 것과 같이 과황산의 주입농도가 높을수록 페놀 제거율이 높아지고, [PS]/[S-mZVIbm]/[PhOH] 비가 8/4/1 조건과 8/8/1 조건 실험을 통해 황화영가철의 농도가 과황산의 농도와 동일한 경우보다 절반일 경우 페놀 제거율과 제거 속도가 높음을 확인했다. 페놀 농도 대비 16배의 과황산, 8배의 황화영가철을 주입하였을 때(16/8/1) 가장 높은 페놀 제거율(100%)과 페놀 제거 속도(9.38 hr-1)를 보였다.
과황산과 황화영가철의 몰비가 1:1인 8/8/1, 4/4/1 조건일 때 페놀 제거율이 2:1인 16/8/1, 8/4/1 조건보다 낮지만 과황산 소모율과 소모 속도에서 높은 결과를 확인하였다(Fig. 2b와 2c). 과황산의 양과 황화영가철의 주입농도가 동일한 경우 과황산의 활성화에 필요한 황화영가철이 2가철 이온을 과다방출하여 라디칼 제거 현상을 촉진시켜 낮은 페놀 제거율을 보이는 것으로 판단된다(Yoon et al., 2022). 과황산의 절반 농도의 황화영가철을 주입했을 경우 동일한 경우와 비교하여 확연히 차이 나는 페놀 제거율을 확인했다. 황화영가철 주입량이 감소됨에 따라 라디칼 제거반응이 감소하여 페놀을 지속적으로 제거할 수 있었던 것으로 보인다. 두 조건 모두 페놀 제거율과 비례하는 페놀 제거 속도를 Table 2를 통해 비교할 수 있다(실험 7과 9). 모든 반응은 초기에 페놀이 대부분 제거되고 이후 평형 농도를 유지하는 형태와 비교적 낮은 R2값을 보인다. 이러한 경향은 이전 [S]/[Fe] 비율 최적화를 통해 선정된 [S]/[Fe]=0.12 조건 실험결과와 비슷함을 확인할 수 있다(실험 3).
실험 시작 후 4시간이 지난 시점에서 과황산과 황화영가철의 몰 비가 2:1인 경우 과황산 소모율이 약 71.5% 인 반면, 과황산과 황화영가철의 몰 비가 1:1인 경우 초기 30분 이내 과황산 소모율이 100%인 것으로 확인되었다. 이처럼 과황산과 황화영가철의 몰 비가 동일한 경우 과황산은 초기 30분 이내 황화영가철과 모두 반응하며 과황산 소모율을 100% 달성하여 과황산과 황화영가철의 몰 비가 2:1인 조건보다 비교적 높은 과황산 소모 속도가 얻어지는 것을 확인할 수 있다. 그 결과 과황산이 소모되면서 황산 라디칼을 더 이상 생성하지 않아 결과적으로 페놀의 제거가 더 이상 일어나지 않은 것으로 판단된다.
3.3. 함수비의 영향
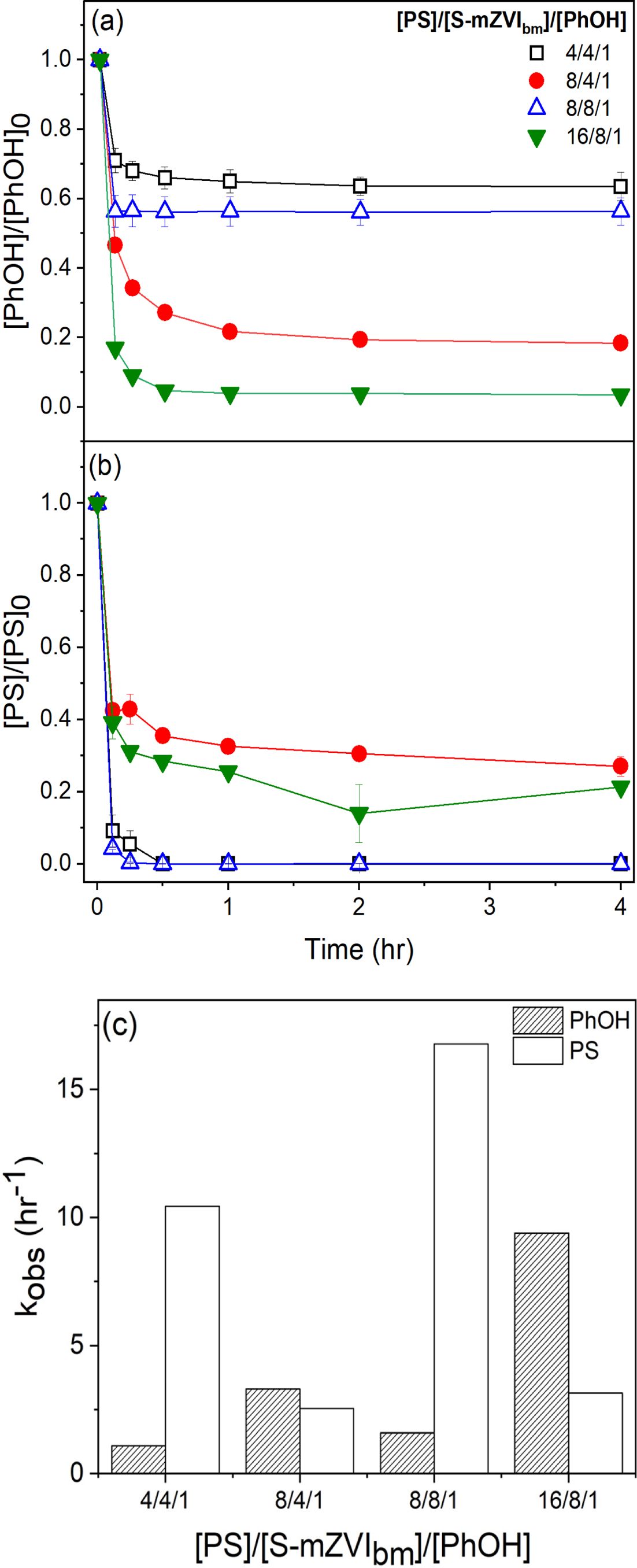
원위치 오염토양의 처리 조건과 유사한 환경을 모사하기 위해 약액의 양을 달리하여 함수비 1:10 조건에 비해 약액의 양이 감소한 함수비로 각각 1:5, 1:2 조건을 선정하여 실험을 진행하였다. 과황산/황화영가철 주입량 별 4시간 이후 결과를 살펴보면, 함수비가 낮아질수록 즉, 약액의 양이 감소할수록 페놀 제거율이 감소하는 경향을 확인하였다(Fig. 3a와 3b). 이는 이전 선행결과들과 일치하며 토양이 페놀 제거를 방해함으로써 비교적 낮은 페놀 제거율을 확인할 수 있다(Tang et al., 2015). 토양에 흡착된 페놀의 양을 정량한 결과 총 농도의 약 2.61% 수준으로 흡착은 큰 영향을 끼치지 않는다고 판단하였다.
과황산 소모율의 경우 과황산과 황화영가철의 몰 비가 동일한 경우 모든 함수비 조건에서 초기 30분 이내 100%를 소모되었다(Fig. 3b와 3d). 함수비가 1:5일 때 과황산과 황화영가철의 몰 비가 2:1인 조건 중 8/4/1의 경우 다른 조건과 비교하여 과황산 소모율이 높게 나타나는데, 이는 현재의 회분식 실험에서는 각 함수비에 따른 과황산의 소모의 기작이 다발적으로 발생하기에 기여하는 정도를 파악하기 힘들고, 향후 토양의 성상을 고려한 추가 연구가 필요함을 시사한다. 과황산 소모 속도를 분석한 결과 함수비가 감소할수록 kobs,PS 값이 증가하는 경향을 보인다(Fig. 3f.). 페놀 제거 속도를 분석한 결과, 함수비가 감소 할수록 kobs,PhOH 값이 감소하는 경향을 확인할 수 있다(Fig. 3e). 페놀농도 대비 16배의 과황산과 8배의 황화영가철 주입 시 모든 조건에서 페놀 제거율은 큰 차이가 없는 것을 확인했으며 함수비의 영향을 크게 받지 않은 것으로 판단된다. 이처럼 용액의 양이 토양에 비해 상대적으로 작아지는, 즉 함수비가 낮아지는 경우 초기 30분 내 과황산이 토양성분에 의해 소모되는 현상이 중요해진다고 생각되며(Fang et al., 2018) 페놀 제거 이외의 토양에 의한 과황산 소모기작이 있는 것으로 추정된다.
3.4. 원위치 토양혼합기술을 모사한 페놀 분해
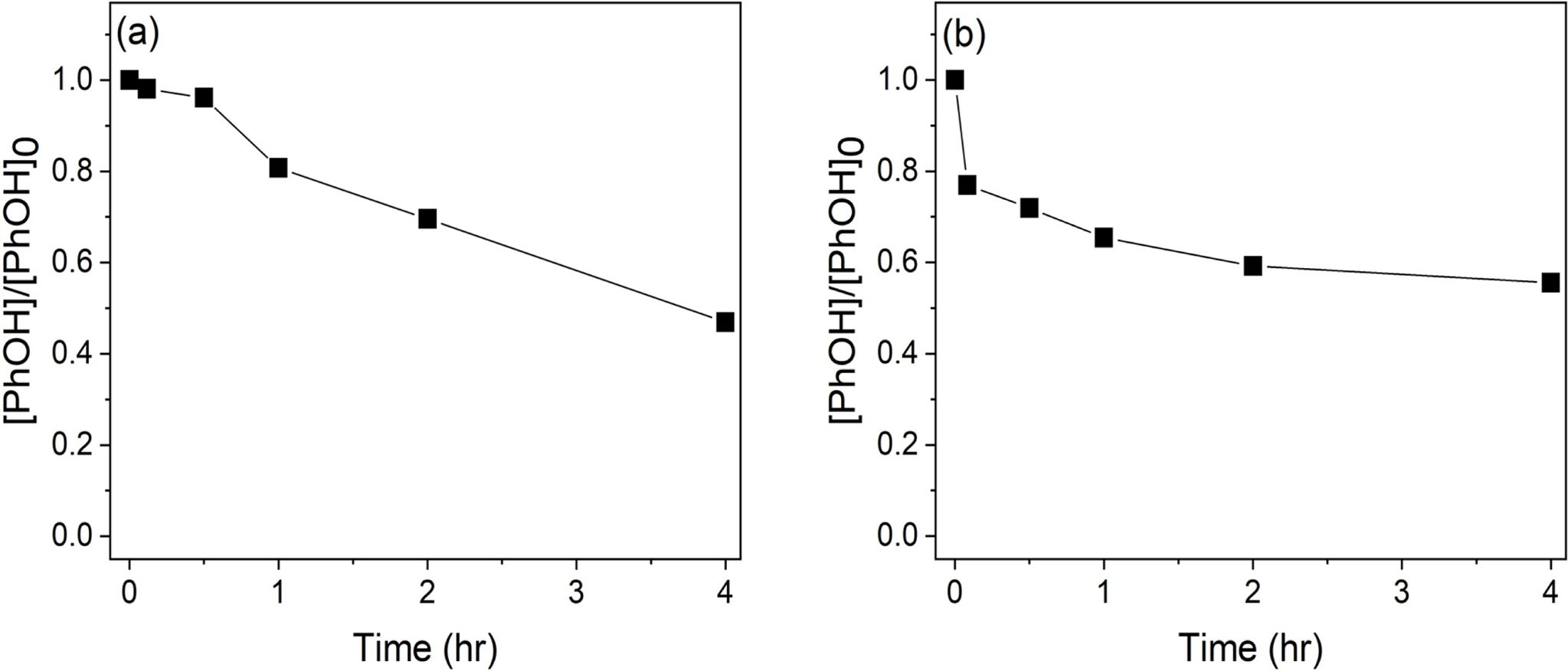
이전 토양 슬러리 실험에서 도출한 페놀 제거율이 가장 높은 페놀 농도 대비 16배의 과황산, 8배의 황화영가철 주입을 조건으로 오거 혼합장치 형태를 모사하기 위해서 임펠러를 이용한 교반을 실시한 실험에서는 이전 토양 실험과 비교하여 확연히 낮은 페놀 제거율(54.3%)을 보였다(Fig. 4a). 회전식 진탕기를 이용한 혼합에 비해서 제한적인 혼합이 이루어진 것이 가장 큰 요인으로 판단된다. 또한 이전 토양 실험과 비교하여 실험이 종료된 4시간을 기준으로 평형 농도에 도달하지 않았다는 점과 시간에 따라 제거되는 페놀의 양이 비교적 일정한 0차 반응(Table 2의 실험18)을 보였다는 점은 이전 토양 슬러리 실험에서 보여진 현상과는 대비되는 결과이다. 이를 통해 교반방식에 따라 페놀이 제거되는 속도와 경향이 상이하다는 점을 추측할 수 있으며, 이를 검증하기 위해 교반방식의 영향에 대한 추가 고찰이 필요하다. 임펠러의 회전속도, 회전시간, 날의 각도와 개수, 반응기의 크기 등이 혼합에 영향을 미칠 수 있는 인자이다.
굴삭기 버킷 형태를 모사한 실험을 수행한 결과 4시간 이내 토양 내 페놀을 43.8% 제거했다(Fig. 4b). 앞선 오거 혼합장치 모사실험의 경우와 유사하게 제한적인 교반에 의해 낮은 페놀 제거율이 나타난 것으로 판단된다. 오거 토양혼합장치를 모사한 실험과 비교하여 낮은 페놀 제거율을 보였으나 이전의 토양슬러리 실험에서와 유사하게 페놀의 분해는 1차반응으로 일어났으면 4시간 이내에 거의 평형에 도달하는 것을 확인하였다. 따라서 본 실험을 통해 원위치 토양혼합기술을 모사한 페놀 제거는 오거 혼합장치 형태가 적절하다고 판단되며 현장에 적용될 수 있는 변수를 고려하여 정확하고 다양한 반응에 대한 결과와 후속연구가 필요하다.
|
Fig. 1 Effect of various [S]/[Fe] ratios of sulfidated zero-valent iron (S-mZVIbm) on (a) phenol removal efficiency, (b) persulfate consumption rate, and (c) pseudo-first order rate constants for phenol (kobs,PhOH) and persulfate (kobs,PS). [PS]0= 12 mM, [SmZVIbm]0= 6 mM, [PhOH]0= 3 mM. |
|
Fig. 2 Phenol degradation and persulate consumption at various dosages of persulfate and S-mZVIbm. (a) phenol removal efficiency, (b) persulfate consumption rate, and (c) pseudo-first order rate constants for phenol (kobsPhOH), and persulfate (kobsPS). [PS]0= 12~48 mM, [S-mZVIbm]0= 12~24 mM, [PhOH]0= 2.91 g/kg, [S]/[Fe] = 0.12, Soil:Liquid = 1:10. |
|
Fig. 3 Phenol degradation according to different mass ratios of soild and liquid (S:L ratio) of the slurries. (a) phenol removal efficiency at 1:5 S:L ratio, (b) persulfate consumption rate at 1:2 S:L ratio, (c) phenol removal efficiency at 1:5 ratio, (d) persulfate consumption rate at 1:2 ratio, (e) pseudo-first order rate constant for phenol (kobs,PHOH), and (f) pseudo-first order rate constant for persulfate (kobs,PS), [PS]0= 12~48 mM, [S-mZVIbm]0= 12~24 mM, [PhOH]0= 2.91 g/kg, [S]/[Fe] = 0.12. |
|
Fig. 4 Phenol degradation at two different simulated in-situ soil mixing conditions. (a) Four-blade propeller used to simulate in-situ auger mixing (b) Sporadic end-over-end mixing executed to simulate bucket mixing. |
|
Table 2 Phenol and persulfate degradation efficiencies and rates in various conditions |
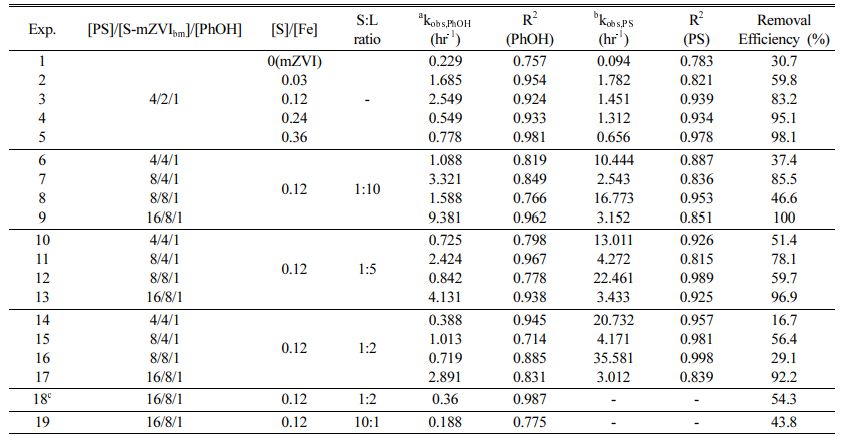
aThe phenol oxidation rate constant was obtained by fitting a first-order model to the data until the changes in phenol concentrations were less than 5% of the initial phenol concentration. |
본 연구에서는 과황산과 황화영가철을 이용한 고도산화공정을 적용하여 토양 내 페놀의 제거 특성을 평가하였다. 황화영가철의 [S]/[Fe] 비율이 0.03에서 0.36로 증가함에 따라 황화영가철을 활성화제로 이용한 과황산 고도산화 공정의 페놀 제거율도 증가하였다. [S]/[Fe] 비율이 0.36인 경우에는 기존의 개질되지 않은 영가철을 이용한 시스템과 비교하여 3배 이상의 높은 페놀 제거율을 보였다. 하지만 [S]/[Fe] 비율이 높은 조건에서 황화영가철이 자연발화하는 단점을 보여 황화영가철의 최적 [S]/[Fe] 비율을 0.12로 선정하였다. 황화영가철을 활성화제로 이용한 과황산의 페놀산화반응의 최적조건은 과황산과 황화영가철의 몰비가 2:1이고 과황산과 페놀의 몰비가 16:1인 조건으로 나타났으며 이러한 조건에서 페놀을 1시간 이내에 100% 제거 가능하였다. 토양슬러리 시스템내에서 함수비가 페놀분해에 미치는 영향을 분석한 결과 함수비가 낮아질수록, 즉 용액의 양이 낮아질수록 페놀 제거율이 감소되는 경향을 확인할 수 있었다. 이는 과황산의 페놀 제거 기작 이외의 토양의 유기물이나 광물 등에 의한 과황산의 소모가 산화반응을 저해하였음을 시사한다. 과황산/황화영가철 기술의 현장 적용을 감안하여 함수율을 현저하게 낮은 상태로 유지한 원위치 토양혼합기술 모사실험을 수행한 결과, 함수율이 비교적 높은 슬러리 실험에서의 결과와 비교하여 현저하게 낮은 페놀 제거율을 얻었다. 그러나, 본 연구 결과 전반적으로는 페놀로 오염된 토양의 처리에 황화영가철/과황산 고도산화공정의 적용이 충분히 가능하다는 것을 보여준다. 향후 토양의 특성에 따른 과황산의 소모 반응, 함수비 및 원위치 교반조건이 과황산 고도산화반응에 미치는 영향 등에 대한 추가고찰이 필요함을 알 수 있다.
이 과제는 부산대학교 기본연구지원사업(2년)에 의하여 연구되었음.
- 1. Chung, H.S., Bien, N.Q., Choi, J.Y., and Hwang, I. (2022, October), Treatment of phenol contaminated soil using sulfidated zero valent iron as a persulfate activator for advanced oxidation process, [Conference presentation], KOSSGE 2022 Fall Meeting, Siheung, Korea.
- 2. Crane, R.A. and Scott, T.B., 2012, Nanoscale zero-valent iron: future prospects for an emerging water treatment technology, Journal of Hazardous Materials, 211-212, 112-125.
-

- 3. Hancock, P. and Dean, J., 1997, Extraction and fate of phenols in soil, Anal. Commun., 34(12), 377-379.
-

- 4. Deng, S., Liu, L., Cagnettam G., Huang, J., and Yu, G., 2021, Mechanochemically synthesized S-ZVIbm composites for the activation of persulfate in the pH-independent degradation of atrazine: Effects of sulfur dose and ball-milling conditions, Chemical Engineering Journal, 423, 129789.
-

- 5. Dong, H., Hou, K., Qiao, W., Cheng, Y., Zhang, L., Wang, B., Li, L., Wang, Y., Ning, Q., and Zeng, G., 2019, Insights into enhanced removal of TCE utilizing sulfide-modified nanoscale zero-valent iron activated persulfate, Chemical Engineering Journal, 359, 1046-1055.
-

- 6. Dong, H., Ning, Q., Li, L., Wang, Y., Wang, B., Zhang, L., Tian, R., Li, R., and Chen, J., and Xie, Q., 2020, A comparative study on the activation of persulfate by bare and surface-stabilized nanoscale zero-valent iron for the removal of sulfamethazine, Separation and Purification Technology, 230, 115869.
-

- 7. Fan, D., Lan, Y., Tratnyek, P.G., Johnson, R.L., Filip, J., O¡¯Carroll, D.M., Garcia, A.N., and Agrawal, A., 2017, Sulfidation of iron-based materials: a review of processes and implications for water treatment and remediation. Environ. Sci. Technol., 51(22), 13070-13085.
-

- 8. Fang, G.D., Dionysiou, D.D., Al-Abed, S.R., and Zhou, D.M., 2013, Superoxide radical driving the activation of persulfate by magnetite nanoparticles: implications for the degradation of PCBs, Applied Catalysis B: Environmental, 129, 325-332.
-

- 9. Gu, Y., Wang, B., He, F., Bradley, M.J., and Tratnyek, P.G., 2017, Mechanochemically sulfidated microscale zero valent iron: pathways, kinetics, mechanism, and efficiency of trichloroethylene dechlorination, Environ. Sci. Technol., 51(21), 12653-12662.
-

- 10. Hou, K., Pi, Z., Yao, F., Wu, B., He, L., Li, X., Wang, D., Dong, H., and Yang, Q., 2021, A critical review on the mechanisms of persulfate activation by iron-based materials: Clarifying some ambiguity and controversies, Chemical Engineering Journal, 127078.
-

- 11. Jin, H., Cang, Z., Ding, W., Wu, W., Ma, H., Wang, C., Qi, Z., and Li, Z., and Zhang, L., 2021, Oxidative removal of antibiotic resistant E. coli by sulfidated zero-valent iron: Homogeneous vs heterogeneous activation, Journal of Hazardous Materials, 408, 124411.
-

- 12. Kim, M.H., Na, H.K., Kim, Y.K., Ryoo, S.R., Cho, H.S., Lee, K.E., Jeon, H., Ryoo, R., and Min, D.H., 2011, Facile synthesis of monodispersed mesoporous silica nanoparticles with ultralarge pores and their application in gene delivery, ACS Nano, 5(5), 3568-3576.
-

- 13. Kim, C., Ahn, J.Y., Kim, T.Y., Shin, W.S., and Hwang, I., 2018, Activation of persulfate by nanosized zero-valent iron (NZVI): mechanisms and transformation products of NZVI, Environ. Sci. Technol., 52(6), 3625-3633.
-

- 14. Li, H., Wan, J., Ma, Y., Huang, M., Wang, Y., and Chen, Y., 2014, New insights into the role of zero-valent iron surface oxidation layers in persulfate oxidation of dibutyl phthalate solutions, Chemical Engineering Journal, 250, 137-147.
-

- 15. Li, J., Zhang, X., Sun, Y., Liang, L., Pan, B., Zhang, W., and Guan, X., 2017, Advances in sulfidation of zerovalent iron for water decontamination, Environ. Sci. Technol., 51(23), 13533-13544.
-

- 16. Liang, C. and Guo, Y.Y., 2010, Mass transfer and chemical oxidation of naphthalene particles with zerovalent iron activated persulfate, Environ. Sci. Technol., 44(21), 8203-8208.
-

- 17. Liang, C. and Lai, M.C., 2008, Trichloroethylene degradation by zero valent iron activated persulfate oxidation, Environmental Engineering Science, 25(7), 1071-1078.
-

- 18. Ma, J., He, D., Collins, R.N., He, C., and Waite, T.D., 2016, The tortoise versus the hare-Possible advantages of microparticulate zerovalent iron (mZVI) over nanoparticulate zerovalent iron (nZVI) in aerobic degradation of contaminants, Water Research, 105, 331-340.
-

- 19. Oh, S.Y., Kim, H.W., Park, J.M., Park, H.S., and Yoon, C., 2009, Oxidation of polyvinyl alcohol by persulfate activated with heat, Fe2+, and zero-valent iron, Journal of Hazardous Materials, 168(1), 346-351.
-

- 20. Ryu, A., Jeong, S.W., Jang, A., and Choi, H., 2011, Reduction of highly concentrated nitrate using nanoscale zero-valent iron: effects of aggregation and catalyst on reactivity, Applied Catalysis B: Environmental, 105(1-2), 128-135.
-

- 21. Rodriguez, S., Vasquez, L., Romero, A., and Santos, A., 2014, Dye oxidation in aqueous phase by using zero-valent iron as persulfate activator: kinetic model and effect of particle size, Ind. Eng. Chem. Res., 53(31), 12288-12294.
-

- 22. Siegrist, R.L., Crimi, M., and Simpkin, T.J. (Eds.), 2011, In situ chemical oxidation for groundwater remediation (Vol. 3). Springer Science & Business Media.
-

- 23. Song, M., 2021, Activation of persulfate using slow-release of Fe(II) mediated by silica-coated nZVI for in situ chemical oxidation. (Masters issertation). Pusan National University, 82.
- 24. Song, H. and Carraway, E.R., 2005, Reduction of chlorinated ethanes by nanosized zero-valent iron: kinetics, pathways, and effects of reaction conditions. Environ. Sci. Technol., 39(16), 6237-6245.
-

- 25. Tang, X., Hashmi, M.Z., Zeng, B., Yang, J., and Shen, C., 2015, Application of iron-activated persulfate oxidation for the degradation of PCBs in soil, Chemical Engineering Journal, 279, 673-680.
-

- 26. Wei, X., Gao, N., Li, C., Deng, Y., Zhou, S., and Li, L., 2016, Zero-valent iron (ZVI) activation of persulfate (PS) for oxidation of bentazon in water, Chemical Engineering Journal, 285, 660-670.
-

- 27. Yoon, S.E., Kim, C., and Hwang, I., 2022, Continuous Fe (II)-dosing scheme for persulfate activation: Performance enhancement mechanisms in a slurry phase reactor, Chemosphere, 308, 136401.
-

- 28. Zhang, L., Jin, H., Ma, H., Gregory, K., Qi, Z., Wang, C., Wu, W., Cang, D., and Li, Z., 2020, Oxidative damage of antibiotic resistant E. coli and gene in a novel sulfidated micron zero-valent activated persulfate system, Chemical Engineering Journal, 381, 122787.
-

- 29. Zou, H., Hu, E., Yang, S., Gong, L., and He, F., 2019, Chromium (VI) removal by mechanochemically sulfidated zero valent iron and its effect on dechlorination of trichloroethene as a co-contaminant, Science of the Total Environment, 650, 419-426.
-

 This Article
This Article
-
2023; 28(1): 15-24
Published on Feb 28, 2023
- 10.7857/JSGE.2023.28.1.015
- Received on Feb 8, 2023
- Revised on Feb 13, 2023
- Accepted on Feb 20, 2023
 Services
Services
Shared
 Correspondence to
Correspondence to
- Inseong Hwang
-
Department of Civil & Environmental Engineering, Pusan National University
- E-mail: ihwang@pusan.ac.kr