- A Study on Magnetization of Layered Metal Sulfide for the Removal of Cesium Ions from Aqueous Solution
Chul-Min Chon1·Jiwon Park1·Jungho Ryu1·Jeong-Yun Jang1·Dong-Wan Cho1*
1Mineral Resources Division, Korea Institute of Geoscience and Mineral Resources
- 수중 세슘 제거를 위한 층상 황화 금속 물질 자성화 연구
전철민1·박지원1·류정호1·장정윤1·조동완1*
1한국지질자원연구원 광물자원연구본부
This article is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
In the fabrication of magnetic adsorbent by incorporating iron species on base materials with layered structure, there can be a potential loss of adsorption capacity from the penetration of dissolved iron species into the structure. This work newly synthesized a magnetic adsorbent by incorporating nano magnetite and glucose into layered metal sulfide via hydrothermal treatment, and tested the removal efficiencies of cesium ions (Cs+) by the adsorbents fabricated under different conditions (final temperature and glucose mass ratio). As a result, the optimal fabrication condition was found to be mass ratio of 1 (layered metal sulfide) : 0.1 (nano magnetite) : 0.4 (glucose) and final temperature of 160oC. As-prepared adsorbent possessed good adsorption ability of Cs+ (54.8 mg/g) without a significant loss of adsorption capacity from attaching glucose and nano magnetite onto the surface.
Keywords: Cesium, Layered metal sulfide, Magnetite, Glucose, Hydrothermal treatment
전 세계에 설치되어 있는 원전에서 지진으로 인한 핵 누출 사고나 핵무기 실험에 의해 인체에 악영향을 미치는 방사성 오염물질들(137Cs, 90Sr, 235U, 131I 그리고 57Co)이 수계에 유입되어 환경오염이 발생하고 있다(Han et al., 2022). 그 중에 방사성 오염물질 세슘(137Cs)의 경우에는 비교적 긴 반감기(~30년)와 높은 용해도를 갖고 있어 타 방사성 원소들에 비해 위험도가 높고 처리가 어려운 오염물질로 알려져 있다(Park et al., 2023). 특히, 흡착제 활용 시 Cs은 상대적으로 작은 수화 반지름(hydrated radius)을 갖고 있고 +1가 양이온으로 존재하여 일반적인 흡착 반응(정전기적 인력, 물리적 흡착, 복합 반응 등)으로 제거가 어렵기 때문에 선택적으로 Cs 제거가 가능한 흡착제 개발이 필요하다. 대표적인 Cs 제거용 흡착제들에는 층상 황화 금속 물질(layered metal sulfide), 타이타노실리케이트, 그리고 프러시안 블루(Prussian blue)가 있다(Yang and Cho, 2021; Ye et al. 2022). 흡착제 내부에 있는 K+와의 이온 교환(ion exchange)을 통해 방사성 오염물질들을 제어하여 흡착 효율이 높다는 특징이 있다. 또한, 빠른 흡착 속도, 높은 흡착 용량, 그리고 높은 선택성을 장점으로 하고 있어 많은 연구자들은 Cs 흡착 제거 시 이온 교환 기반 흡착제를 활용하고 연구하고 있다(Tang et al., 2022). 그러나 뛰어난 흡착 능력에도 불구하고 작은 분말 형태를 갖고 있어 회수가 용이하지 않다.
그래서 최근에는 흡착제 적용성을 높이기 위한 일환으로 흡착제를 자성화(magnetization)하는 방안이 연구되고 있다(Seema, 2020; Yang et al., 2018). 일반적인 철 공침법(co-precipitation, 수중에 Fe 이온과 흡착제를 혼합하고 pH를 높여 자성화 시키는 방법)은 방사성 오염물질들이 K+와의 이온 교환을 통해 들어가야 할 흡착제의 흡착 장소(층상 또는 표면)에 철 이온(Fe2+이나 Fe3+)들이 대신 들어가서 흡착 용량을 크게 저감시킬 가능성이 있다. 그래서 흡착 고유 용량을 유지하기 위한 흡착제와 자성체를 물리적으로 결합하는 방안이 고려되어야 한다. 예를 들어, 알지네이트/하이드로젤/폴리비닐 알코올 비드 내에 흡착제와 자성체를 함께 고정(immobilization)시키는 방안이 있다(Lee et al., 2019). 그러나 비교적 크기가 큰 비드(5 mm 이상)로 흡착제를 고정시키는 경우에는 이온 투수성 문제로 흡착 속도가 크게 느려지는 경우가 있고, 비드의 상대적 높은 무게 때문에 흡착제 질량 당 방사성 오염물질 흡착 용량이 크게 저하될 수 있다.
그래서 본 연구에서는 이온 교환 기반 흡착제 표면에 나노 자철석(magnetite)를 첨착 시켜 고유의 흡착 용량을 저하시키지 않고, 동시에 흡착 특성에 영향을 거의 미치지 않도록 하는 것을 목표로 하였다. 나노 자철석을 흡착제와 결합시키는 방법은 층상 황화 금속 물질을 합성하는데 사용하는 열수화(hydrothermal treatment) 반응기를 동일하게 사용하였다. 결합 원리는 글루코즈(glucose)가 탄화 되면서 상대적으로 크기가 큰 흡착제(약 10 마이크로) 표면에 나노 자철석 입자들이 붙도록 접착제 역할을 하여 하나의 자성 흡착제가 되도록 하는 것이다. 약 50-100 나노 크기인 자철석이 층상 내부에 들어가지 않고 표면에 붙게 되면서 흡착 용량(이온 교환 장소)을 보존하고 동시에 흡착제가 탄화층(글루코즈 유래 물질)에 의해 분산되는 효과를 기대하였다.
2.1. 실험 재료 및 장치
본 연구에서는 염화세슘(CsCl, 99.9%), 질산(HNO3), 수산화나트륨(NaOH, 96%), 안티모니 산화물(Sb2O3, 99%), 주석 분말(Sn), 황 분말(S, 99%), 탄산 칼륨(K2CO3, 99.5%), 글루코즈(glucose, C6H12O6, ACS reagent), 나노 자철석(Fe3O4, 97%, size range = 50-100 nm), 그리고 아세톤(C3H6O, 99.8%)를 시그마 알드리치(Sigma Aldrich Co., USA)에서 구입하여 사용하였다. 그리고 층상 황화 금속 물질과 자성 Cs 흡착제 제조를 위한 반응기로 100 mL 테플론 처리된 스테인리스 오토클래브(Teflon-lined stainless steel autoclave)를 별도로 제작하여 사용하였다. 실험에 사용한 층상 황화 금속 물질들 KTS-3과 KATS-2는 각각 Sarma et al.(2016)과 Yang and Cho(2021) 연구들의 제조 방법들을 따랐다.
2.2. 실험 방법
2.2.1. 자성 Cs 흡착제(KMG) 제조 방법
자성 Cs 흡착제 KMG 제조 방법은 이해를 돕기 위해 Fig. 1과 같이 모식도로 표현하였다. KTS-3 또는 KATS-2, 나노 자철석, 글루코즈를 준비한 뒤 다음과 같이 무게를 측정하였다. 열수화 반응기에 먼저 DIW를 파이펫(pipet)으로 3 mL 담은 후 글루코즈를 첨가하고 물에 글루코즈가 잘 녹았는지 확인하였다. 글루코즈가 완전히 녹은 다음, 미리 무게를 재어 둔 나노 자철석을 첨가하여 충분히 교반하고, 그 다음 KTS-3 또는 KATS-2를 첨가하고 혼합 물질들이 전부 잘 섞일 수 있도록 충분히 스푼으로 저어주었다. 반응기 캡을 완전히 닫아준 후 오븐에 넣고, 오븐 온도를 160ºC로 설정해주었다. 반응 6시간이 끝난 반응기를 후드 안에서 식힌 후 캡을 해체하였다. 그리고 고체 생성물을 접시(weighing dish)에 덜어서 옮기고 50oC 오븐에서 6시간 이상 건조시켰다. 아세톤 세척을 위해 증류수 30 mL을 conical tube에 담아준 후, 원심 분리를 위해 양쪽 무게를 양팔 저울로 맞춰주었다. 원심분리기에 넣기 전 시료들이 충분히 물과 교반 되어 세척될 수 있도록 충분히 흔들어 준 후 4,000 rpm, 10분으로 설정하여 원심분리 후 상등액은 따라 버리고 새로 증류수 30 mL을 첨가하여 5번 과정을 2번 더 반복하여 총 3번의 증류수 세척 과정을 거쳤다. 상등액을 따라 버린 코니칼 튜브(conical tube)에 아세톤을 30 mL 첨가한 후 증류수 세척 과정과 동일하게 세척 및 원심 분리를 3회 진행하였다. 세척이 완료된 시료를 50oC로 설정된 오븐에 넣은 후 6시간 이상 충분히 건조 시켰다.
2.2.2. Cs 흡착 실험 방법
제조된 KMG 흡착 능력을 평가하기 위한 Cs 흡착 실험은 다음과 같이 진행되었다. 2,000 mL 볼륨 플라스크(volume flask)에 2.53 g CsCl을 첨가한 후 증류수를 채워 1,000 ppm Cs 저장 용액을 제조하고, 희석하여 사용하여 106.2 mg/L Cs 농도로 초기 농도를 설정하였다. 50 mL 코니칼 튜브(conical tube)에 실험에 사용할 시료를 각각 0.02 g씩 담아준다. 이 때, 실험 오차를 줄이기 위해 같은 시료를 3세트씩 만들어 반응 용액을 20 mL씩 첨가해주었다. 교반기에서 24시간 동안 교반 시켜주었다. 이 때 교반기 뚜껑을 덮어두면 마찰 때문에 교반기 내부 온도가 실온보다 많이 높아질 수 있으므로 뚜껑을 연 상태로 교반 시켰다. 교반이 끝나면 4,000 rpm, 10분 조건으로 원심분리하여 0.2 μm 주사기 필터(syringe filter)를 사용하여 상등액을 얻었다. 얻어진 상등액에 HNO3 원액을 1-2방울 첨가하여 산처리 후 보관한 시료 튜브 바닥에 입자가 쌓인 것이 확인 되면 0.2 μm 주사기 필터(syringe filter)를 사용하여 다시 한번 더 여과(filtering)한 후 분석에 사용하였다. 산처리 된 시료를 예상 농도에 맞게 증류수로 희석하여 Cs은 이온크로마토 그래피(IC)로 분석한다. 이 때, 실험에 사용한 반응 용액도 함께 희석 후 분석하였다.
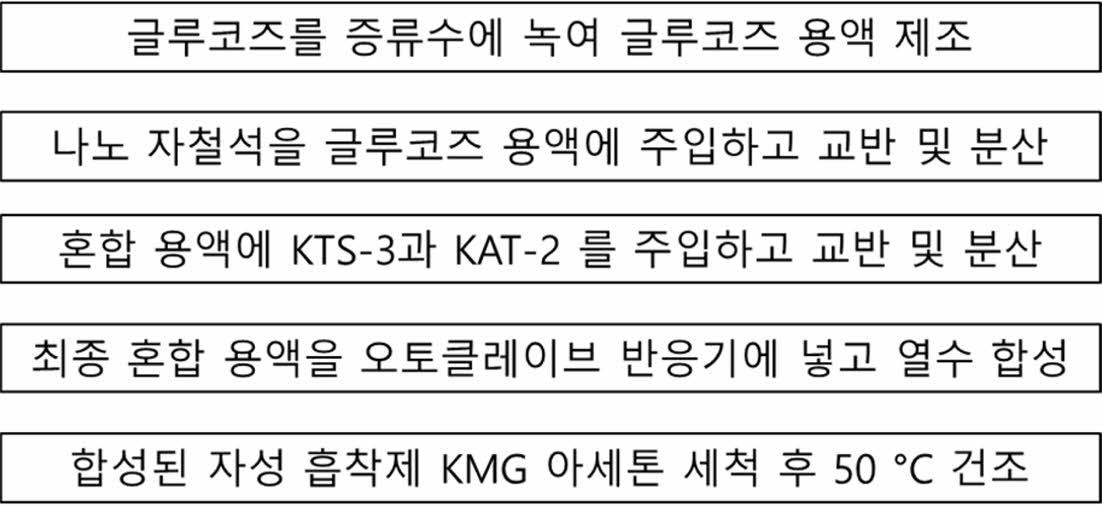
|
Fig. 1 A procedure of magnetic Cs adsorbent (KMG) synthesis. |
3.1. 자성 Cs 흡착제 제조 시 최종 온도 영향
KATS-2, 나노 자철석, 그리고 글루코즈 세 가지 물질들을 결합하여 제조하는 자성 Cs 흡착제는 KATS-2에 비해 동일한 양으로 처리할 수 있는 Cs 흡착 용량은 감소하게 된다. 그래서 최소한의 Cs 흡착 용량 저하를 보이는 KMG 제조 조건을 찾는 것이 필요하다. 우선적으로 열수 합성 시 최종 온도를 선정하기 위해 120-200도까지 설정하여 실험을 수행하였다. KATS-2 : 나노 자철석 : 글루코즈 비율을 1 : 0.1 : 0.2로 설정하고, 반응 온도를 120-200도까지 조절하여 6시간 동안 제조한 자성 Cs 흡착제들을 원물질인 KATS-2 흡착제와 비교하여 실험 결과를 Fig. 2에 나타내었다. 106.2 mg/L Cs 용액에 1 g/L KATS-2 흡착제를 주입했을 때 84.1 mg/g 흡착 제거 용량을 보여주었지만, 자성화 공정을 거친 흡착제들은 첨착된 나노 자철석과 글루코즈에 의해 흡착 제거 용량이 감소하는 경향(84.1 mg/g → 38.0-50.5 mg/g)을 보였다. 그 중 50.5 mg/g Cs 흡착 용량을 보인 160도가 적합한 것으로 나타났다. 200도에서 흡착 용량이 저하된 것은 대부분 층상 황화 금속 물질이 200도에서 열수화 반응(hydrothermal reaction)으로 생성되는 것을 고려할 때 나노 자철석이 KATS-2 흡착제와의 고체상 반응(solid-state reaction)이 일어난 것에 기인했을 가능성이 있다. 이러한 고체상 반응으로 인해 본래 KATS-2 가 갖고 있는 Cs 에 대한 흡착 장소들이 감소했을 것으로 사료된다. 그래서 160도에서 고체상 반응을 피하고 글루코즈를 탄화 시키는 것이 타당하다고 판단되었다.
3.2. 자성 Cs 흡착제 제조 시 글루코즈 함량이 미치는 영향
본 연구에서는 자성 Cs 흡착제 제조 시 고온에서 글루코즈가 탄화하여 흑연층을 생성하면서 나노 자철석이 층상 황화 금속 물질 표면에 붙어있도록 하는 것이 중요하다. 글루코즈 대신 키토산을 활용하여 점토 광물과 나노 자철석을 결합시킨 Cho et al.(2012) 이전 연구를 보면, Cu(II)와 As(V) 오염물질 처리 효율이 투입된 물질들의 조합 비율에 따라 크게 변화하는 것을 확인한 바 있다. 특히, 나노 자철석과 점토 광물을 결합시키는 역할을 한 키토산의 함량이 주요 인자인 것으로 나타나 본 연구에서도 글루코즈 함량이 미치는 영향을 알아보는 실험을 수행하였다. 반응 온도 160도에서 글루코즈 함량을 0.2에서 1.0 g까지 증가시킨 경우 실험 결과를 Fig. 3에 나타내었다. 글루코즈 0.4 g 인 경우 54.8 mg/g로 Cs 흡착 용량이 가장 높은 것으로 나타났다(KATS-2 흡착 용량이 약 34.8%만큼 저감). 글루코즈 0.2 g에서 보다 낮은 Cs 흡착 용량을 보인 것은 글루코즈 탄화층이 상대적으로 적어 나노 자철석이 KATS-2 표면에 고르게 분산되지 못한 것으로 추정한다. 결과적으로 1 : 0.1 : 0.4(160도) 조건으로 층상 황화 금속 물질을 기반의 자성 Cs 흡착제를 제조하는 것이 적합하다고 판단되었다.
3.3. 자성화 공정이 층상 황화 금속 물질 고유 흡착 능력에 미치는 영향
동일한 조건(1 : 0.1 : 0.4, 160도)으로 KTS-3를 이용하여 자성화한 경우에도 Cs 흡착 용량이 약 33.2%만큼 감소하여 108.1 mg/g에서 72.24 mg/g까지 저감 되었다(Fig. 4a). 이는 KATS-2를 자성화한 경우(약 34.8% 만큼 감소)와 비슷한 흡착 용량 감소 효과이다. 그리고 물리적으로 나노 자철석이 KTS-3 표면에 결합되지 않은 경우를 피하기 위해 자성 회수 공정을 별도로 거쳤다. 자성 회수 공정(KMG 획득)을 위해 25 mL 비커에 자성 분리에 사용할 시료를 담고, 원래 시료가 담겨있던 50 mL 코니칼 튜브(conical tube)는 자성 분리 되지못한 시료 회수를 위해 준비해두었다. 시료가 담긴 비커에 DIW 10 mL 첨가하여 시료를 부유 시킨 후 자석을 대고 자성 분리 되지 않은 부유 물질은 따라 버렸다. 동일하게 3회 이상 반복 후 자성 분리된 흡착제가 남아있는 비커 그대로 50oC 오븐에 넣고 충분히 건조 시켰고, 자성 분리 되지 않은 남은 시료들은 다시 자성체 첨착 공정의 원물질로 활용하였다. 자성 회수율은 약 50%였고, 자성 회수된 시료만 자성 Cs 흡착제(KMG)로 명명하였다. KMG의 Cs 흡착 용량은 약 49.8 mg/g으로 자성화 시킨 흡착제 대비 약 31.1% 감소한 것으로 나타났다. 결과적으로 제조된 KMG의 흡착 용량은 원재료(KTS-3) 대비 약 50% 수준이었다.
Fig. 4a에서 나타난 Cs 흡착 용량 결과를 토대로 원재료 KTS-3의 흡착 용량을 계산하여 Fig. 4b에 나타냈다. 결과적으로 KTS-3의 흡착 용량은 99.6-108.36 mg/g 수준으로 보이면서 글루코즈와 나노 자철석이 결합하면서 발생할 수 있는 흡착 용량 손실은 거의 나타나지 않았다. 이는 철 공침 방법과 달리 열수화 처리 방법은 자성화 공정 이후에도 층상 황화 금속 물질의 고유의 흡착 용량을 유지할 수 있음을 증명하였다.
Fig. 5는 KTS-3과 KMG의 XRD 분석 결과이다. 원재료로 사용된 KTS-3 물질은 전형적인 K2(Sn2S5) 구조의 층상 황화 금속 물질의 성상(JCPDS No. 81-1011)을 보였다. 그리고 KMG의 XRD 스펙트럼을 보면 Fe3O4 (JCPDS No. 74-0748) 해당하는 피크(peak)들이 관찰되면서 KTS-3 흡착제 표면에 자철석 입자들이 붙어있는 것을 확인할 수 있다. 자성 회수한 분말들(KMG)의 XRD 분석 결과임을 고려할 때, 나노 자철석이 글루코즈 탄화층에 의해 층상 황화 금속 물질 표면에 안전하게 첨착 되어 있음을 확인할 수 있다.

|
Fig. 2 Cs+ adsorption capacities of KATS-2 based adsorbents (KATS-2: magnetite: glucose = 1 : 0.1 : 0.2) fabricated at different final temperatures (120-200oC). |

|
Fig. 3 Cs+ adsorption capacities of KATS-2 based adsorbents fabricated at different mass ratios of glucose (mass ratio range of glucose: 0.2-1). |

|
Fig. 4 (a) Cs+ adsorption capacities of KTS-3 based adsorbents under different conditions (b) Calculated Cs+ adsorption capacities of KTS-3 inside the adsorbents. |
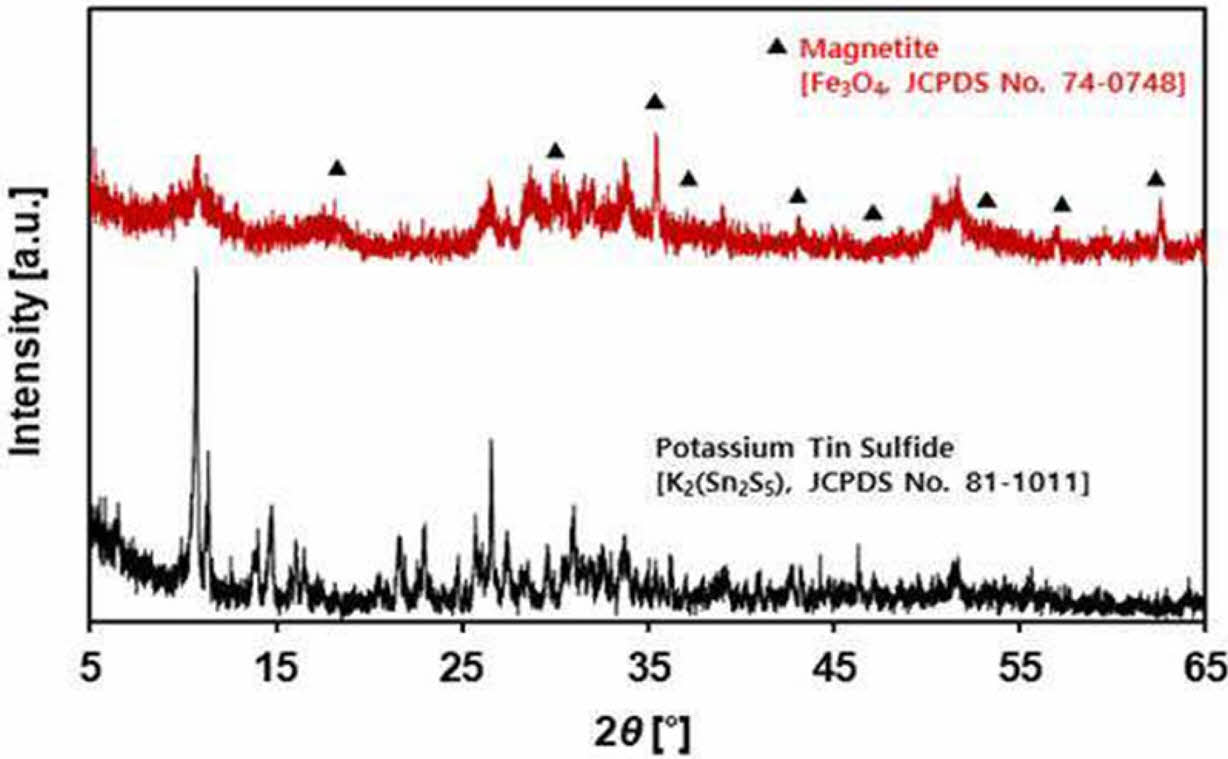
|
Fig. 5 XRD spectra of KTS-3 and KMG adsorbents. |
본 연구에서는 열수화 처리를 통해 나노 자철석과 글루코즈를 층상 황화 금속 물질에 결합시켜 자성화시키는 연구를 수행하였다. 결과적으로 최종 온도 160도와 1 : 0.1 : 0.4(층상 황하 금속 물질 : 나노 자철석 : 글루코즈) 혼합 비율이 자성화를 위한 최적 조건으로 나타났다. 개발된 자성화 방법은 층상 황화 금속 물질의 세슘 고유 흡착 용량 손실을 거의 일으키지 않고 자성 흡착제를 제조하는 것이 가능하였다. 그리고 자성 회수되지 않은 물질들(나노 자철석이 붙지 않은 것으로 추정되는 흡착제)은 다시 원재료로 활용하면 재료 손실을 방지할 수 있다.
본 연구는 원자력안전위원회의 재원으로 한국원자력안전재단의 지원을 받아 수행한 원자력안전연구사업의 연구결과이며(No. 00231329), 부분적으로 한국지질자원연구원 기본사업 “실시간 도시지역 산사태 조기경보기술 및 지질환경 오염물질 위험관리기술 개발(23-3412)” 과제에서 지원받아 수행하였다.
- 1. Cho D.W., Jeon, B.H., Chon, C.M., Kim, Y., Schwartz, F.W., Lee, E.S., and Song, H., 2012, A novel chitosan/clay/magnetite composite for adsorption of Cu(II) and As(V), Chem. Eng. J., 200-202, 654-662.
-

- 2. Han, W.X., Huang, Y., Su, M.H., Liu, H.Y., Shen, C.J., Zhou, Y., Ou, T., and Chen, D.Y., 2022, Highly selective adsorption and lattice process of cesium by cubic cyanide-based functional materials, Environ. Res., 214(4), 114085.
-

- 3. Lee, I., Park, C.W., Yoon, S.S., and Yang, H.M., 2019, Facile synthesis of copper ferrocyanide-embedded magnetic hydrogel beads for the enhanced removal of cesium from water, Chemosphere, 224, 776-785.
-

- 4. Park, S.J., Shin, S.S., Jo, J.H., Jung, C.H., Park, H., Park, Y.I., Kim, H.J., and Lee, J.H., 2023, Tannic acid-assisted in-situ interfacial formation of Prussian blue-assembled adsorptive membranes for radioactive cesium removal, J. Hazard. Mater., 442, 129967.
-

- 5. Sarma, D., Malliakas, C.D., Subrahmanyam, K.S., Islama, S.M., and Kanatzidis, M.G., 2016, K2xSn4-xS8-x (x=0.65-1): a new metal sulfide for rapid and selective removal of Cs+, Sr2+ and UO22+ ions, Chem. Sci., 7, 1121-1132.
-

- 6. Seema, H., 2020, Novel self assembled magnetic Prussian blue graphene based aerogel for highly selective removal of radioactive cesium in water, Arab. J. Chem., 13(2), 4417-4424.
-

- 7. Tang, J.H., Jin, J.C., Li, W.A., Zeng, X., Ma, W., Li, J.L., Lv, T.T., Peng, Y.C., Feng, M.L., and Huang, X.Y., 2022, Highly selective cesium(I) capture under acidic conditions by a layered sulfide, Nat. Commun., 13(658).
-

- 8. Yang, C. and Cho, K., 2021, Rapid and selective removal of Cs+ from water by layered potassium antimony thiostannate, J. Hazard. Mater., 403, 124105.
-

- 9. Yang, H.M., Hwang, J.R., Lee, D.Y., Kim, K.B., Park, C.W., Kim, H.R., and Lee, K.W., 2018, Eco-friendly one-pot synthesis of Prussian blue-embedded magnetic hydrogel beads for the removal of cesium from water, Sci. Rep-Uk, 8, 11476.
-

- 10. Ye, Z.Y., Zhang, Y., Hou, L.A., Zhang, M.L., Zhu, Y.Z., and Yang, Y., 2022, Preparation of a GO/PB-modified nanofiltration membrane for removal of radioactive cesium and strontium from water, Chem. Eng. J., 446(3), 137143.
-

 This Article
This Article
-
2023; 28(4): 1-5
Published on Aug 31, 2023
- 10.7857/JSGE.2023.28.4.001
- Received on Jul 31, 2023
- Revised on Aug 4, 2023
- Accepted on Aug 23, 2023
 Services
Services
Shared
 Correspondence to
Correspondence to
- Dong-Wan Cho
-
1Mineral Resources Division, Korea Institute of Geoscience and Mineral Resources
- E-mail: dwcho@kigam.re.kr





