- Abundance and Diversity of Microbial Communities in the Coastal Aquifers in Songji Lagoon, South Korea
Jung-Yun Lee1,2·Dong-Hun Kim1*·Woo-Hyun Jeon1·Hee Sun Moon1
1Groundwater Environment Research Center, Climate Change Response Division,
Korea Institute of Geoscience and Mineral Resources, Daejeon 34132, Republic of Korea
2Department of Biological Sciences and Biotechnology, Chungbuk National University, Cheongju 28644, Republic of Korea- 송지호 해안 대수층 미생물 군집의 풍부도 및 다양성
이정윤1,2·김동훈1*·전우현1·문희선1
1한국지질자원연구원 기후변화대응연구본부 지하수환경연구센터
2충북대학교 생명시스템학과This article is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
The Songji lagoon is brackish environment with a mixture of saline and fresh water, and the interaction of groundwater-lagoon water creates a physicochemical gradient. Although some studies have been conducted on the hydrological and geochemical characteristics of the Songji lagoon, microbial ecological studies have not yet been conducted. In this study, we investigated the effect of groundwater and surface water interaction on water quality as well as microbial community changes in the Songji Lagoon using 16S rRNA gene sequencing. Hydrochemical analyses show that samples were classified as 5 hydrochemical facies (HF) and hydrochemical facies evolution (HFE) revealed the intrusion phase was more dominant (57.9%) than the freshening phase (42.1%). Higher microbial diversity was found in freshwater in comparison to saline water samples. The microbial community at the phylum level shows the most dominance of Proteobacteria with an average of 37.3%, followed by Bacteroidota, Actinobacteria, and Patescibacteria. Heat map analyses of the top 18 genera showed that samples were clustered into 5 groups based on type, and Pseudoalteromonas could be used potential indicator for seawater intrusion.
Keywords: Lagoon, Coastal aquifer, Microbial diversity, Microbial community, Seawater intrusion
연안 대수층은 해양 환경에서 중요한 담수 공급원이며 해양과 지하수를 연결하는 핵심적인 수리지구화학적 구성요소이다(Re et al., 2013; Robinson et al., 2018). 연안 대수층과 해수의 상호작용은 지하수위와 해수면 변동으로 인한 수두구배와 다양한 해양학적 메커니즘에 의해 영향을 받으며, 이러한 상호작용을 이해하기 위해서는 삼각주, 하구, 석호와 같은 연안 지질학적 단위에 대한 정보를 얻는 것이 중요하다(Viezzoli et al., 2010; Ahmed et al., 2018; De Souza et al., 2021). 그러나 대부분의 연구는 삼각주와 하구의 환경 변화에 초점을 맞추고 있으며 석호에 대한 연구는 부족한 실정이다.
석호는 담수와 해수가 혼합된 기수호로 정의되며 사주나 사취와 같은 퇴적 지형에 의해 인접한 해양으로부터 영구적으로 개방되거나 간헐적으로 차단될 수 있는 지역이다(Duck et al., 2012). 홀로세 해수면 변화 동안 형성된 지형으로 세계 해안선의 약 13%가 석호로 구성되어 있으며(Barnes, 1980), 석호는 독특한 생지화학적 작용이 일어나는 지역으로 생물학적 다양성이 높고, 다양한 수생생물들의 산란처와 피란처를 제공할 뿐만 아니라 관광객과 주민에게 심미적 공간을 제공하는 역할을 한다(Kwak et al., 2005; Niencheski et al., 2007).
해안 석호의 지질학적 및 생태학적 중요성에 대한 인식이 높아짐에 따라 최근 몇 년 동안 해안 석호와 지하수의 수문학적 상호작용을 이해하기 위한 다양한 연구가 수행되었다. 미국 Malibu Lagoon의 경우 환경 추적자(environmental tracer, Rn-222)를 이용하여 석호로 유입되는 지하수를 정량적으로 평가하였으며 이와 더불어 지하수-지표수 상호작용에 따른 총 용존질소(total dissolved nitrogen, TDN)의 생지화학적 거동에 대한 평가도 이루어졌다(Dimova et al., 2017). 스페인 La Pletera Lagoon에서는 해안 석호의 수문학적 순환에서 계절에 따른 지하수 유입량을 산정하여 의존도를 분석하였으며(Menico et al., 2017), 뉴질랜드의 Te Waihora/Lake Ellesmere Lagoon에서는 지하수로부터 유입되는 영양염의 부하를 용존 이온, 동위원소, 영양염 분석을 통해 산정하는 연구를 수행하였다(Coluccio et al., 2021).
해안 석호는 지리적 위치로 인해 염분, 영양염, 유기물 함량 등의 물리화학적 구배가 매우 큰 이질적인 시스템으로 이러한 독특한 기수환경에서의 생존을 위해 미생물의 생리학적 다양성이 요구된다(Cadena et al., 2019). 미생물 군집은 환경 변수에 영향을 크게 받기 때문에 연안 시스템의 하구 구배에 따라 군집의 분포와 구성에 급격한 변화를 가져오게 되며 이러한 변화는 결국 연안 생태계의 물질순환과 생산성에 영향을 미치게 된다(Gifford et al., 2014; Richa et al., 2017). 최근 분자생물학 기술의 개발로 이러한 연안 생태계에서 미생물의 다양성과 기능에 대한 연구가 일부 수행되었다. 인도의 염수 해안 석호인 Chilika에서는 환경 요인에 따른 군집의 풍부도 변화 관찰을 통해 α-Proteobacteria, Actinobacteria, β-Proteobacteria가 우점하고 있는 것을 확인하였고, 분류군 별 절대 풍부도와 지표 분석을 통해 해양 환경에서 널리 분포하는 플랑크톤 세균(planktonic bacteria)인 SAR11이 여름과 겨울철 고염분 환경에서 주로 발견되어 염분 구배의 지표로서의 활용 가능성에 대해 보고된 바 있다(Tarafdar et al., 2021). 멕시코 남부의 Celestun 석호에서는 담수, 염수, 혼합지역에 특이적인 미생물 분류군이 검출되었으며, 담수 지역에서는 혐기성 메탄생성균과 메탄영양균이 주로 발견되는 반면 염수 지역에서는 Sandaracinaceae, Ami- nicenantes와 Thaumarchaeota가 주로 발견되었다. 또한, 혼합지역에서는 Flavobacteriaceae와 Syntrophobacteraceae가 풍부하게 존재하는 것을 확인하였다(Cadena et al., 2019). 이와 같이 연안 석호에서의 미생물 군집의 구성 및 분포에 대한 연구는 연안 생태계의 기능을 체계적으로 이해하기 위한 정보를 제공할 수 있다.
한반도 동해안에는 7개의 큰 석호와 11개의 작은 석호가 연속적으로 분포하고 있으며, 그 중 송지호는 5번째로 큰 자연 호수로 동해안에 존재하는 석호들 중 원형이 잘 유지되어 있다(Yoon et al., 2008; Yum et al., 2015). 그러나 최근에 기후변화와 같은 자연적 요인과 석호 주변의 산업화와 관광지로 개발되는 등의 인위적 요인으로 인해 오염물질이 석호로 유입되어 수질이 악화되고 석호의 생태계가 파괴되고 있다(Jeon et al., 2021). 송지호는 인근의 대수층과 연결되어 있어 지하수의 영향을 받는 지하수의존생태계이기 때문에 석호 생태계 파괴는 연결된 두 수계의 수질을 동시에 악화시킬 수 있으므로 체계적인 관리 보전이 필요하다.
본 연구에서는 보존가치가 높은 연안 석호인 송지호의 지하수-지표수 상호작용 특성을 파악하기 위하여 송지호 주변의 지하수, 석호수, 하천수, 해수의 물리화학적 및 미생물학적 특성 분석을 수행하였다. 이러한 연구는 석호 수질 관리 및 생태계 안정성 유지를 위한 기초자료로 활용될 수 있다.
2.1. 연구 지역
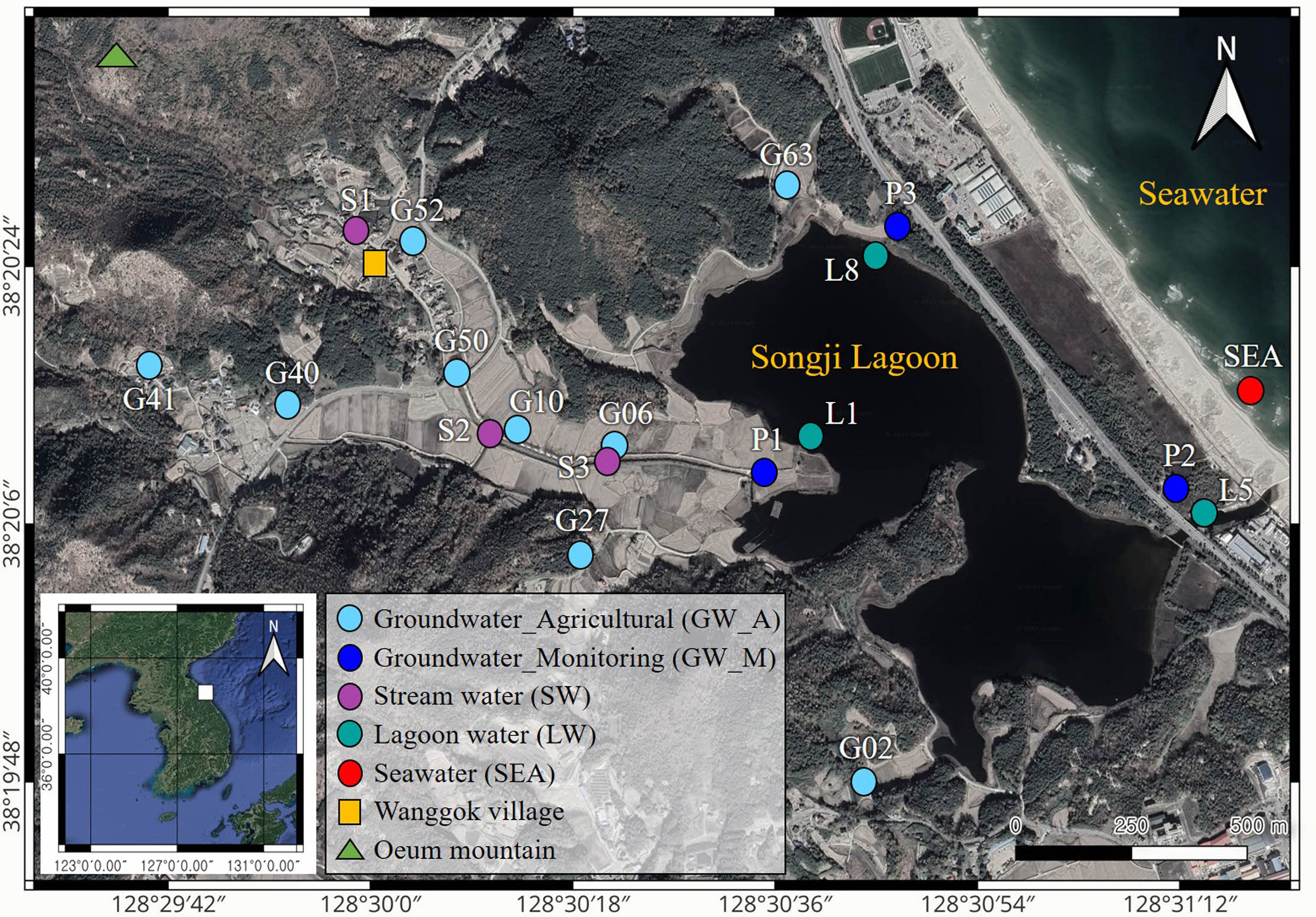
송지호는 행정구역상으로 강원도 고성군 죽왕면에 위치하며 전체 면적 약 0.6 km2, 둘레 5.6 km, 유역 면적 5.4 km2, 최대 수심 4.2 m의 규모로 중앙부의 구릉지를 기준으로 북호와 남호로 구분된다(Yoon et al., 2008; Yum et al., 2015; Jeon et al., 2021). 송지호는 해안과의 조석차가 약 50 cm 정도이며 최근 10년간 연평균 강수량은 1,100 – 2,100 mm(평균 1,390 ± 290 mm) 범위이며 대부분 여름철인 7월과 8월에 집중된다(Korea meteoro- logical administration, KMA). 평균 기온은 12.8oC이며 -12.8 – 35.5oC의 범위를 보인다. 송지호 주변은 얕은 산지, 농지, 바다로 이루어져 있으며, 이 일대는 중생대 백악기 속초화강암이 기반암을 이루고 신생대 제4기 충적층으로 피복되어 있다(WREA, 2019; Kim et al., 2023). 송지호는 오음산으로부터 유입하는 수계와 왕곡마을로부터 유입되는 수계가 합류하여 송지호로 유입되고 있으며, 남동쪽 송지호교 부근에서 해수와 연결되는 통로가 있다(Jeon et al., 2021; Fig. 1). 송지호와 해안은 평상시에는 사빈과 사구에 의해 250 m 내외로 격리되어 있으나, 여름철 집중되는 강우로 인해 석호수의 수위가 증가하여 담수가 해수로 유입되는 갯트임 현상이 발생한다(Jeon et al., 2021).
2.2. 시료 채취
시료는 2021년 6월 초에 송지호 인근의 농업용 지하수 관정 9지점, 모니터링 지하수 관정 3지점, 석호수 3지점, 하천수 3지점, 해수 1지점을 대상으로 채취하였다(Fig. 1). 현장 수질(수온, 전기전도도, pH, 용존산소, 산화환원전위)은 휴대용 수질측정장비(Multi 3620 IDS, WTW, Ger- many)를 이용하여 측정하였으며, 현장 수질이 안정화된 후 시료를 채취하였다. 미생물 분석을 위해 지하수는 4 L, 석호수와 하천수, 해수는 각각 2 L씩을 무균 채수병에 채취하였고, 0.22 μm Sterivex filter(Merck Millipore, USA)를 이용하여 현장에서 여과하였다. 여과된 필터는 각각 멸균된 50 mL conical tube에 넣고 4oC 내외로 보관하여 실험실로 운반한 뒤 -20oC에 보관하였다. 여과된 물은 주요 용존 양이온(Na+, Ca2+, Mg2+, K+)과 용존 음이온(Cl-, NO3-, SO42-, HCO3-) 분석에 사용하기 위해 각각 30 mL 폴리에틸렌 용기에 채취하였다. 용존 양이온 시료는 용기 벽면 흡착과 침전을 방지하기 위해 현장에서 질산(HNO3)을 첨가하여 pH 2 이하로 유지하였고, 수집된 시료는 4oC 내외로 보관하여 실험실로 운반하였다.
2.3. 주요 용존 이온 분석
지하수, 석호수, 하천수, 해수 시료의 주요 용존 양/음이온 농도는 각각 유도결합 플라즈마 분광 광도계(In- ductively coupled plasma-optical emission spectrometry, Optima 7300 DV, PerkinElmer, USA)와 이온크로마토그래피(Ion-exchange chromatography, ICS-1500, Dionex, USA)를 사용하여 분석하였다. HCO3-(total alkalinity) 농도는 총 알칼리도 측정 시약(TNT 870 kit, Hach, USA)을 첨가하여 나타나는 발색반응을 분광 광도계(DR-1500, Hach, USA)를 이용하여 측정하였다. Na+, Ca2+, Mg2+, K+, Cl-, NO3-, SO42- 농도의 검출한계는 각각 0.1, 0.02, 0.1, 0.01, 0.01, 0.04, 0.05 mg/L이다.
2.4. DNA 추출 및 염기서열 분석
염기서열 분석을 위해 시료가 여과된 0.22 μm 필터를 DNeasy PowerWater kit(Qiagen, USA)를 이용하여 제조사의 방법에 따라 genomic DNA를 추출하였다. 차세대염기서열분석(next-generation sequencing, NGS)은 Macrogen Inc.(Korea)의 Miseq(Illumin, USA) 장비를 이용하여 미생물의 16S ribosomal RNA(16S rRNA) 유전자의 V4 영역을 대상으로 제조사의 방법에 따라 수행하였다.
얻어진 paired-end 염기서열은 Qiime 2(v.2022.02)의 q2‐demux plugin을 사용하여 정방향 280 bp, 역방향 210 bp로 trimming하여 demultiplexing한 뒤 quality를 확인하였다(Bolyen et al., 2019). 높은 quality를 가진 염기서열을 선별하기 위해 DADA2 파이프라인을 사용하여 낮은 quality의 서열은 제거하고, 남은 염기서열들에 존재하는 에러를 보정하고 키메라(chimera) 서열을 제거하였다. 이들 중 염기서열이 100% 일치하는 서열들을 하나로 묶어 amplicon sequence variants(ASV)를 구성하였다(Callahan et al. 2016). 구성된 ASV는 q2-phylogeny plugin을 사용하여 mafft method로 alignment를 진행하였으며 Fasttree method로 phylogeny를 분석하였다(Katoh et al. 2002; Price et al. 2010). 각 ASV의 서열정보를 바탕으로 한 미생물 분류는 Silva database(v.138)를 반영하는 Naive Bayes classifier를 사용하였다(Quast et al., 2012). 이렇게 얻은 미생물 분류군 중 세균(bacteria)만 선택적으로 분류되도록 필터링 하였다.
2.5. 미생물 군집 구조 및 다양성 분석
시료에 존재하는 미생물 군집의 구조 및 다양성을 분석하기 위해 Qiime 2(v.2022.02)의 q2-diversity plugin을 사용하여 core-metrics-phylogenetic method로 추출된 염기서열들 중 일부를 무작위적으로 선별하였다. 시료 내 미생물 군집의 다양성을 파악하기 위해 선별된 염기서열을 Shannon's diversity index, Observed Features, Faith's phylogenetic diversity, Evenness 지수를 사용하여 alpha-diversity를 분석하였다. 또한 시료 간 미생물 군집의 다양성을 분석하기 위해 Bray-Curtis distance법을 사용하여 주좌표 분석(principal-coordinate analysis, PCoA)을 수행하였다(Estaki et al., 2020). 각 시료의 미생물의 군집 구성을 문(phylum) 수준에서 보여주는 bar plot은 Qiime 2 (v.2022.02)의 q2-feature classifier plugin을 사용하여 taxa barplot으로 시각화 하였다(Bolyen et al., 2019). 각 시료의 미생물 군집 특성을 속(genus) 수준에서 분석하기 위해 q2-feature table plugin을 사용하여 heatmap으로 시각화 하였다(Hunter et al., 2007).
|
Fig. 1 Study area showing the sampling locations (groundwater, lagoon water, stream water, and seawater) |
3.1. 현장 수질
송지호의 지하수(GW_A, GW_M), 석호수(LW), 하천수(SW), 해수(SEA)의 수온, 전기전도도, pH, 용존산소, 산화환원전위는 시료 채취 시 현장에서 측정하였다(Table 1). 지하수 시료(GW_A, GW_M)의 수온은 13.8 – 18.5oC 범위로 평균 16.2oC로 나타났으며 대체적으로 고른 온도 분포를 보였다. 전기전도도(EC)는 147 – 27,400 μS/cm(median = 236 μS/cm) 범위로 넓은 값을 보였는데 해안가 사주에 위치한 P2와 송지호 경계면에 위치한 P3 시료를 제외하면 평균 303.4 μS/cm의 값을 나타냈다. P2와 P3 시료의 경우 일반적인 지하수에 비해 매우 높은 전기전도도를 갖는 것으로 보아 석호수나 해수의 영향을 받고 있는 것으로 판단된다. 지하수 시료의 pH는 P3 시료를 제외한 모든 시료에서 6.0 – 7.1(평균 6.6)로 대체로 일정하게 나타났다. P3 시료의 경우 다른 지하수 시료에 비해 매우 낮은 pH(pH 4) 값을 보였는데 이는 시료 내에 높은 SO42- 농도에 의한 영향으로 판단된다. 황산염(SO42-)의 경우 기반암에 포함되어 있는 황산염 광물의 용해에 의해 증가될 수 있는데, P3 관정의 시추 코어 이화학 분석을 통해 황산염이 높게 존재하고 있음을 확인하였다(data not shown). 용존산소와 산화환원전위의 경우 각각 2.4 – 8.4 mg/L, -33.1 – 313.5 mV의 범위를 보였다. 대체적으로 연구 지역 내 지하수 시료에서 높은 용존산소와 산화환원전위 값을 보였는데 이는 조사된 관정들이 대부분 심도 20 m 이하의 충적층 관정으로 시료 채취 심도가 10 m 이내 이고, 특히 GW_A 관정은 농업용으로 사용되고 있어 농번기에 지하수 사용량이 많다는 점을 고려하면 주변의 물과 공기와의 접촉에 의한 영향으로 판단된다.
송지호 석호수(LW)의 수온, 전기전도도, pH, 용존산소, 산화환원전위는 각각 24.2 – 28.5oC, 15.2 – 21.4 mS/cm, 7.7 – 8.1, 8.0 – 9.0 mg/L, 69.1 – 179.1 mV의 범위를 보였다. 석호수의 수온은 대기 기온이 반영되었으며, pH는 전체적으로 약 알칼리성으로 나타났다. 석호수는 전체적으로 해수에 가까운 높은 전기전도도 값을 보였으며, L8의 경우 다른 석호수 시료에 비해 낮은 전기전도도를 보였는데 이는 지하수와 같은 담수의 유입 영향으로 판단된다. 석호수의 용존산소와 산화환원전위 값은 높게 측정되었는데 이는 석호수가 대기와 접촉하고 있어 공기의 영향을 받는 것으로 판단된다.
송지호로 유입되는 하천수(SW)의 수온, 전기전도도, pH, 용존산소, 산화환원전위는 각각 23.8 – 25.9oC, 156 – 206 μS/cm, 7.8 – 9.2, 7.7 – 9.8 mg/L, 116.2 – 173.9 mV의 범위를 보였다. 하천수의 수온, pH, 용존산소, 산화환원전위는 석호수와 대체적으로 유사한 값을 보였고 전기전도도는 지하수와 유사하였다. 해수(SEA) 시료는 전형적인 해수의 특징을 보여주었다.
현장 수질 측정 결과, 연구 지역 지하수는 대체적으로 충적층 지하수의 특징을 반영하고 있으나 일부 해안가나 경계면에서는 석호수나 해수의 영향을 받는 것으로 판단된다. 석호수의 경우 해수와 유사한 특성을 보이고 있으며 이는 갯트임 또는 수리전도도가 높은 지역을 통한 해수와의 교환 때문으로 추정되지만 추가적인 연구가 필요하다. 따라서 송지호의 지형학적 특성에 따른 지하수-석호수-해수의 상호작용이 각 시료의 현장 수질에 영향을 미치는 것으로 판단된다.
3.2. 용존 이온 분포 및 수리화학적 특성
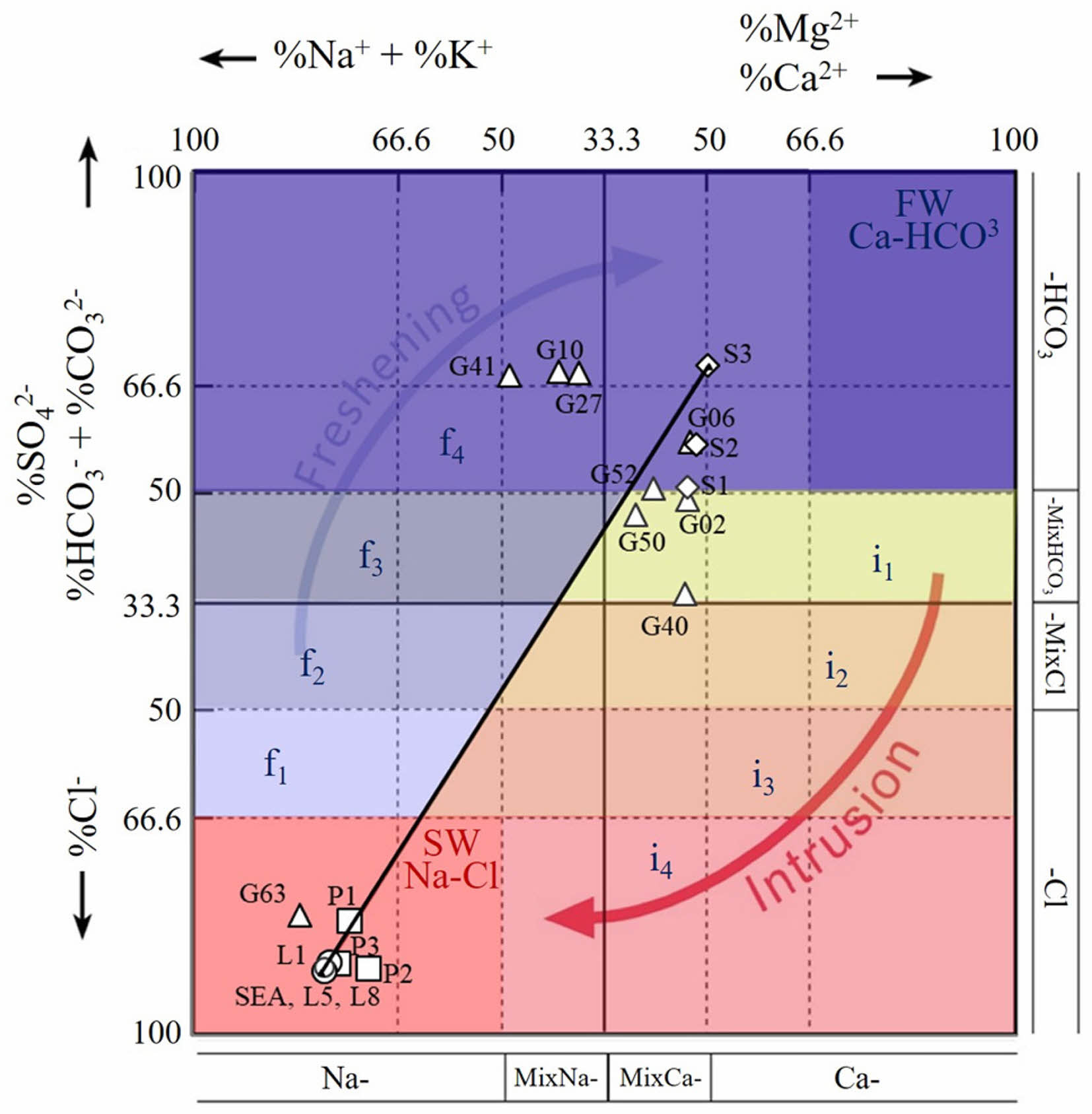
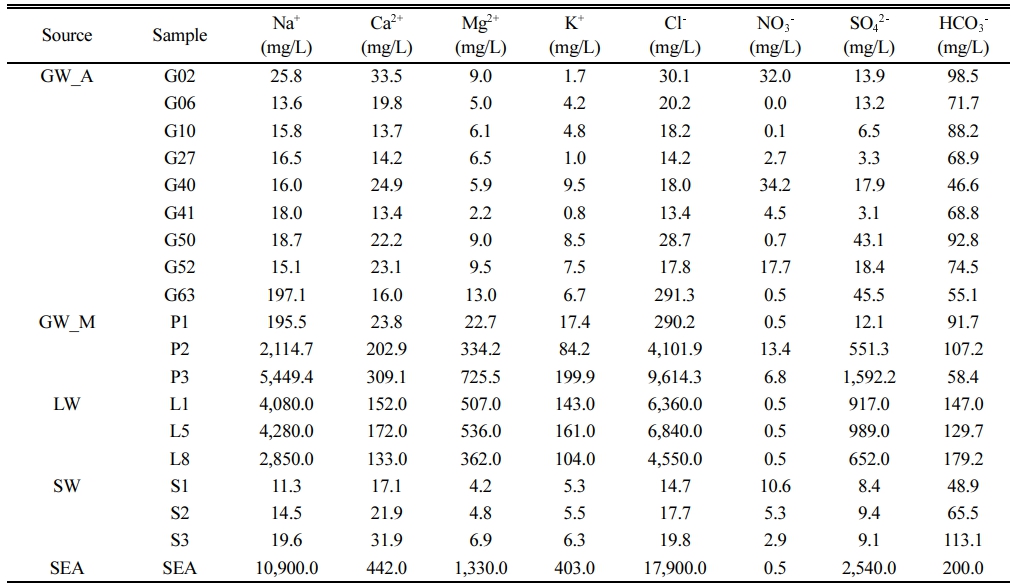
연구 지역에서 채취된 시료(지하수, 석호수, 하천수, 해수)의 수질 유형을 파악하기 위해 주요 용존 양이온과 용존 음이온 농도를 측정하였다(Table 2). 분석된 시료의 전하균형오류(charge balance error, CBE)는 10% 내로 분석의 신뢰성이 높은 것으로 판단되었다. 전반적으로 해수 > 석호수 > 지하수 > 하천수 순으로 이온의 함량이 높게 나타났다. 시료의 수리화학적 특성이 해수 또는 담수의 영향을 받는지를 해석하기 위하여 용존 이온 농도를 Hydrochemical facies evolution diagram(HFE-D)(Giménez- Forcada, 2010)으로 도식화하였다(Fig. 2). 시료들의 Hydrochemical facies(HF)를 분석한 결과, Na-Cl type 8개(G63, L1, L5, L8, P1, P2, P3, SEA), MixCa-HCO3 type 4개(G06, G52, S1, S2), MixNa-HCO3 type 3개(G10, G27, G41), MixCa-MixHCO3 type 3개(G02, G40, G50), Ca-HCO3 type 1개(S3)로 구분되었다. 석호수, 해수, 일부 지하수가 Na-Cl type에 도시되었는데, 이는 현장 수질 결과와 유사하게 염수 또는 해수의 영향을 받아 전기전도도가 높은 시료들이 해당되었다. 대부분의 지하수와 하천수가 Ca/MixCa-HCO3/MixHCO3 type에 도시되었는데, 이는 염수나 해수의 영향보다는 물-암석 반응이나 강우에 반응하는 경우에 해당된다(Ahn, 2012). MixNa- HCO3 type에 도시된 일부 지하수의 경우 상대적으로 긴 체류시간 때문이라 판단된다(Lee and Lee, 2000).
Hydrochemical facies evolution(HFE)을 분석한 결과, 19개의 시료 중 8개의 시료가 freshening sub-stage(f4), 8개의 시료가 intrusion phase(SW), 3개의 시료가 intrusion sub-stage(i1)로 분류되었다. 송지호와 인접한 시료들의 경우 석호수나 해수의 영향을 받아 intrusion sub-stage로 분류되고 비교적 상류에 위치한 시료들은 물-암석반응이나 강우의 영향을 받아 freshening sub-stage 로 분류되는 것으로 판단된다.
3.3. 미생물 군집 다양성 분석
미생물 군집 구조 및 다양성을 분석하기 위해 지하수(GW), 석호수(LW), 하천수(SW), 해수(SEA) 시료를 대상으로 염기서열 분석을 수행한 결과 저품질 서열, 키메라 서열을 제외하고 167,716개의 염기서열을 얻었다. 각 시료당 5,000개의 염기서열을 동일하게 추출하여 분석을 수행하였으며 2,039개의 ASV가 생성되었다. 지하수 시료 중 P3 시료는 DNA 농도가 낮아 군집 분석에서 제외하였다.
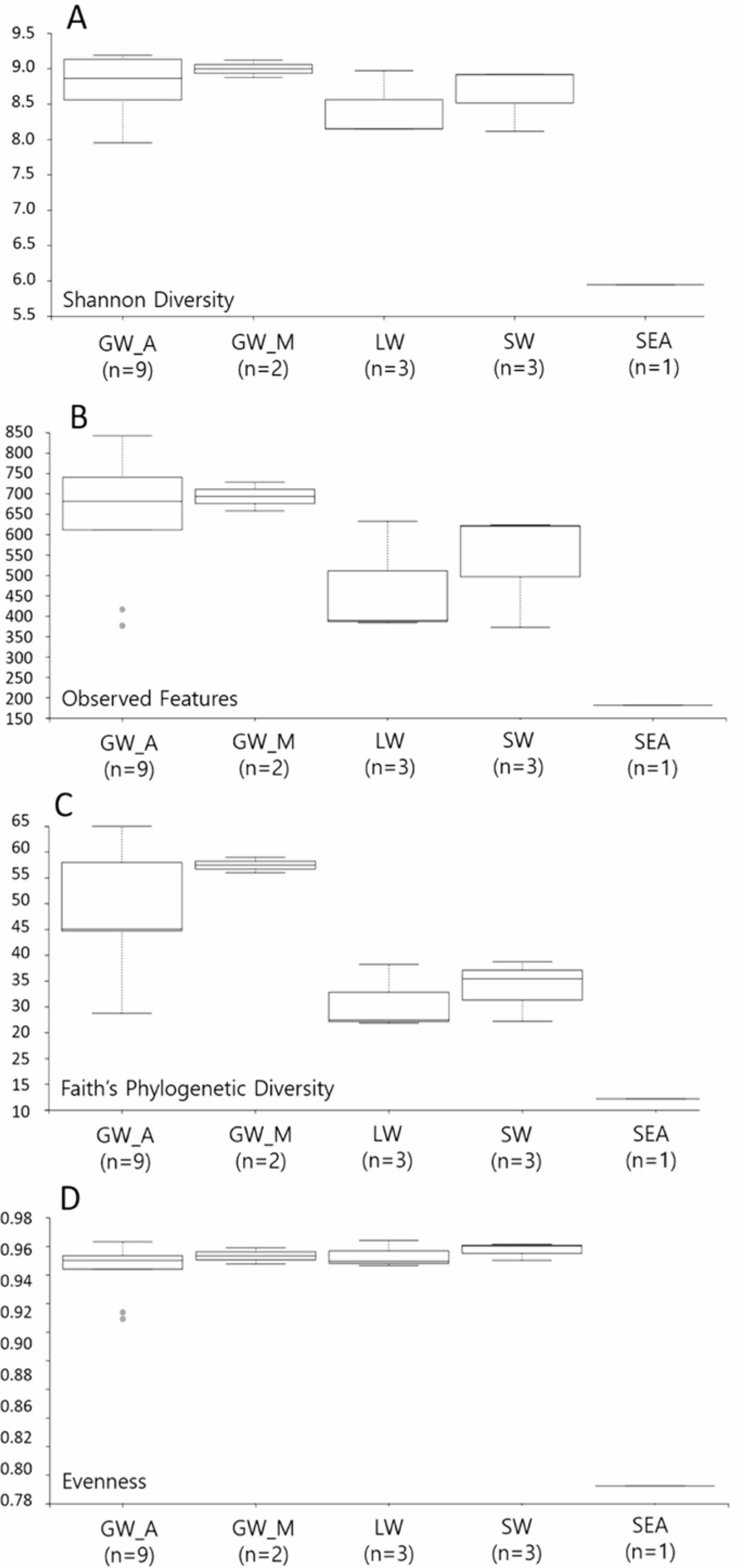
시료 내 미생물 군집의 다양성(diversity)을 분석하기 위하여 Shannon's diversity index(SD), Observed Features (OF), Faith's phylogenetic diversity(FD), Pielou’s evenness (PE) 지수로 alpha-diversity를 분석하였다(Fig. 3). 미생물 군집의 종풍부도(richness)를 정량적으로 나타내는 SD 지수와 정성적인 OF 지수는 담수인 지하수와 하천수가 염수인 석호수와 해수보다 높은 값을 보였다. 염기서열 간의 계통발생학적 관계를 반영된 FD 지수 또한 지하수가 석호수와 하천수보다 1.5배 이상 높은 값을 보였으며 군집의 균등도(evenness)을 나타내는 PE 지수는 지하수와 석호수, 하천수에서 유사하게 나타났다. 해수의 경우 모든 지수에서 가장 낮은 값을 보여주었는데 이는 시료의 수가 적고 높은 염도의 해수에서 생존할 수 있는 미생물이 제한적이기 때문인 것으로 판단된다. 전체적으로 종풍부도 지수는 지하수에서 가장 높게 나타났으며 하천수, 석호수, 해수 순으로 관찰되어 담수인 지하수와 하천수에서 다양성이 높은 것으로 나타났다. 균등도 지수는 해수를 제외하고 전체적으로 높은 값을 보였으며 시료마다 그 차이가 크게 관찰되지 않아 미생물종이 균등하게 분포하는 것으로 판단된다. 석호수, 하천수, 해수 시료는 지하수 시료에 비해 비교적 적은 수의 샘플로 분석되었지만 시료에 따라 미생물 군집의 종풍부도에 차이가 있는 것을 확인할 수 있었다.
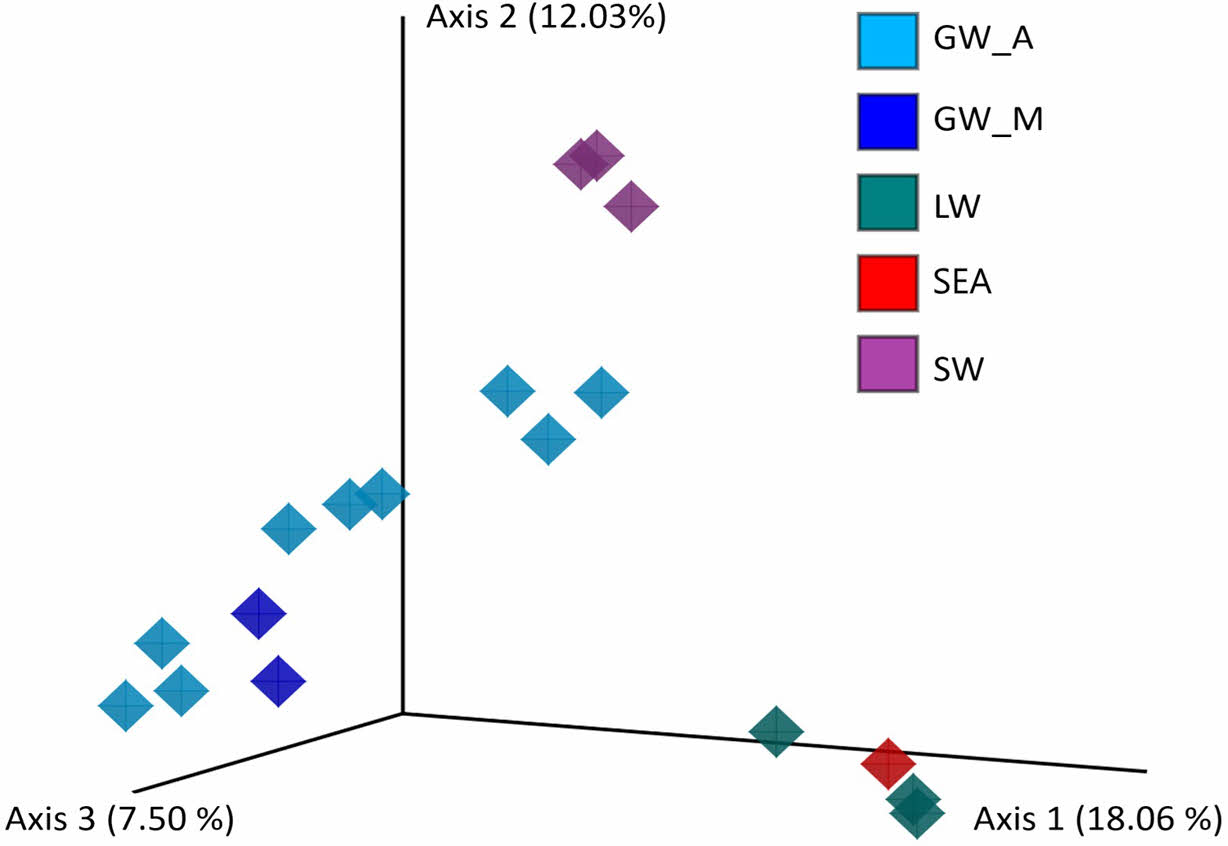
또한 Bray-Curtis distance법을 사용하여 주좌표 분석(principal-coordinate analysis, PCoA)을 수행하여 시료 간 미생물 군집의 다양성을 나타내는 beta-diversity를 분석한 결과, 시료의 유형에 따라 그룹화되는 것을 확인하였다(Fig. 4). 지하수 시료의 경우 모니터링 관정(GW_M)과 농업용 관정(GW_A)시료가 하나의 그룹으로 형성되었으며, 석호수는 해수와 그룹을 이루고 하천수가 하나의 그룹으로 형성되었다. 해수의 영향을 받아 높은 전기전도도 값을 갖는 지하수 시료(P2)의 경우도 다른 지하수 시료와 유사한 군집을 유지하는 특징을 보였다. P2 시료의 경우 일반 지하수보다 높은 전기전도도를 보였으나 전체적인 수질이 지하수와 해수의 특징을 모두 갖고 있기 때문에 미생물 군집의 다양성과 전체적인 구성이 지하수와 더 유사한 경향성을 보이는 것으로 판단된다.
3.4. 미생물 군집 구조 비교
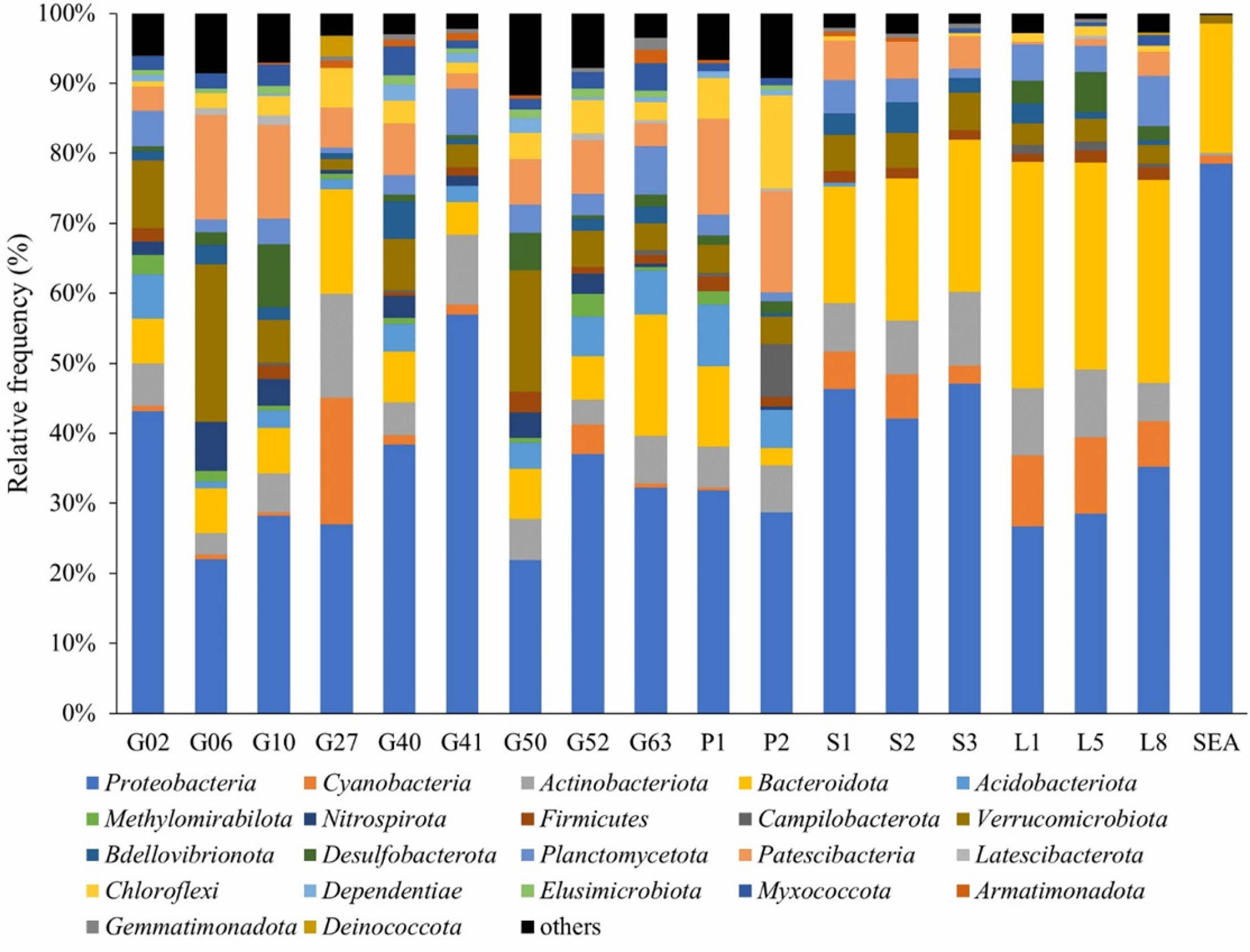
각 시료에 존재하는 미생물 군집 구성의 상대적 풍부도(relative frequency)를 문(phylum) 수준에서 분석한 결과, 미분류군 그룹(other)을 포함하여 총 23개의 문으로 구성되었다(Fig. 5). 이 중 Proteobacteria가 가장 높은 비율을 차지하였으며 Bacteroidota, Actinobacteriota, Patescibac- teria, Verrucomicrobiota, Cyanobacteria 순으로 존재하였다. Proteobacteria는 지구상에서 가장 다양하고 풍부한 미생물 문(Spain et al., 2009; Zhou et al., 2020) 중 하나로, 전체 시료에서 평균 37.3%를 차지하고 있으며 최소 21.9%(G50)부터 최고 78.5%(SEA)까지 폭넓게 분포하고 있었다. Bacteroidota는 담수와 해수를 포함한 다양한 수생 서식지에서 발견되는 문으로 유기 탄소 순환에 관여하는 것으로 알려져 있으며(O'Sullivan et al., 2006), 전체 시료에서 평균 14.4%를 차지하고 최소 2.5%(P2)부터 최고 32.3%(L1) 비율로 분포하고 있다. 수생 및 토양 생태계에 폭넓게 존재하며 유기물의 분해와 질소 순환에 관여하는 것으로 알려진 Actinobacteriota(Zhang et al., 2019)는 전체 시료에서 평균 7.0%를 차지하고 최소 0.3% (SEA)부터 최고 14.8%(G27) 범위로 분포하고 있었다. 나머지 Patescibacteria, Verrucomicrobiota, Cyanobacteria는 평균 6% 이하를 차지하고 있으며 시료마다 다양한 비율로 존재하고 있었다.
일부 지하수 관정 시료(G06, G10, G50, P1, P2)에서 Patescibacteria, Verrucomicrobiota가 각각 평균 12.6%와 10.8%로 높게 존재하였는데, 이 두 미생물은 최근에 지하수에서 많이 발견되고 있으나 정확한 기능에 대해서는 알려져 있지 않아 추후 관심을 가질 필요가 있다(Tian et al., 2020; Bärenstrauch et al., 2022). Cyanobacteria는 해양 및 담수 환경에 널리 분포하고 있는 호기성 광합성 미생물(Hu and Rzymski, 2019)로 하천수 시료(SW)와 석호수(LW) 시료에서 주로 발견되나 일부 지하수(G27) 시료에 높게 존재하였다. 이는 G27이 농지에 위치한 충적 관정이며 시료 채취 시기가 농번기 였던 점을 고려하면 지하수가 농업용수로 사용되면서 주변 지표수가 관정 내로 유입되어 나타난 현상으로 예측된다. 또한, 석호수 시료(L1, L5, L8)에서는 Cyanobacteria가 평균 9.2%로 높게 존재하였는데, 이는 Cyanobacteria가 높은 수온과 약 알칼리성의 조건을 선호(Hu and Rzymski, 2019)하며 석호수의 환경이 이와 유사하기 때문으로 추정된다. 석호수 시료와 하천수 시료의 경우 시료 위치에 관계없이 유사한 군집 구조를 갖는 것으로 나타났으며, 지하수 시료는 위치에 따라 군집 구성이 매우 다양한 특징을 보였다. 해수 시료는 종풍부도와 균등도 지수가 낮게 반영되어 매우 단순한 군집 구조를 갖고 있다.
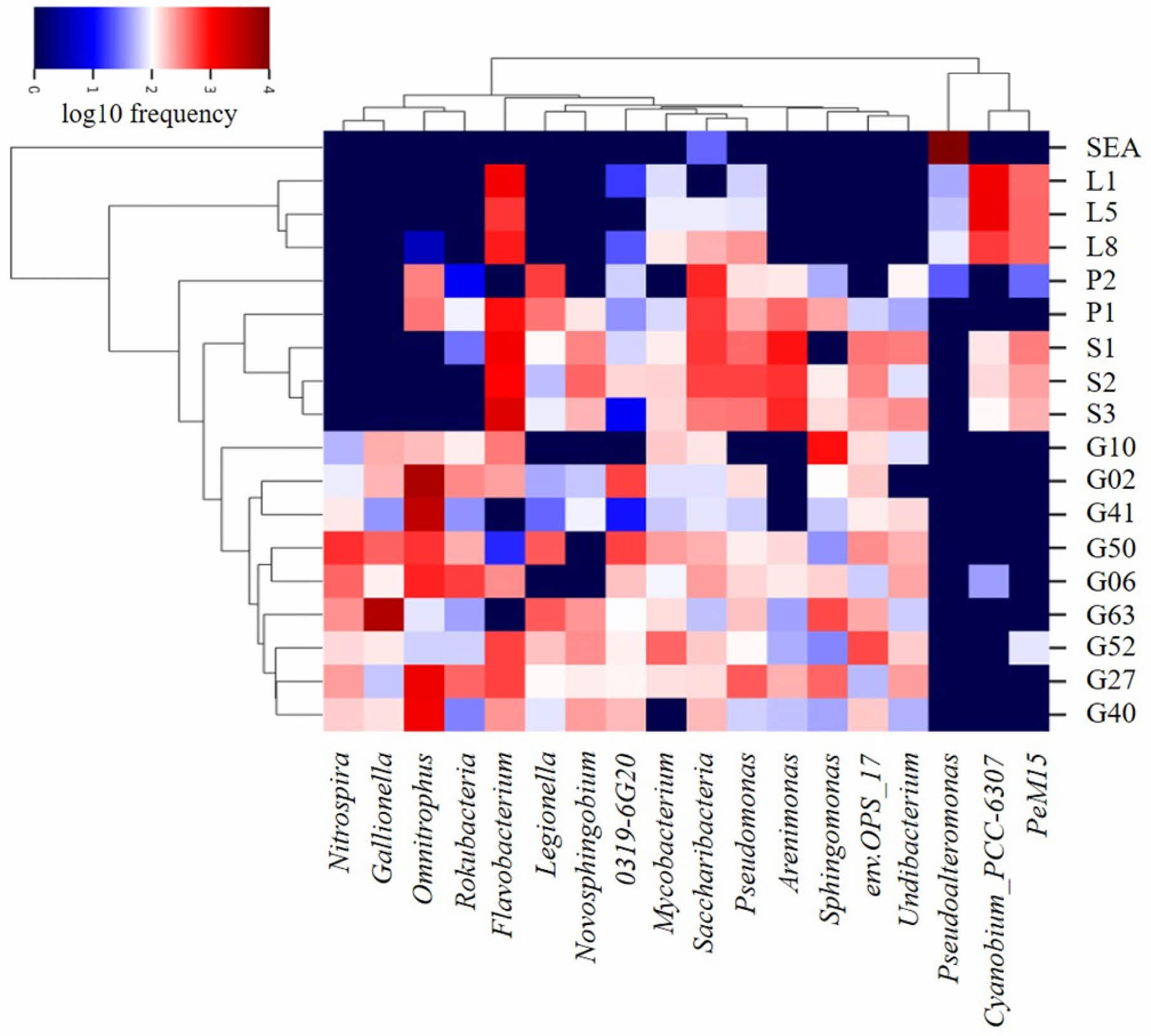
각 시료에 존재하는 미생물 군집의 특성을 확인하기 위하여 가장 높은 빈도로 존재하는 상위 18개의 속(genus)을 대상으로 heat-map 분석을 수행하였다(Fig. 6). 해수를 제외한 지하수, 석호수, 하천수 시료에서 Flavobacterium 속이 큰 비중을 차지하고 있었다. Flavobacterium 속은 해수, 담수, 토양 환경에서 복잡한 유기 화합물의 분해에 관여하고 있으며(Kolton et al., 2013; McBride et al., 2014), 일부 종은 탄화수소와 같은 유기 물질의 생물학적 정화능(Suresh et al., 2022)을 갖고 있기 때문에 연구 지역 내 모든 시료에서 발견되는 것으로 판단된다.
시료는 크게 5개의 그룹으로 구분되었으며 대부분 수질 특성과 시료의 유형에 따라 구분되었다. 농업용 관정 지하수(GW_A) 시료들로 형성된 그룹에서는 Nitrospira, Gallionella, Omnitrophus, Rokubacteria 속이 우세하게 존재하였다. Nitrospira 속은 호기성 환경에서 질산화(nitrification)에 중요한 역할을 하는 미생물로, 암모니아(NH4+)를 아질산염(NO2-)으로 전환하는 암모니아 산화 박테리아(ammonia-oxidizing bacteria, AOB)이다(Daims and Wagner, 2018). Gallionella 속은 미호기성 환경에서 이가 철 이온(ferrous ion)을 불용성 침전물인 수산화철(ferric hydroxide)로 산화시키는 철 산화능을 가지고 있으며(Hallbeck and Pedersen, 1991), Omnitrophus 속은 대수층에서 많이 발견되며 황 산화 또는 환원과 같이 황 순환에 관여하는 것으로 알려져 있다(Glöckner et al., 2010; Perez‐Molphe‐Montoya et al., 2022). Rokubacteria속은 토양이나 담수에 풍부하게 존재하며 유기물을 분해하며 일부 종은 아질산염 산화환원효소(nitrite oxidore- ductase)를 가지고 있어 질소 순환에도 관여한다(Becraft et al., 2017). 따라서 농업용 관정 시료의 우세 속은 해당 관정이 농지에 위치하는 충적 관정으로 활발한 농업 활동에 의한 영향으로 판단된다. 모니터링 관정 지하수(GW_M)와 하천수(SW) 시료들이 형성한 그룹에서는 Saccharibacteria, Pseudomonas, Arenimonas 속이 우세하였다. Saccharibacteria 속은 토양이나 담수에 풍부하게 존재하며, 호기성 환경에서는 질산염을 환원하고 혐기성 환경에서는 다양한 유기 화합물을 분해한다(Kindaichi et al., 2016). Pseudomonas 속은 토양이나 물에서 일반적으로 발견되는 그람음성균(Crone, 2020)이고, Arenimonas 속은 일반적으로 질산염을 감소시키고 환경에 존재하는 총 질소를 제거하는 탈질 반응과 관련이 있다(Zhao et al., 2018). 지형적으로 하천수와 P1 시료는 연결성이 좋을 것으로 판단되며 이에 따라 미생물 군집도 유사한 특징을 보였다.
석호수(LW) 시료들로 구성된 그룹은 Cyanobium PCC-6307과 PeM15 속이 우세하게 존재하였다. Cyanobium PCC-6307 속은 수생태계에서 광합성을 통해 산소를 생산하며, 질소 고정(nitrogen fixation)을 수행하여 대기 중 질소를 다른 생물이 사용할 수 있는 질소 화합물로 전환할 수 있어 생태학적 네트워크와 생태계의 안정성을 유지하는데 중요한 역할을 한다고 알려져 있다(Costa et al., 2015; Gao et al., 2023). PeM15은 염기서열의 존재만 밝혀진 미배양 세균으로 해양 Actinobacteria 계통이며 호기성 환경에서 혐기성 환경에 이르기까지 다양한 서식지에서 확인되며 영양염 강화(nutrient enrichment)에 매우 민감하다고 알려져 있어 향후 석호수의 오염 지시자로 활용될 가능성이 있다(Arocha-Garza et al., 2017).
해수(SEA) 시료와 P2 시료는 각각 하나의 그룹으로 구분되었는데, 해수 시료에는 다양한 해양환경에 널리 분포하고 있으며 해양 질소 순환에서 중요한 역할을 한다고 알려져 있는 Pseudoalteromonas 속이 우세하게 존재하였다(Lloyd et al. 2013; Chen et al., 2020). Pseudoaltero- monas 속은 파이오멜라닌(pyomelanin)이란 성분을 세포 외로 방출하는데 이 물질은 천연방오제로 작용하여 오염 유기체로 인해 발생하는 파울링(fouling)을 막아주는 역할을 한다(Zeng et al., 2017). P2시료는 지하수와 석호수 시료의 가운데 위치하고 있으며, 지하수와 해수의 특징을 모두 갖는 특징을 갖는다.
결과적으로, 각각의 그룹들은 시료의 수질 특성과 유형을 반영하고 있으며 각 시료에 존재하는 미생물 속들의 생태학적 기능들로 미루어 보아 송지호에서 일어나는 지하수-지표수 상호작용을 통해 질소, 황, 탄소와 같은 물질순환이 활발하게 일어날 것으로 판단된다. 또한 Pseu- doalteromonas 속은 해수의 영향을 많이 받는 석호수(LW)와 지하수(P2)에서 주로 관찰되었으므로 해수 침투의 지표로 활용될 수 있음을 시사한다.
|
Fig. 2 Hydrochemical Facies Evolution Diagram (HFE-D) of groundwater, lagoon water, stream water, and seawater in study area. Data input in mg/L. Blue means freshening phase and red means intrusion phase. |
|
Fig. 3 Boxplot of alpha-diversity indices. Alpha-diversity indexes are composite indexes reflecting abundance and consistency. (A) Shannon, (B) Observed features, (C) Faith's and (D) Evenness indices reflect the amplicon sequence variant (ASV) abundance in samples |
|
Fig. 4 Bacterial beta-diversity. The figure shows a threedimensional scatter plot, generated using principal-coordinates analysis (PCoA) from Bray-curtis distance analyses, showing the distance of bacterial communities. |
|
Fig. 5 Stacked bar plots of Phylum level bacterial taxa. Each color in the bar plot represents a bacterial taxa assigned according to the legend. Plots were generated using the Qiime2. |
|
Fig. 6 Heat-map showing relative frequency of bacterial communities at genus level. Deprogram on the horizontal and vertical axes are based on the Bray-Curtis matrix. |
|
Table 1 Field parameters of samples collected at June 2021 |
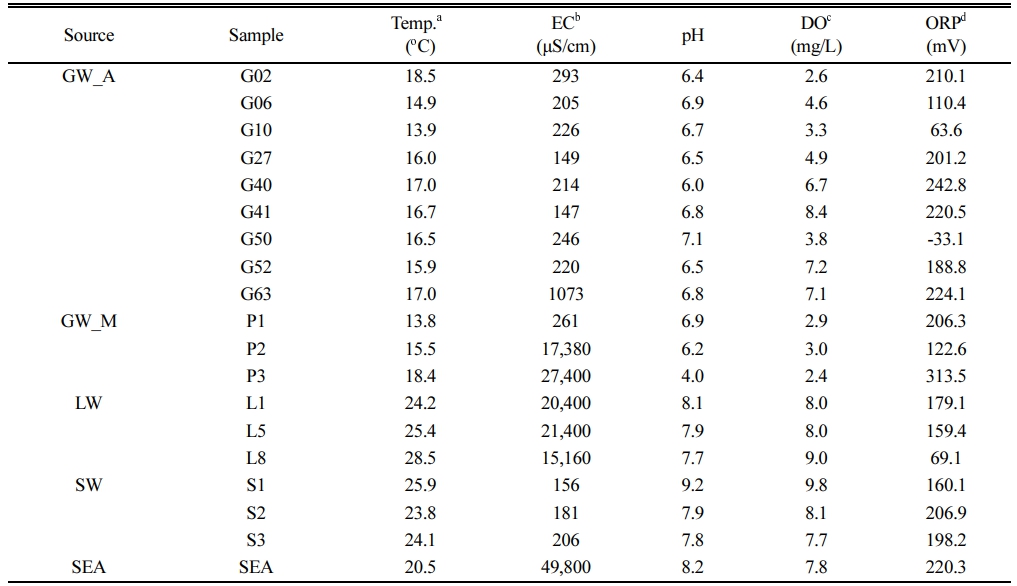
a Temperature |
|
Table 2 Statistics of ionic compositions of groundwater, lagoon water, stream water, and seawater in study area |
본 연구에서는 강원도 동해안에 위치한 송지호의 지하수-지표수 상호작용을 이해하기 위하여 물리화학적 및 미생물학적 특성 분석을 수행하였다. 연구 지역 지하수는 담수의 특성을 보여주고 있지만 일부 지하수는 석호수나 해수의 영향을 받는 것으로 나타났다. 석호수의 경우 갯트임으로 인한 해수와의 교환으로 전기전도도가 높은 것으로 추정되지만 해수 및 담수의 유입에 대한 추가적인 연구가 필요하다. 전체 시료는 5개의 Hydrochemical facies type(Na-Cl, MixCa-HCO3, Ca-HCO3, MixCa-MixHCO3, MixNa-HCO3)으로 구분되었고 HFE-D를 통해 intrusion phase(57.9%)가 freshening phase(42.1%)보다 우세함을 확인하였다. 전반적으로 미생물 종풍부도와 균등도 지수는 지하수 시료에서 가장 높게 나타났으며 하천수, 석호수, 해수 시료 순으로 관찰되어 담수인 지하수와 하천수에서 미생물 군집의 다양성이 높은 것으로 나타났다. 미생물 군집의 경우 Proteobacteria가 가장 많이 존재하였고 시료에 따라 Bacteroidota, Actinobacteriota, Patescibac- teria, Verrucomicrobiota, Cyanobacteria 문 등이 우점하기도 하였다. 전체적으로 Flavobacteium 속이 광범위하게 존재하고 있으며 수질 특성과 유형을 반영한 미생물 군집이 다양하게 구성되어 있어 생지화학적 물질순환이 활발하게 일어나고 있는 것으로 판단된다. 또한, 해수 침투 지표로서 해수에 주로 존재하는 Pseudoalteromonas 속의 활용 가능성을 확인하였다. 본 연구는 연안 석호의 미생물 모니터링을 통해 수문학적 연결성과 염수 간섭이 연안 지역의 생태 및 생지화학에 미치는 영향을 평가하는데 기초자료로 활용될 수 있을 것이라 판단된다.
본 연구는 과학기술정보통신부에서 지원한 기본사업(기후변화 대응 대용량 지하수 확보 및 최적활용 기술 개발, GP2020-012)의 도움으로 수행되었습니다.
- 1. Ahn, J.S., 2012, Geochemical occurrences of arsenic and fluoride in bedrock groundwater: a case study in Geumsan County, Korea, Environ. Geochem. Health, 34, 43-54.
-

- 2. Arocha-Garza, H.F., Canales-Del Castillo, R., Eguiarte, L.E., Souza, V., and De la Torre-Zavala, S., 2017, High diversity and suggested endemicity of culturable Actinobacteria in an extremely oligotrophic desert oasis, Peer J, 5, e3247.
-

- 3. Bärenstrauch, M., Vanhove, A.S., Allégra, S., Peuble, S., Gallice, F., Paran, F., Lavastre, V., and Girardot, F., 2022, Microbial diversity and geochemistry of groundwater impacted by steel slag leachates, Sci. Total Environ., 843, 156987.
-

- 4. Barnes, R.S.K., 1980, Coastal Lagoons, Cambridge University Press.
-

- 5. Becraft, E.D., Woyke, T., Jarett, J., Ivanova, N., Godoy-Vitorino, F., Poulton, N., Brown, J.M., Brown, J., Lau, M.C., Onstott, T., Eisen, J.A., Moser, D., and Stepanauskas, R., 2017, Rokubacteria: genomic giants among the uncultured bacterial phyla, Front. Microbiol., 8, 2264.
-

- 6. Bolyen, E., Rideout, J.R., Dillon, M.R., Bokulich, N.A., Abnet, C.C., Al-Ghalith, G.A., and Caporaso, J.G, 2019, Reproducible, interactive, scalable and extensible microbiome data science using QIIME 2, Nat. Biotechnol., 37(8), 852-857.
-

- 7. Cadena, S., Aguirre-Macedo, M.L., Cerqueda-García, D., Cervantes, F.J., Herrera-Silveira, J.A., and García-Maldonado, J.Q., 2019, Community structure and distribution of benthic Bacteria and Archaea in a stratified coastal lagoon in the Southern Gulf of Mexico, Estuar. Coast. Shelf Sci., 230, 106433.
-

- 8. Callahan, B.J., McMurdie, P.J., Rosen, M.J., Han, A.W., Johnson, A.J.A., and Holmes, S.P., 2016, DADA2: High-resolution sample inference from Illumina amplicon data, Nat. Methods, 13(7), 581-583.
-

- 9. Chen, X., Wang, Y., Wang, P., and Zhang, Y., 2020, Proteases from the marine bacteria in the genus Pseudoalteromonas: diversity, characteristics, ecological roles, and application potentials, Mar. Life Sci. Technol., 2(4), 309-323.
-

- 10. Coluccio, K.M., Morgan, L.K., and Santos, I.R., 2021, Resolving groundwater sources to a coastal lagoon using major ions, nutrients and stable isotopes, Environ. Earth Sci., 80(588).
-

- 11. Costa, M.S., Costa, M., Ramos, V., Leao, P.N., Barreiro, A., Vasconcelos, V., and Martins, R., 2015, Picocyanobacteria from a clade of marine cyanobium revealed bioactive potential against microalgae, bacteria, and marine invertebrates, J. Toxicol. Environ. Health - A, 78(7), 432-442.
-

- 12. Crone, S., Vives‐Flórez, M., Kvich, L., Saunders, A.M., Malone, M., Nicolaisen, M.H., Martínez‐García, E., Rojas‐Acosta, C., Catalina Gomez‐Puerto, M., and Calum, H., 2020, The environmental occurrence of Pseudomonas aeruginosa, APMIS, 128(3), 220-231.
-

- 13. Daims, H., and Wagner, M., 2018, Nitrospira, Trends Microbiol., 26(5), 462-463.
-

- 14. De Souza, G.K., von Ahn, C.M.E., Niencheski, L.F.H., and de Andrade, C.F.F., 2021, Effects of coastal lagoon water level on groundwater fluxes of nutrients to the coastal zone of southern Brazil, J. Mar. Syst., 213, 103459.
-

- 15. Dimova, N., Ganguli, P.M., Swarzenski, P.W., Izbicki, J.A., and O¡¯Leary, D., 2017, Hydrogeologic controls on chemical transport at Malibu Lagoon, CA: Implications for land to sea exchange in coastal lagoon systems, J. Hydrol. Reg. Stud., 11, 219-233.
-

- 16. Duck, R.W., and da Silva, J.F., 2012, Coastal lagoons and their evolution: A hydromorphological perspective, Estuar. Coast. Shelf Sci., 110, 2-14.
-

- 17. Estaki, M., Jiang, L., Bokulich, N.A., McDonald, D., González, A., Kosciolek, T., and Knight, R., 2020, QIIME 2 enables comprehensive end‐to‐end analysis of diverse microbiome data and comparative studies with publicly available data, Curr. Protoc., 70(1), e100.
-

- 18. Fadili, A., Malaurent, P., Najib, S., Mehdi, K., Riss, J., and Makan, A., 2018, Groundwater hydrodynamics and salinity response to oceanic tide in coastal aquifers: case study of Sahel Doukkala, Morocco, Hydrogeol. J., 26(7), 2459-2473.
-

- 19. Gao, J., Shao, N., Sun, Y., Nie, Z., Yang, X., Dai, F., Xu, G., and Xu, P., 2023, Impact of effective microorganisms and Chlorella vulgaris on Eriocheir sinensis and water microbiota in ponds experiencing Cyanobacterial Blooms, Sustainability, 15(9), 7362.
-

- 20. Gifford, S.M., Sharma, S., and Moran, M.A., 2014, Linking activity and function to ecosystem dynamics in a coastal bacterioplankton community, Front. Microbiol., 5, 185.
-

- 21. Giménez‐Forcada, E., 2010, Dynamic of sea water interface using hydrochemical facies evolution diagram, Groundwater, 48(2), 212-216.
-

- 22. Glöckner, J., Kube, M., Shrestha, P.M., Weber, M., Glöckner, F.O., Reinhardt, R., and Liesack, W., 2010, Phylogenetic diversity and metagenomics of candidate division OP3, Environ. Microbiol., 12(5), 1218-1229.
-

- 23. Hallbeck, L. and Pedersen, K., 1991, Autotrophic and mixotrophic growth of Gallionella ferruginea, Microbiology, 137(11), 2657-2661.
-

- 24. Hu, C. and Rzymski, P., 2019, Programmed cell death-like and accompanying release of microcystin in freshwater bloom-forming cyanobacterium Microcystis: From identification to ecological relevance, Toxins, 11(12), 706.
-

- 25. Hunter, J.D., 2007, Matplotlib: A 2D graphics environment, Comput. Sci. Eng., 9(03), 90-95.
-

- 26. Jeon, W.H., Kim, D.H., Lee, S.H., Hwang, S., Moon, H.S., and Kim, Y., 2021, Hydrogeological characterization of groundwater and surface water interactions in fresh-saline water mixed zone of the east coast lagoon area, Korea, J. Soil Groundw. Environ., 26(6), 144-156.
-

- 27. Katoh, K., Misawa, K., Kuma, K.I., and Miyata, T., 2002, MAFFT: a novel method for rapid multiple sequence alignment based on fast Fourier transform, Nucleic Acids Res., 30(14), 3059-3066.
-

- 28. Kim, D.H., Lee, J.Y., Cho, S.Y., Moon, H.S., Jung, Y.Y., Park, Y., and Oh, Y.H., 2023, Determining groundwater-surface water interaction at coastal lagoons using hydrogeochemical tracers, J. Soil Groundw. Environ., 28(2), 1-11.
- 29. Kindaichi, T., Yamaoka, S., Uehara, R., Ozaki, N., Ohashi, A., Albertsen, M., Nielsen, P.H., and Nielsen, J.L., 2016, Phylogenetic diversity and ecophysiology of Candidate phylum Saccharibacteria in activated sludge, FEMS Microbiol. Ecol., 92(6), fiw078.
-

- 30. Kolton, M., Sela, N., Elad, Y., and Cytryn, E., 2013, Comparative genomic analysis indicates that niche adaptation of terrestrial Flavobacteria is strongly linked to plant glycan metabolism, PloS one, 8(9), e76704.
-

- 31. Kwak, S.J., Yoo, S.H., and Chang, J.I., 2005, Measuring the conservation value of lagoons: the case of Songji Lagoon, Ocean Polar Res., 27(2), 161-169.
-

- 32. Lee, J. and Lee, K., 2000, Use of hydrologic time series data for identification of recharge mechanism in a fractured bedrock aquifer system, J. Hydrol., 229(3-4), 190-201.
-

- 33. Lloyd, K.G., Schreiber, L., Petersen, D.G., Kjeldsen, K.U., Lever, M.A., Steen, A.D., Stepanauskas, R., Richter, M., Kleindienst, S., Lenk, S., Schramm, A., and J©ªrgensen, B.B., 2013, Predominant archaea in marine sediments degrade detrital proteins, Nature, 496(7444), 215-218.
-

- 34. McBride, M.J., Liu, W., Lu, X., Zhu, Y., and Zhang, W., 2014, The family cytophagaceae, The prokaryotes, 4, 577-593.
-

- 35. Menció, A., Casamitjana, X., Mas-Pla, J., Coll, N., Compte, J., Martinoy, M., Pascual, J., and Quintana, X.D., 2017, Groundwater dependence of coastal lagoons: The case of La Pletera salt marshes (NE Catalonia), J. Hydrol., 552, 793-806.
-

- 36. Niencheski, L.F.H., Windom, H.L., Moore, W.S., and Jahnke, R.A., 2007, Submarine groundwater discharge of nutrients to the ocean along a coastal lagoon barrier, Southern Brazil, Mar. Chem., 106(3-4), 546-561.
-

- 37. O'Sullivan, L.A., Rinna, J., Humphreys, G., Weightman, A.J., and Fry, J.C., 2006, Culturable phylogenetic diversity of the phylum ¡®Bacteroidetes¡¯ from river epilithon and coastal water and description of novel members of the family Flavobacteriaceae: Epilithonimonas tenax gen. nov., sp. nov. and Persicivirga xylanidelens gen. nov., sp. nov., Int. J. Syst. Evol. Microbiol., 56(1), 169-180.
-

- 38. Perez‐Molphe‐Montoya, E., Küsel, K., and Overholt, W.A., 2022, Redefining the phylogenetic and metabolic diversity of phylum Omnitrophota, Environ. Microbiol., 24(11), 5437-5449.
-

- 39. Price, M.N., Dehal, P.S., and Arkin, A.P., 2010, FastTree 2-approximately maximum-likelihood trees for large alignments, PloS one, 5(3), e9490.
-

- 40. Quast, C., Pruesse, E., Yilmaz, P., Gerken, J., Schweer, T., Yarza, P., and Glöckner, F.O., 2012, The SILVA ribosomal RNA gene database project: improved data processing and web-based tools, Nucleic Acids Res., 41(D1), D590-D596.
-

- 41. Re, V., Sacchi, E., Martin-Bordes, J.L., Aureli, A., El Hamouti, N., Bouchnan, R., and Zuppi, G.M., 2013, Processes affecting groundwater quality in arid zones: the case of the Bou-Areg coastal aquifer (North Morocco), Appl. Geochem., 34, 181-198.
-

- 42. Richa, K., Balestra, C., Piredda, R., Benes, V., Borra, M., Passarelli, A., Margiotta, F., Saggiomo, M., Biffali, E., Sanges, R., Scanlan, D.J., and Casotti, R., 2017, Distribution, community composition, and potential metabolic activity of bacterioplankton in an urbanized Mediterranean Sea coastal zone, Appl. Environ. Microbiol., 83(17), 494.
-

- 43. Robinson, C.E., Xin, P., Santos, I.R., Charette, M.A., Li, L., and Barry, D.A., 2018, Groundwater dynamics in subterranean estuaries of coastal unconfined aquifers: Controls on submarine groundwater discharge and chemical inputs to the ocean, Adv. Water Resour., 115, 315-331.
-

- 44. Spain, A.M., Krumholz, L.R., and Elshahed, M.S., 2009, Abundance, composition, diversity and novelty of soil Proteobacteria, The ISME Journal, 3(8), 992-1000.
-

- 45. Suresh, J.I., Janani, M.S., and Sowndharya, R., 2022, Bacterial diseases in fish with relation to pollution and their consequences-a global scenario, Bacterial Fish Diseases, 113-131.
-

- 46. Tarafdar, L., Kim, J.Y., Srichandan, S., Mohapatra, M., Muduli, P.R., Kumar, A., Mishra, D.R., and Rastogi, G., 2021, Responses of phytoplankton community structure and association to variability in environmental drivers in a tropical coastal lagoon, Sci. Total Environ., 783, 146873.
-

- 47. Tian, R., Ning, D., He, Z., Zhang, P., Spencer, S.J., Gao, S., Shi, W., Wu, L., Zhang, Y., and Yang, Y., 2020, Small and mighty: adaptation of superphylum Patescibacteria to groundwater environment drives their genome simplicity, Microbiome, 8, 1-15.
-

- 48. Viezzoli, A., Tosi, L., Teatini, P., and Silvestri, S., 2010, Surface water-groundwater exchange in transitional coastal environments by airborne electromagnetics: the Venice Lagoon example, Geophys. Res. Lett., 37(1).
-

- 49. Wonju Regional Environmental Administration (WREA), 2019, A study on the development of the brackish water area in the lagoon of the east coast.
- 50. Yoon, S., Hwang, S., Park, C., Kim, H., and Moon, Y., 2008, Landscape changes of coastal lagoons during the 20th century in the Middle East coast, South Korea, J. Geol. Soc. Korea, 43(4), 449-465.
- 51. Yum, J., Takemura, K., Yu, K., Nahm, W., Hong, S., Yang, D., Katsuki, K., and Kim, J.Y., 2015, Late Quaternary environmental changes of the Hwajinpo and Songjiho lagoons on the eastern coast of Korea, Earth Surface Processes and Environmental Changes in East Asia: Records From Lake-catchment Systems, 163-199.
-

- 52. Zeng, Z., Guo, X., Cai, X., Wang, P., Li, B., Yang, J., and Wang, X., 2017, Pyomelanin from Pseudoalteromonas lipolytica reduces biofouling, Microb. Biotechnol., 10(6), 1718-1731.
-

- 53. Zhang, B., Wu, X., Tai, X., Sun, L., Wu, M., Zhang, W., and Dyson, P., 2019, Variation in actinobacterial community composition and potential function in different soil ecosystems belonging to the arid Heihe River Basin of Northwest China., Front. Microbiol., 10, 2209.
-

- 54. Zhao, Y., Cao, X., Song, X., Zhao, Z., Wang, Y., Si, Z., Lin, F., Chen, Y., and Zhang, Y., 2018, Montmorillonite supported nanoscale zero-valent iron immobilized in sodium alginate (SA/Mt-NZVI) enhanced the nitrogen removal in vertical flow constructed wetlands (VFCWs), Bioresour. Technol., 267, 608-617.
-

- 55. Zhou, Z., Tran, P.Q., Kieft, K., and Anantharaman, K., 2020, Genome diversification in globally distributed novel marine Proteobacteria is linked to environmental adaptation, The ISME Journal, 14(8), 2060-2077.
-

 This Article
This Article
-
2023; 28(5): 12-24
Published on Oct 31, 2023
- 10.7857/JSGE.2023.28.5.012
- Received on Sep 7, 2023
- Revised on Sep 22, 2023
- Accepted on Oct 6, 2023
 Services
Services
Shared
 Correspondence to
Correspondence to
- Dong-Hun Kim
-
1Groundwater Environment Research Center, Climate Change Response Division,
Korea Institute of Geoscience and Mineral Resources, Daejeon 34132, Republic of Korea - E-mail: donghun@kigam.re.kr





