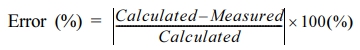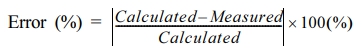- Method for Measuring pH and Alkalinity of High-Pressure Fluid Samples : Evaluation through Artificial Samples
Minseok Song·Soohyeon Moon*·Gitak Chae·Jun-Hwan Bang
Korea Institute of Geoscience and Mineral Resources (KIGAM), Daejeon 34132, Korea
- 고압 유체 시료의 pH 및 알칼리도 측정 방법 : 가상 시료를 활용한 실용성 평가
송민석·문수현*·채기탁·방준환
한국지질자원연구원
This article is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
As part of monitoring technology aimed at verifying the stability of CO2 geologic storage and mitigating concerns about leakage, a method for measuring the pH and alkalinity of high-pressure fluid samples was established to obtain practical technology. pH measurement for high-pressure samples utilized a high-pressure pH electrode, and alkalinity was measured using the Gran titration method for samples collected with a piston cylinder sampler (PCS). Experimental samples, referencing CO2-rich water and CO2 geologic storage studies, were prepared in the laboratory. The PCS controls the piston, preventing CO2 degassing and maintaining fluid pressure, allowing mixing with KOH to fix dissolved CO2. Results showed a 6.1% average error in high-pressure pH measurement. PCS use for sample collection maintained pressure, preventing CO2 degassing. However, PCS-collected sample alkalinity measurements had larger errors than non-PCS measurements, limiting PCS practicality in monitoring field settings. Nevertheless, PCS could find utility in pre-processing for carbon isotope analysis and other applications. This research not only contributes to the field of CCS monitoring but also suggests potential applications in studies related to natural analogs of CCS, CO2-rock interaction experiments, core flooding experiments, and beyond.
Keywords: CCS monitoring, High-pressure fluid, High-pressure pH, Alkalinity, Piston cylinder sampler
전 세계적으로 이상 기후 현상이 발생하면서 지구온난화에 대한 관심이 높아졌다. 그러나 에너지 전환이 더딘 상황에서, 이산화탄소 지중저장 기술(CCS: carbon capture and storage)의 역할이 더욱 강조되고 있다. CCS는 화석 연료의 사용으로 인해 발생하는 이산화탄소 등을 지중저장함으로써 적극적으로 온실가스를 감축할 수 있는 기술이다(Ajayi et al., 2019; Yasemi et al., 2023). 대한민국 정부는 2050 탄소중립(NDC: nationally determined contribution)을 선언하였고, 목표 감축량(흡수∙제거)의 6.4% 인 480만 톤을 CCS 기술로 감축하기로 하였다(국무조정실, 2023). 이에 따라 우리나라에서도 경제적이면서도 안전한 CCS를 위하여 CO2 저장지층 탐사 및 평가, CO2 저장 효율 향상 기술 개발, 모니터링 기술 개발을 위한 다각적인 연구개발이 수행되고 있다.
CO2의 안정적인 저장을 확인하고 누출에 대한 우려를 불식시키기 위하여 지구물리학적, 지구화학적 모니터링 기술이 적용되고 있으며(Blackford et al., 2015; Roberts et al., 2017; Yang et al., 2019; Cheong and Kim, 2020), 이중 지구화학적 모니터링은 저장층의 유체를 채취하여 분석함으로써 CO2 저장을 직접적으로 확인할 수 있는 기술로 분류된다(Litynski et al., 2012; Jones et al., 2015). 지구화학적 모니터링에서는 CO2의 용해 정도를 직∙간접적으로 나타내는 파라미터인 pH와 알칼리도 측정이 기본적으로 수행된다. pH의 경우 저장층의 상태를 반영한 고압 환경에서 원위치(in-situ) 측정이 바람직하다. 이는 채취한 고압의 시료를 지표의 대기압 조건에서 측정하면 압력 감소로 인해 CO2가 탈기 되어 pH가 증가할 수 있기 때문이다(Mörner and Etiope, 2002). 이와 반대로 CO2 주입 전의 저장층 유체가 pH가 높을 경우, 압력이 감소함에 따라 대기 중 CO2가 시료에 유입 되어 pH가 감소할 수도 있다. 따라서 저장층의 압력을 고려하지 않은 pH 측정은 CO2 함량의 정확한 측정을 방해하며, 이는 모니터링 목표를 달성하는 데 제악을 줄 수 있다(Vesper and Edenborn, 2012; Myrttinen et al., 2015).
지하 저장층의 정확한 CO2 함량 분석을 위하여 압력을 유지하며 유체를 채취하려는 다양한 연구가 수행되고 있다. Kampman et al.(2014)은 미국 유타 주 Crystal Geyser에서 CO2와 지하수의 상호작용 및 CO2의 거동을 파악하기 위하여 고압을 유지하며 유체 시료를 채취하였다. 이를 위하여 가압교체식 지하 유체시료 채취기(PDS: positive displacement bottomhole sampler)와 유압 변압기(HTB: hydraulic transfer bench)를 적용하였다. PDS는 특정 심도에서 유체 시료를 채취하는 기구로써, 샘플러 내부의 피스톤이 움직이며 지층 유체를 빨아들이는 장치이다. 이때 피스톤은 지층의 압력을 유지하며 움직인다. HTB는 채취한 유체 시료의 압력을 유지하면서 시료의 일부(aliquot)를 취할 수 있게 하는 장치이다. Alfredson et al.(2016)과 Matter et al.(2016)은 Carbfix 프로젝트에서 PDS와 기능이 유사한 deep well sampler를 설계∙제작하여 실험실과 현장에서 활용하였다. 위에서 언급한 사례는 샘플러를 관측정에 내려서 시료를 채취하는 wire-line 방식으로 분류되며, 고압 유체 시료의 pH는 모두 고압 pH 전극으로 측정되었다. 한편 미국 Frio 프로젝트(Freifeld et al., 2005; Kharaka et al., 2006; Kharaka et al., 2009)와 호주 Otway 프로젝트(Boreham et al., 2011)는 U-tube 방식을 활용하여 고압 유체를 채취하였다. U-tube 방식에서는 U자형 관의 한쪽에 고압의 질소가스를 가하여 U자형 관 하부를 통해 유입된 유체를 지상으로 이송하여 시료를 채취한다. 그러나 해당 프로젝트에서 pH 측정에 있어 고압 pH 전극의 사용 여부는 확인되지 않았다.
pH는 일반적으로 유리 전극으로 측정되지만, 고압에서 유리 전극은 파손될 위험이 있기 때문에 유리 전극을 고압 유체에 적용하지 않는 것이 일반적이다. 고압 유체의 pH 측정을 위해서는 유리 전극을 스테인리스 관으로 보호한 전극(Kampman et al., 2014; Alfredson et al., 2016), Zr/ZrO2 전극(Zhang et al., 2008), 반도체 기반 전극(Shitashima et al., 2013)을 이용한다. 또는 비색법을 통해 측정하기도 한다(Raghuraman et al., 2006). 본 연구는 Crystal Geyser와 Carbfix 프로젝트에서 검증된 고압 유리 전극을 사용하여 고압 유체 시료의 pH를 측정하는 실용 기술을 확보하기 위해 수행되었다. 또한 고압 유체 시료의 알칼리도 측정을 위한 장치를 제작하고 이의 효용성을 시험하였다. 본 연구의 결과는 CCS 프로젝트의 모니터링 현장에서 긴요하게 활용될 수 있으며, CCS 관련 실내 실험에서도 활용될 수 있다.
본 연구에서는 고압 유체 시료의 pH와 알칼리도를 측정하는 방법을 확립하고, 이를 원활하게 활용하기 위해 이전 연구에서 사용된 방법(Kampman et al., 2014; Matter et al., 2016)을 준용하였다. 고압을 유지하는 측정 장치를 구성하고, 기존 연구에서 사용된 유체 조성을 참고하여 제조한 시료(ACW: artificial CO2-rich water)를 활용하여 장치의 실용성과 정확도를 검증하였다.
2.1. 장치 구성
2.1.1. 고압 pH 측정 장치
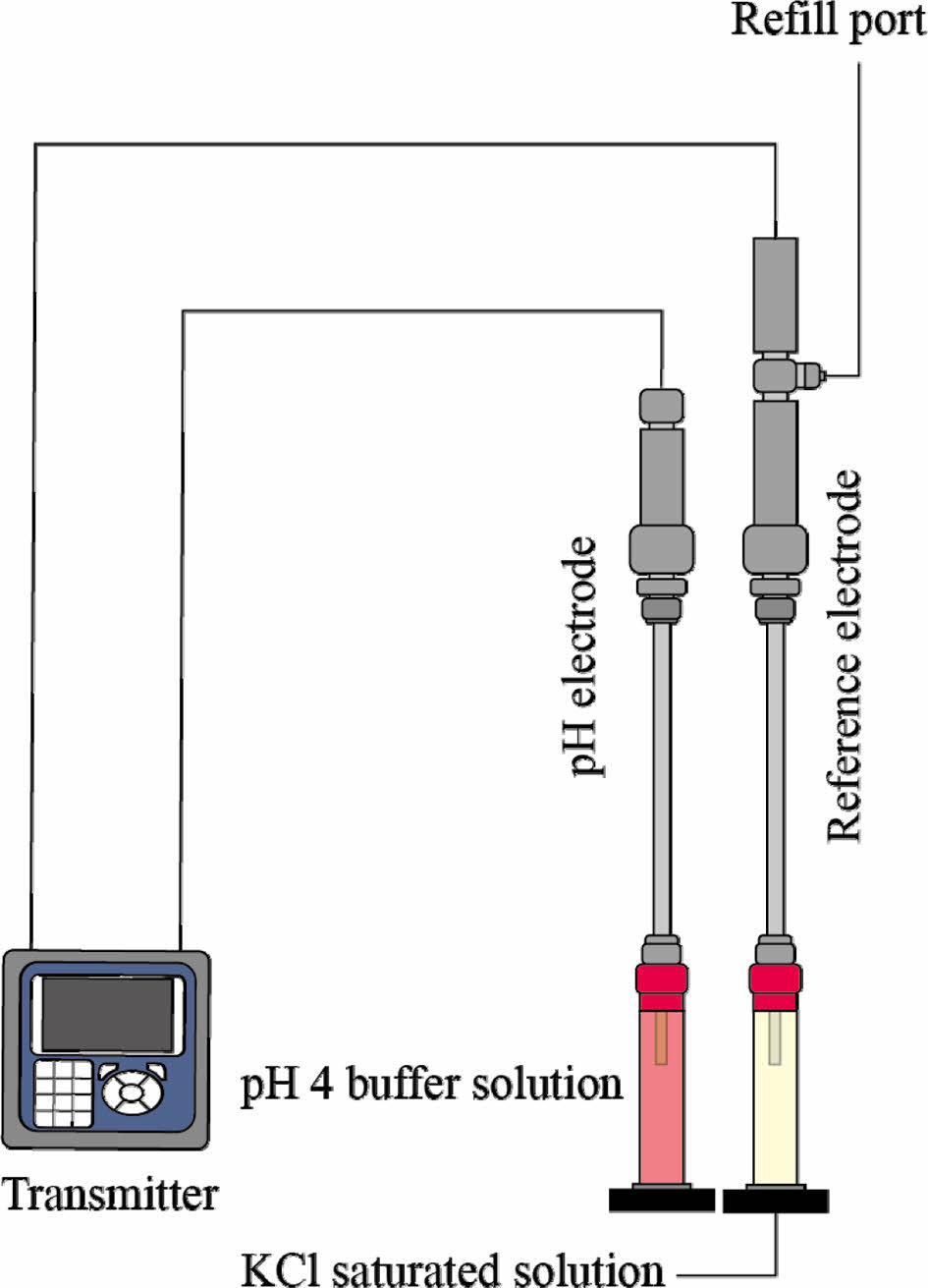
고압 유체 시료의 pH는 Corr Instruments 사(社)의 pH 전극(UltraDeg®, Miami, USA)과 기준전극(reference electrode)을 사용하여 측정하였다(Fig. 1). 전극의 제어 및 기록은 RosemountTM 56 트랜스미터(Emerson, Minnesota, USA)를 이용하였다. pH 전극과 기준전극은 13.6 MPa까지 견디는 것으로 설계되었다. 측정 전∙후 pH 전극은 pH 4 완충용액(buffer solution)에, 기준전극은 약 4.6 M의 KCl 포화용액에 보관하였다. 측정 전에 기준전극은 매번 KCl 포화용액을 상부 주입구(refill port)를 통해서 채워야 한다. 참고로 제품 매뉴얼에는 채움용액(filling solution)은 0.1 M(mol/L), 보관용액은 1 M의 KCl 용액을 사용하라고 하였으나, 제조사에 문의한 결과 두 용액 모두 KCl 포화용액 사용을 권장하였다. 기준전극에 0.1 M KCl 용액을 채우면 offset이 정상범위를 벗어나는 오류가 지속적으로 발생한다. 한편 보정(calibration)은 pH 4와 7 완충용액을 이용하여 측정 전에 수행하였다.
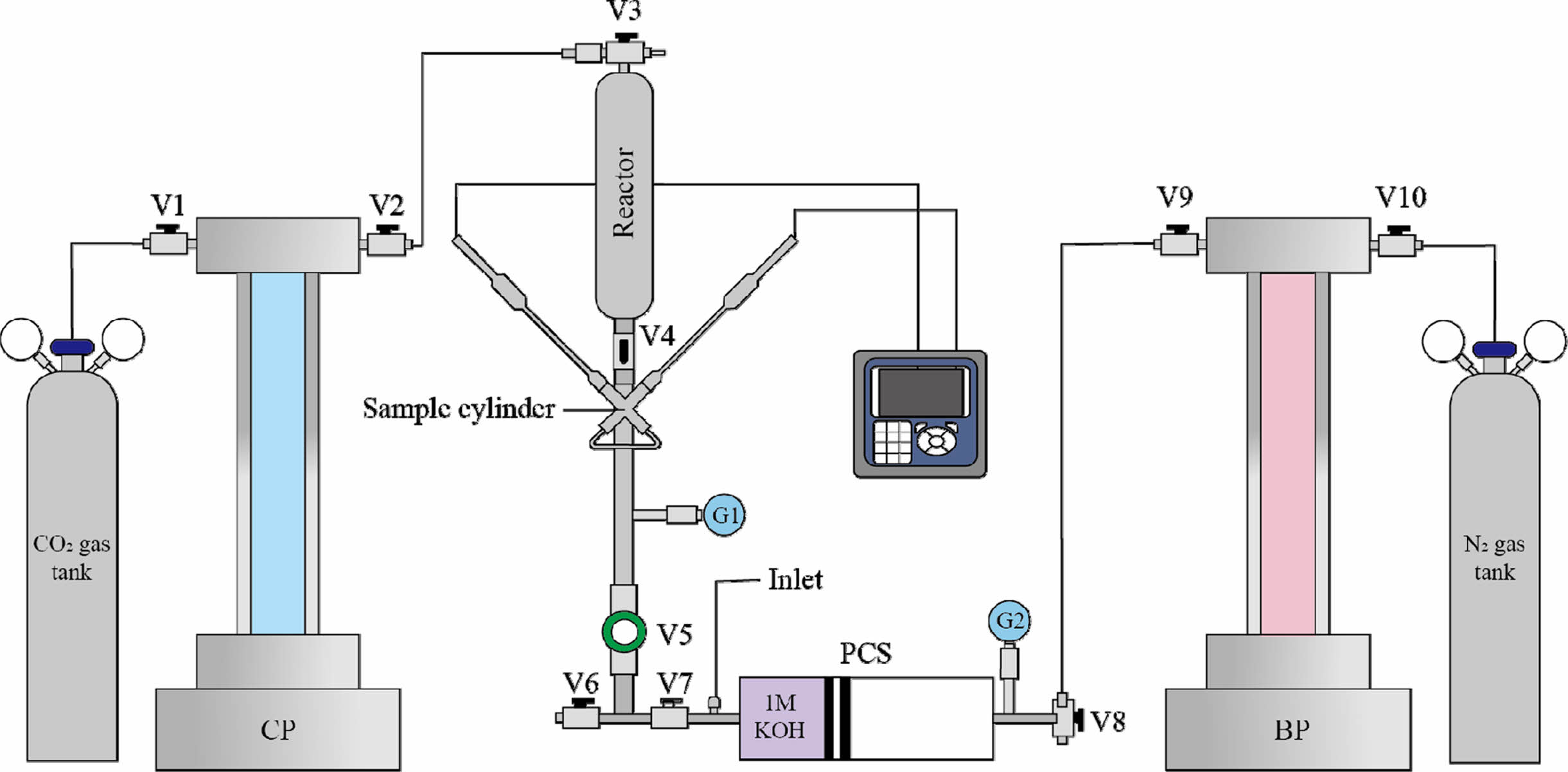
소량의 유체 시료 내에서 두 전극이 가깝게, 안정적으로 위치할 수 있도록 샘플 실린더를 X자 형으로 제작하였다(이하 X실린더: Corr Instruments, 2009; Kampman et al., 2014). X실린더의 용량은 22.5 mL이다. X실린더 상부에 생성될 수 있는 에어포켓을 최대한 방지하기 위하여 고압 유체 샘플은 전극이 닿는 X자의 중앙 부분으로 주입되어 아래 방향으로 배수되도록 하였다(Fig. 2). X실린더 상부에는 고압(<10 Mpa) ACW를 주입하기 위해 290 mL 용량의 원통형 리액터(304L-HDF4-290, Swagelok, Ohio, USA)를 설치하였다. 리액터 내부의 용액은 syringe pump(500D, Teledyne ISCO, Nebraska, USA)를 이용하여 CO2 또는 N2로 가압하였다.
2.1.2. 고압 피스톤 실린더 시료 채취기(PCS: piston cylinder sampler)
알칼리도 측정용 시료를 채취할 때 압력을 유지하고 CO2 탈기를 방지하기 위하여 피스톤 실린더 시료 채취기(PCS)를 제작∙사용하였다(Fig. 2). PCS의 내부 용량은 47.7 mL이다. PCS 내부에는 2개의 O-ring이 있는 피스톤(floating piston 또는 plunger)이 있고, 이 피스톤의 반대편에 압력을 가감함으로써 주입되는 시료의 압력을 조절할 수 있다. PCS에 시료를 주입하기 이전에 1 M의 KOH 용액을 먼저 주입하여 시료와 반응하도록 하였다. KOH는 시료의 pH를 높이고, 일부 용존 CO2는 K2CO3로 침전하여 용존 CO2를 고정하는 역할을 한다. PCS는 내부에서 피스톤의 정상 작동 여부와 용액의 혼합 과정을 관찰할 수 있도록 투명한 아크릴 재질로 제작되었다. 따라서 실험은 아크릴 PCS의 내압 기준인 1 MPa 조건에서 수행되었으며, 이는 뒤에서 설명할 기존 연구의 사례보다 압력이 낮은 조건이다(3.4 MPa: Kampman et al., 2014; 4.4 MPa: Matter et al., 2016). 본 연구는 PCS를 활용한 알칼리도 측정 방법을 확립하는 목적으로 수행되었기 때문에 낮은 압력에서 실험이 수행되었고, 향후 보다 높은 압력에서 작동할 수 있는 PCS를 제작할 예정이다.
2.2. 고압 유체 시료 pH 측정
2.2.1. ACW(artificial CO2-rich water) 제조
ACW는 Kampman et al.(2014)과 Matter et al.(2016)에서 보고된 자료를 참고하여 제조하였으며, 최종적으로 제조된 ACW를 각각 ACWK, ACWM으로 명명하였다. Kampman et al.(2014)에서 DFS004 시료는 CO2W255 관정의 322 m에서 채취되어, 높은 압력(3.4 MPa)에서 CO2를 다량 함유(알칼리도 63.7 meq/L)하여 낮은 pH (5.13)를 나타내는 특징이 있다. 이와 유사한 ACW를 제조하기 위하여 CaCl2∙2H2O 2.9 g, NaOH 4.4 g, 2 M HCl 22.6 mL를 1 L DIW(deionized water)에 용해시켰다. 그러나 예상과 다르게 침전물이 생성되어 그 농도를 반으로 낮추었다. 침전물은 본 연구에서 고안한 장치의 밸브에 안 좋은 영향을 미칠 수 있다. 본 실험에서는 CaCl2∙ 2H2O 1.5 g, NaOH 2.2 g, 2 M HCl 11.3 mL를 혼합하여 ACWK를 제조하였다. CO2를 주입하지 않은 ACWK의 pH는 PHREEQC 계산값(12.37)과 측정값(12.31~12.38)이 매우 유사하게 나타났다. 이때 pH는 Hach 사의 pH 전극(PHC 101, Iowa, USA)으로 측정하였다.
한편 Matter et al.(2016)의 HN-2 관정에서 채취된 시료는 상대적으로 높은 pH(8.79)와 낮은 알칼리도(1.45 meq/L)를 나타내었다. 이를 모사하기 위하여 CaCl2∙2H2O 0.018 g, NaHCO3 0.109 g을 1 L DIW에 용해시켜 ACWM을 제조하였다. 이때 실험실 대기 중에서 ACWM의 pH가 지속적으로 낮아지는 현상(8.27에서 7.37까지 감소)이 발생하였다. 이는 대기 CO2가 ACWM으로 유입된 결과로 판단하여, ACWM은 Tedlar bag에 제조/보관 하였다. Tedlar bag은 PET(Polyethylene terephthalate) 재질로 된 봉투에 밸브를 설치한 후, 용액을 담고 접착기(impulse sealer)로 밀봉하여 제작하였다. 이와 같이 에어포켓이 없는 상태로 대기의 유/출입을 차단한 ACWM 시료의 pH는 8.19~8.38로 유지되어 PHREEQC 계산 결과인 8.24와 유사한 값을 나타내었다.
본 실험은 Kampman et al.(2014)와 Matter et al.(2016)의 연구에서 분석한 시료의 성분을 참조하여 가상의 시료를 제조한 것이다. 따라서 실험의 정확도는 투여된 CaCl2∙2H2O, NaOH, HCl, NaHCO3의 양을 바탕으로 PHREEQC에서 계산한 값과 실험으로 얻은 측정값을 비교하여 판단되었다.
2.2.2. 고압 pH 측정
앞서 설명한 바와 같이 ACWK는 CO2 1 MPa로 가압하여 pH 5.23인 ACW로 제조/실험 하였고, ACWM은 CO2를 주입하지 아니하여도 Matter et al.(2016)의 결과와 유사한 pH를 나타내기 때문에 N2 1 MPa로 가압하였다.
고압 pH 측정 과정을 간단히 정리하면 다음과 같다(장치의 각 명칭은 Fig. 2 참조).
1. 실험 전, 고압 pH 전극은 전원을 연결할 때마다 보정을 수행하였다. 보정 후 상압에서 Hach 사의 pH 전극과 동일 시료 측정 결과와 비교하였다.
2. 보정을 마친 pH 전극과 기준전극을 X실린더 양쪽에 결합한다(Fig. 2).
3. Syringe pump(CP: CO2 pump)에 CO2를 1 MPa로 약 400 mL 채운다.
4. CO2 가압 전의 ACWK 약 200 mL를 리액터에 담아 CP와 연결한 후 정압(constant pressure)으로 CO2를 ACWK에 주입한다.
5. CO2가 ACWK에 용해됨에 따라 CP의 압력은 감소하고, 정압을 유지하기 위하여 CP 내 CO2 부피는 감소한다. 이때 용해 반응을 빠르게 진행하기 위해 리액터의 밸브(V3, V4)를 잠근 후 위아래로 교반하였다. CO2 주입과 교반을 약 14~16회 반복하였다.
6. 리액터를 X실린더 상부에 연결하고, V4를 열어 가압된 ACWK를 X실린더에 주입한다.
7. V7은 닫은 상태로 V6를 열고, V5를 천천히 돌려주어 ACWK를 배수(약 50 mL)한다.
8. V5를 닫고 X실린더를 ACWK로 채워 압력을 1 MPa로 유지한다. 이때 압력은 CP와 압력 게이지 G1으로 확인한다.
9. 트랜스미터의 pH 값이 안정된 후 pH를 기록한다.
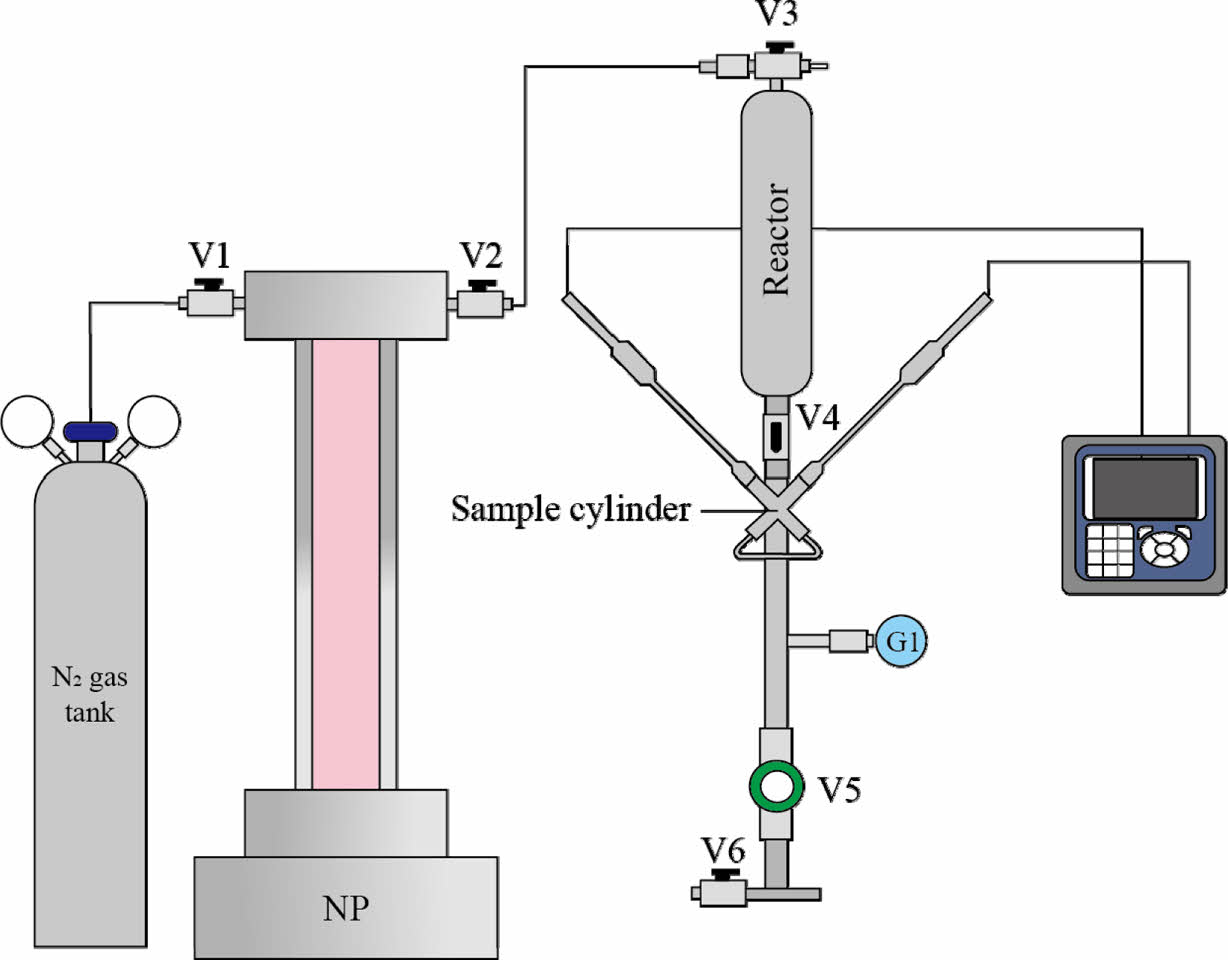
ACWM 측정 방법은 위와 유사하나, N2로 가압하기 때문에 V3에 연결하는 syringe pump(NP: N2 pump)를 교체하고, 위 실험 순서 중 4와 5를 생략하였다(Fig. 3). 또한 ACWM은 대기 중의 CO2가 유입될 수 있기 때문에 Tedlar bag에서 ACWM을 리액터에 옮겨 담는 과정은 가장 마지막에 수행하였다.
2.3. 고압 유체 시료 알칼리도 측정
pH 측정을 마친 후 PCS를 이용하여 알칼리도 측정용 시료를 채취하였다. PCS를 이용한 방법과 비교를 위하여 PCS를 이용하지 않은 상태로 상압에서 알칼리도를 측정하여 비교하였다. ACWK의 경우 알칼리도 측정 중에 CO2가 탈기 될 수 있으므로 PCS를 이용하여 측정하였으나, ACWM의 경우 높은 pH로 인해 CO2 탈기가 발생할 수 없기 때문에 상압 알칼리도 측정만 수행하였다.
2.3.1. 상압에서 알칼리도 측정
고압 pH 측정이 끝난 후 Fig. 2의 V5와 V6를 열어 ACWK를 약 50 mL 채취 하였다. 메스실린더로 시료의 부피를 측정한 후 시료를 비커에 옮겨 담고 1 N HNO3 용액이 담긴 뷰렛을 이용하여 Gran 적정법으로 측정하였다(Drever, 1997; Kim et al., 2019). Gran 적정 시 pH는 Hach 사의 전극으로 측정하였다. ACWM 시료의 경우 알칼리도가 높지 않기 때문에 Mettler Toledo 사의 T50 적정기(titrator)를 이용하였다. 이때 pH는 Mettler Toledo 사의 DGi115-SC 전극을 이용하여 측정하였다. Hach pH 전극과 Mettler Toledo pH 전극은 측정 전에 pH 4, 7, 10으로 보정하였고, 표준용액으로 정확도를 확인하였다.
2.3.2. PCS를 이용한 고압 유체 시료 알칼리도 측정
ACWK 시료의 CO2 탈기를 방지하기 위한 PCS 이용, 알칼리도 측정 방법은 다음과 같다(Fig. 2).
1. 알칼리도 측정용 시료 채취 이전 PCS와 V7 사이의 나사형 주입구(inlet)를 열고, 주사기를 이용하여 15.1 mL의 1 M KOH 용액을 주입한다. 이때 PCS 내부의 압력이 상압(G2 확인)이어야 주사기를 밀어 넣는 압력으로 KOH 용액이 주입될 수 있다. 따라서 V8을 외기가 통하는 방향으로 열어준다. KOH 용액을 주입 후에는 V8을 닫는다.
2. BP(back pressure pump)에 N2를 약 200 mL 채운다. 이때 N2의 압력은 ACWK의 압력인 1 MPa보다 낮은 압력을 유지한다(약 0.95 MPa). 압력은 BP와 G2로 확인한다.
3. V8을 PCS 방향으로 열고, BP를 정압으로 설정한 후, V7과 V5를 열어 ACWK를 PCS로 주입한다. 이때 V5로 유량을 조절하여 ACWK가 급히 PCS로 유입되지 않도록 주의한다. 피스톤이 끝까지 이동한 후에는 G1을 통해 PCS 내부 시료의 압력이 1 MPa인 것을 확인한다.
4. 채취된 용액을 회수하기 위하여 V7을 분리하고, PCS를 위아래로 천천히 흔들어서 K2CO3의 침전을 유도한다.
5. 이후 V7을 천천히 열어서 용액을 회수한다. 이때 피스톤은 가압된 N2가 밀어주게 된다.
6. 회수된 용액은 메스실린더로 부피를 측정하고, 1 N HNO3 용액으로 Gran 적정을 수행하였다. 이때 pH는 Hach 사의 전극을 이용하여 측정하였다.
PCS를 이용한 알칼리도 측정 후, KOH에 의한 알칼리도 증가분을 차감하여 실제 ACWK의 알칼리도를 계산하였다(식 1).
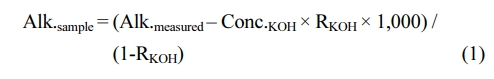
여기서, Alk.sample은 시료의 알칼리도, Alk.measure는 PCS 사용 후 측정한 알칼리도, Conc.KOH는 KOH의 농도(mol/L), RKOH는 KOH의 혼합비이다. PCS의 부피는 47.7 mL이고, KOH를 15.1 mL 첨가하였다. 1 MPa에서 물의 압축률을 고려하면 본 실험에서 RKOH는 0.315이다.
|
Fig. 1 Schematic diagram of transmitter, pH and reference electrode. The electrode must be calibrated before measurement and stored in the appropriate storage solution. |
|
Fig. 2 Schematic diagram of the process for measuring the pH and alkalinity of ACWK. G: Pressure gauge, PCS: piston cylinder sampler, CP: CO2 syringe pump, BP: back pressure pump, V: valves (V4·6·7: 2-way valves, V1·2·3·8·9·10: 3-way valves, V5: screw-type valve.). |
|
Fig. 3 Schematic diagram of the process for measuring the pH
and alkalinity of ACWM. The process is similar to that of ACWK,
but it differs in that N2 gas is used instead of CO2 gas. NP: N2
syringe pump. |
3.1. 고압 유체 시료 pH 측정 결과
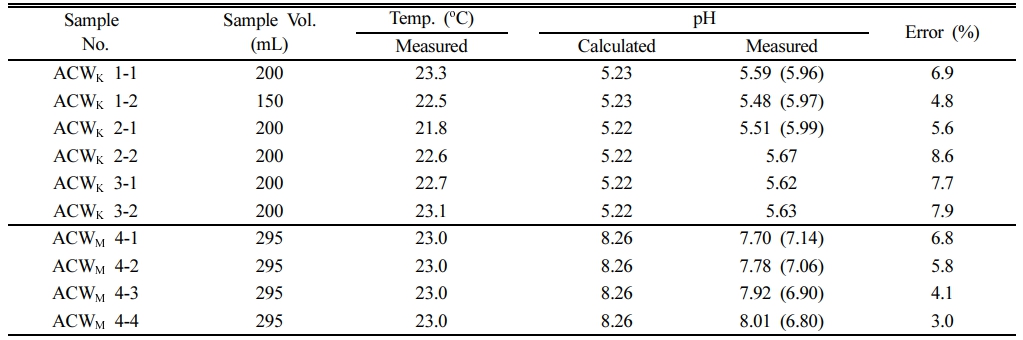
ACWK, ACWM의 pH 분석 결과를 Table 1에 나타내었다. ACWK의 경우 3개의 용액이 제조 되었는데, 각각 투입된 CaCl2∙2H2O, NaOH, HCl의 양이 조금씩 차이 났다. 제조할 때 측정된 각 시약의 질량과 실험 시 온도를 고려하여 각 ACWK의 pH를 PHREEQC로 계산한 결과는 5.22~5.23으로 일정하다(Table 1). ACWK를 고압 전극으로 측정한 pH는 5.48에서 5.67로 나타났으며, 계산값과 0.25~0.45 정도의 차이를 나타내고 있다. 계산한 값을 기준으로 하는 오차는 4.8~8.6%로 계산값과의 차이는 크지 않았다(Table 1). 한편 ACWM의 경우 pH는 8.26으로 계산되었는데, 측정 결과는 그에 비해 0.25~0.56 낮은 7.70~8.01로 나타났다(Table 1). 계산값을 기준으로 한 오차는 3.0~6.8%이다. ACWK에 비하여 ACWM의 오차율이 낮은 이유는 ACWM의 pH가 높기 때문이다. ACWK와 ACWM 고압 pH 측정 오차율의 평균은 6.1(± 1.8)%이다.
Table 1에는 Gran 적정의 초기 pH 값을 괄호 안에 나타내었다. 이는 고압 유체 시료를 대기에 노출하여 상압에서 측정한 값이다. ACWK의 경우 Hach사의 pH 전극으로 측정하였고, ACWM은 Mettler Toledo 사의 pH 전극으로 측정하였다. ACWK의 경우 5.96~5.99로 측정되었다. 계산값인 5.22~5.23 보다 0.73~0.77 높은 값으로, 고압 pH 전극으로 측정된 값에 비하여 더 높게 나타났다. 이는 ACWK로부터 CO2 탈기가 발생하여 pH가 높아진 것으로 판단된다. 한편 ACWM의 경우 6.80~7.14로 계산값에 비하여 1.12~1.46 낮게 나타났다. 이는 고압 pH 전극으로 측정된 값에 비하여 0.56~1.21 더 낮은 값이다. 이는 대기 중의 CO2가 시료로 유입된 결과로 판단된다. 고압 유체 시료의 pH는 상압에서 대기와 접촉할 경우 짧은 시간 내에 변화하며 정확도가 감소한다. 따라서 고압 pH 측정 장치가 더 정확하다고 할 수 있다.
3.2. 알칼리도 측정 결과
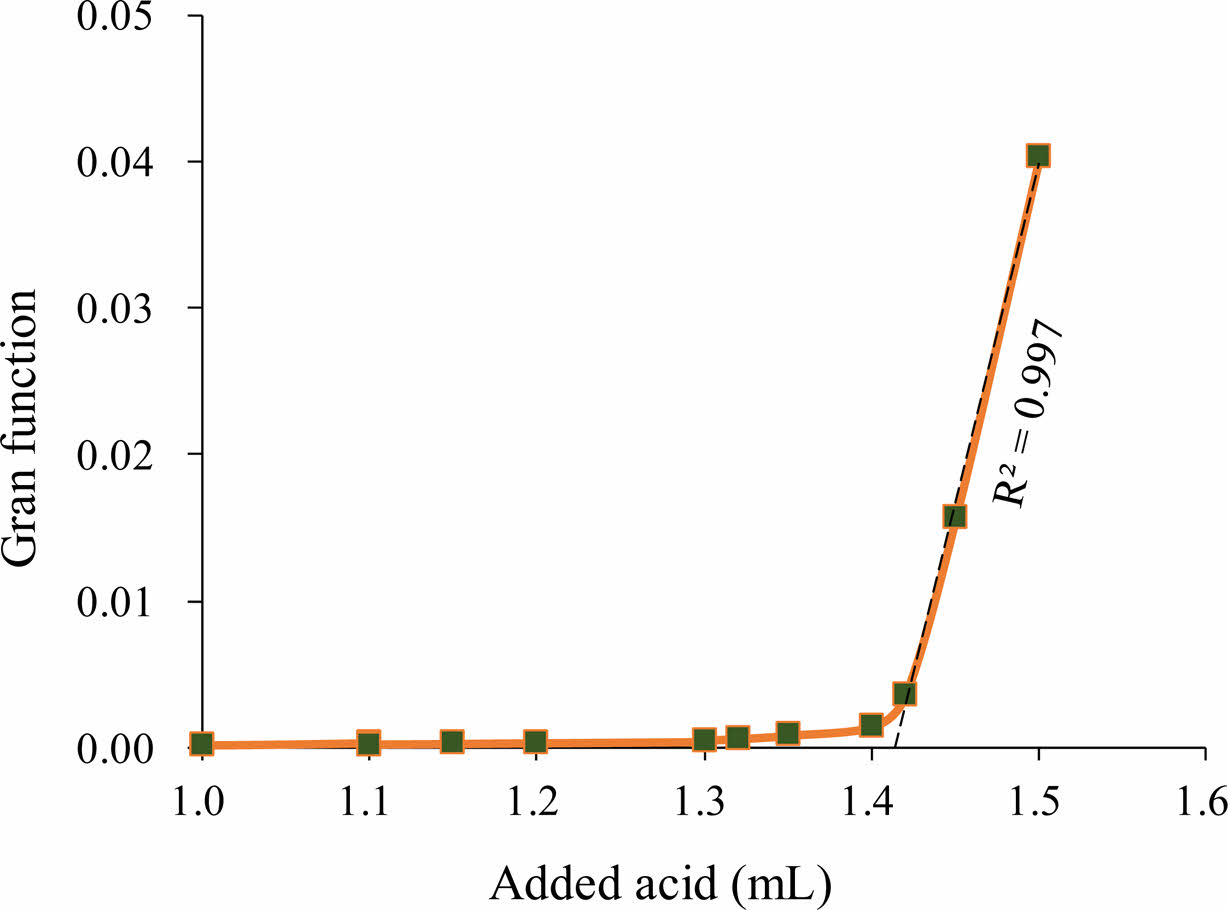
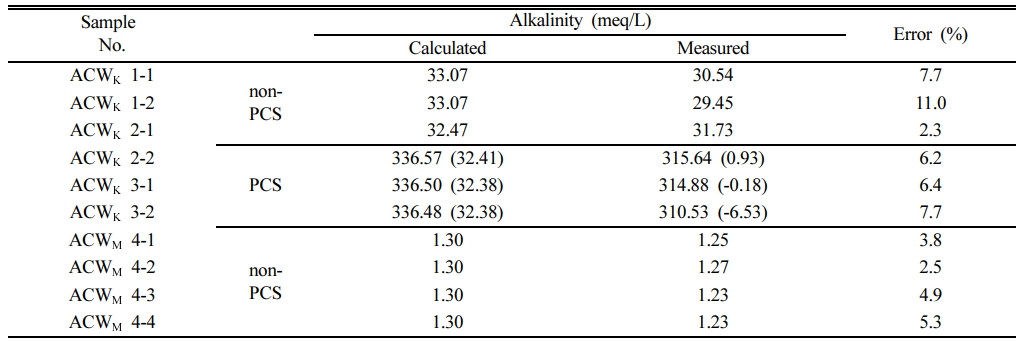
ACWK와 ACWM의 알칼리도 측정 결과를 Table 2에 나타내었다. Fig. 4에는 Gran 적정법의 예시를 나타내었다. Gran 적정법은 x 축에 첨가된 산의 부피, y 축에는 산의 부피를 고려한 H+이온의 몰수((Vsample+Vacid)ㆍ10-pH)를 도시하여 당량점에 해당하는 산의 부피를 구하는 방법이다(Drever, 1997; Kim et al., 2019). Fig. 4에서 시료의 H+ 이온에 대한 완충효과가 사라지면, 첨가한 산의 부피에 대해 H+의 몰수가 선형적으로 증가한다. 이 직선이 x축과 만나는 점은 산이 첨가된 이후부터 시료의 완충능(buffer capacity)이 없다는 가상의 점이 되고, 이를 당량점으로 삼아서 알칼리도를 계산한다.
PCS를 사용하지 않고 측정한 ACWK의 알칼리도는 29.45~31.73 meq/L로 나타났다. 이는 계산값인 32.47~ 33.07에 비하여 약 0.74~3.62 meq/L 낮은 값으로 계산값을 기준으로는 2.3~11.0% 차이 나는 값이다(Table 2). ACWM의 알칼리도는 1.23~1.27 meq/L로 계산값 1.30 meq/L보다 0.03~0.07 낮게 나타났다(Table 2). 계산값을 기준으로 한 오차는 2.5~5.3%로 계산값에 매우 근접하여 나타났다.
반면 PCS를 사용하는 경우 KOH의 영향을 반영하였을 때, 알칼리도의 계산값은 336.48~336.57 meq/L이고, 측정값은 310.53~315.64 meq/L로 계산값에 비하여 20.93~ 25.95 meq/L 낮게 나타났다(Table 2). 계산값을 기준으로 하는 오차율은 6.2~7.7%로 PCS를 사용하지 않은 경우보다 계산값에 근접하여 정확도가 높다고 평가될 수도 있다. 그러나 식 1을 이용하여 KOH의 영향을 빼주었을 경우 알칼리도는 각각 –6.53~0.93 meq/L로 계산값(32.38~32.41 meq/L)과 매우 큰 차이를 나타낸다(Table 2). 식 1을 본 실험에 적용하였을 때 KOH 용액의 알칼리도(약 1,000 meq/L)가 ACWK 시료에 비하여 높기 때문에 KOH 영향을 뺀 알칼리도(Alk.sample)는 KOH 혼합비에 매우 민감하다. 즉 혼합비를 정밀하게 측정하지 않을 경우 PCS를 사용할 때 알칼리도의 오차는 더 크게 나타난다.
본 연구에서는 PCS의 부피와 KOH의 부피를 정밀하게 측정하였고, KOH의 압축률까지 고려하여 혼합비를 계산하였다. 혼합비를 보다 정밀하게 측정하기 위해서는 KOH 주입 후와 샘플 주입 후 PCS 부분을 분리하여 각각 무게를 측정하면 된다. 그러나 PCS를 분리하고 재결합하는 과정은 현장에서 번거롭고, 오차를 발생시킬 가능성이 더 높기 때문에 실용적이지 않다. KOH의 농도를 낮추는 것도 오차를 줄이기 위한 방법이 될 수 있다. 그러나 참값을 모르는 미지의 시료를 측정하는 경우 적절한 KOH 농도를 미리 결정하는 것은 어렵다. 예비 실험 또는 PCS 없이 측정 후 그에 맞는 KOH 농도를 결정할 수 있으나, 이 또한 현장에서 적용하기에는 번거로울 수밖에 없다. PCS 없이 측정한 알칼리도의 오차율이 1개 시료를 제외하고는 2.3~7.7%로 비교적 계산값에 근접하게 나타났다(Table 2). 오차율이 11%인 ACWK 1-2 시료의 경우 ACWK에 CO2를 가압하는 과정에서 제조한 ACW의 양이 상대적으로 적은 시료였다(Table 1). 따라서 CO2가 다른 시료에 비하여 더 용해되었을 가능성이 있으며, 이에 따라 다른 시료에 비하여 pH가 낮게 나타난 바 있다. 결론적으로 PCS를 사용하지 않고 측정된 알칼리도의 정확도는 높다고 평가할 수 있으며, PCS를 현장에서 사용할 경우 발생할 수 있는 오차 요인을 피하는 방법일 수 있다.
알칼리도는 용액에 산(H+)이 첨가되더라도 pH를 유지시킬 수 있는 완충능을 의미한다. 따라서 용액 내에 약산의 짝염기의 농도이며, 보존성(conservative) 양이온에서 약산의 짝염기를 제외한 보존성 음이온을 빼준 값으로 정의된다(Drever, 1997). 따라서 알칼리도는 보존성을 띄게 되며, CO2가 탈기되는 환경에서 측정되더라도 이론적으로는 그 값을 유지하게 된다. 다만 알칼리도 값을 중탄산염(HCO3-)이나 탄산염(CO32-) 등 약산의 짝염기의 농도로 환산할 시 되도록 원위치에서 측정된 pH를 사용하여야 한다. Jo et al.(2009)은 제조한 ACW에서 CO2가 탈기되도록 실험실에 방치한 후(24, 48 시간), 산 중화 적정법, 역 적정법, 침전법, NDIR-TC 측정법을 이용하여 알칼리도와 총 탄소 함량을 측정하였다. 그 결과 알칼리도는 CO2 탈기와 무관하게 일정한 값이 유지됨을 관찰 한 바 있다. 따라서 본 연구에서도 PCS를 사용하지 않은 경우 CO2가 탈기되거나 용해됨(pH 변화)에도 불구하고 알칼리도는 계산된 값에 근접하여 나타났다.
Kampman et al.(2014)은 본 연구에서 활용한 PCS의 원형인 micro-piston separator sample cylinder(이하 PCS)를 이용하여 시료에 KOH를 혼합한 후 측정한 CO2(aq)와 현장에서 바로 측정한 알칼리도를 통해 계산한 CO2(aq)가 크게 차이 나지 않음을 보인 바 있다. 본 연구에서와는 다르게 Kampman et al.(2014)에서 두 값의 차이가 크지 않은 이유는 KOH의 농도(3 M)가 적절하게 선정되었고, 혼합비도 비교적 정확하게 측정되었기 때문으로 사료된다. 따라서 두 값의 차이가 크지 않다면, PCS를 사용하지 않는 것이 오히려 현장에서 적용하는데 오차 요인을 줄이고 효율적일 수 있다고 판단된다. 다만 PCS를 활용할 경우 시료의 압력을 유지하면서 샘플링이 가능하기 때문에 CO2 탈기를 원천적으로 차단할 수 있는 장점이 있다. 따라서 탄소동위원소 분석용 시료를 채취하는 데에 더 유용하게 사용될 수 있다.
|
Fig. 4 Gran titration plot. x-axis: volume of injected acid (mL), y-axis: Gran function = (Vsample+Vacid)×10-pH. |
|
Table 1 Comparison of the pH predicted by PHREEQC and measured using high-pressure pH electrode |
|
|
Table 2 Comparison of the alkalinity predicted by PHREEQC and experimentally measured using Gran titration |
|
본 연구에서 구성한 고압 유체 시료 pH 측정 장치의 정확도는 우수한 것으로 평가된다. 다만 Corr 사의 전극을 사용할 때, 기준전극에 채우는 용액의 KCl 농도를 포화농도로 사용해야 함에 사전 주의하여야 한다. 실험 결과, CO2 함량이 높고, 낮은 pH를 나타내는 해외 사례와 CO2 함량이 낮고, pH가 높은 해외 사례를 참고하여 제조한 ACW를 활용한 실험 오차율은 평균 6.1%로 나타났다. 본 연구에서 수행한 방법은 향후 고압 pH 측정 장치를 CCS 모니터링 현장에서 적용할 때 정확도를 확인하는 방법으로 활용 가능하다. 또한 작업자의 숙련도를 높이는 훈련 과정으로도 활용될 수 있다. 한편 CO2의 탈기를 막고 용존 CO2를 고정하여 알칼리도를 측정할 수 있는 PCS 활용 방법은 CCS 모니터링 현장에 적용하는 데 실용적이지 않다. 이는 KOH의 혼합비 측정, KOH 농도를 결정하는 방법이 번거롭고 오차를 유발할 수 있기 때문이다. 본 연구에서는 PCS를 활용하여 알칼리도를 측정한 경우, KOH의 영향을 감해주었을 때 계산값과 측정값의 오차율이 증가하였다. 따라서 알칼리도는 대기압 환경에서 Gran 적정법으로 측정하는 편이 오히려 더 적합하다. 다만 대기 CO2의 유출입을 막아야 하는 탄소동위원소 분석용 시료의 전처리에는 PCS를 활용하는 것이 바람직하다. 본 연구에서 정립된 고압 유체 시료의 pH와 알칼리도 측정 방법은 CCS 모니터링 분야뿐만 아니라 탄산수에 대한 CCS 자연유사 연구, CO2-암석 반응실험, 코어 유동실험에 활용되길 기대한다.
본 연구는 한국지질자원연구원에서 수행 중인 “CO2 지중저장소 저장효율 향상 및 안전성 평가 기술 개발(GP2020-025)” 과제의 일환으로 수행되었습니다.
- 1. 국무조정실, 2023, 탄녹위 전체회의 보도자료: 2050 탄소중립 달성과 녹색성장 실현’을 위한 국가 전략 및 제1차 국가 기본계획 의결, https://www.opm.go.kr/opm/news/press-release.do?mode =view&articleNo=153151 [Accessed on 27 December 2023]
- 2. Ajayi, T., Gomes, J.S., and Bera, A., 2019, A review of CO2 storage in geological formations emphasizing modeling, monitoring and capacity estimation approaches, Pet Sci, 16, 1028-1063, doi:10.1007/s12182-019-0340-8
-

- 3. Alfredson, H.A., Mesfin, K.G., and Wolff-Boenisch, D., 2016, The syringe sampler: An inexpensive alternative borehole sampling technique for CO2-rich fluids during mineral carbon storage, Greenh Gases, 6(2), 167-177, doi:10.1002/ghg.1543
-

- 4. Blackford, J., Bull, J.M., Cevatoglu, M., Connelly, D., Hauton, C., James, R.H., Lichtschlag, A., Stahl, H., Widdicombe, S., and Wright, I.C., 2015, Marine baseline and monitoring strategies for carbon dioxide capture and storage (CCS), Int J Greenh Gas Control, 38, 221-229, doi:10.1016/j.ijggc.2014.10.004
-

- 5. Boreham, C., Underschultz, J., Stalker, L., Kirste, D., Freifeld, B., Jenkins, C., and Ennis-King, J., 2011, Monitoring of CO2 storage in a depleted natural gas reservoir: gas geochemistry from the CO2CRC Otway Project, Australia, Int J Greenh Gas Control, 5(4), 1039-1054.
-

- 6. Cheong, S. and Kim, B.-Y., 2020, Time-lapse seismic monitoring technique for the Otway site, KSMER, 57(1), 35-44, doi: 10.32390/ksmer.2020.57.1.035
-

- 7. Corr Instruments, 2009, High-Temperature High-Pressure pH and Reference Probes Instruction Manual, https://www.salaty. com.my/wp-content/uploads/pdf/CORR INSTRUMENTS/AN/Instructions_high_P&T_pH&Ref_probes_Sep_2009.PDF [Accessed on 27 December 2023]
- 8. Drever, J.I., 1997, The Geochemistry of Natural Waters: Surface and Groundwater Environments, 3rd Edition, Prentice Hall, Upper Saddle River, NJ USA, 436pp
-

- 9. Freifeld, B.M., Trautz, R.C., Kharaka, Y.K., Phelps, T.J., Myer, L.R., Hovorka, S.D., and Collins, D.J., 2005, The U‐tube: A novel system for acquiring borehole fluid samples from a deep geologic CO2 sequestration experiment, J Geophys Res Solid Earth, 110, B10, doi:10.1029/2005JB003735
-

- 10. Jo, M., Chae, G.-T., Koh, D.-C., Yu, Y., and Choi, B.-Y., 2009, A Comparison study of alkalinity and total carbon measurements in CO2-rich water, J. Soil Groundwater Environ., 14(3), 1-13
- 11. Jones, D.G., Beaubien, S.E., Blackford, J.C., Foekema, E.M., Lions, J., De Vittor, C., West, J.M., Widdicombe, S., Hauton, C., and Queiros, A.M., 2015, Developments since 2005 in understanding potential environmental impacts of CO2 leakage from geological storage, Int J Greenh Gas Control, 40, 350-377, doi:10.1016/j.ijggc.2015.05.032
-

- 12. Kampman, N., Bickle, M.J., Maskell, A., Chapman, H.J., Evans, J.P., Purser, G., Zhou, G., Schaller, M.F., Gattacceca, J.C., Bertier, P., Chen, F., Turchyn, A.V., Assayag, N., Rochelle, C., Ballentine, C.J., and Busch, A., 2014, Drilling and sampling a natural CO2 reservoir: Implications for fluid flow and CO2-fluid–rock reactions during CO2 migration through the overburden, Chem Geol, 369, 51-82, doi:10.1016/j.chemgeo.2013.11. 015
-

- 13. Kharaka, Y.K., Cole, D.R., Thordsen, J.J., Kakouros, E., and Nance, H.S., 2006, Gas–water–rock interactions in sedimentary basins: CO2 sequestration in the Frio Formation, Texas, USA, J Geochem Explor, 89(1-3), 183-186.
-

- 14. Kharaka, Y.K., Thordsen, J.J., Hovorka, S.D., Nance, H.S., Cole, D.R., Phelps, T.J., and Knauss, K.G., 2009, Potential environmental issues of CO2 storage in deep saline aquifers: Geochemical results from the Frio-I Brine Pilot test, Texas, USA, Appl Geochemistry, 24(6), 1106-1112.
-

- 15. Kim, K., Lee, J.-W., Choi, S.-H., Kim, S.-H., Kim, H., Hamm, S.-Y., and Kim, R.-H., 2019, Alkalinity measurement of groundwater using Gran titration method, J. Soil Groundwater Environ., 24(1), 10-16, doi: 10.7857/JSGE.2019.24.1.010
-

- 16. Litynski, J., Rodosta, T., and Brown, B., 2012, Best practices for monitoring, verification, and accounting of CO2 stored in deep geologic formations-2012 update. US DOE/NETL-2012/1568, 136pp
- 17. Matter, J.M., Stute, M., Sn©¡björnsdóttir, S.Ó., Oelkers, E.H., Gislason, S.R., Aradottir, E.S., Sigfusson, B., Gunnarsson, I., Sigurdardottir, H., Gunnlaugsson, E., Axelsson, G., Alfredsson, H.A., Wolff-Boenisch, D., Mesfin, K.G., Taya, D.F.R., Hall, J., Dideriksen, K., and Broecker, W.S., 2016, Rapid carbon mineralization for permanent disposal of anthropogenic carbon dioxide emissions, Science, 352(6291), 1312-1314. doi:10.1126/science.aad8132
-

- 18. Mörner, N.-A. and Etiope, G., 2002, Carbon degassing from the lithosphere, Glob Planetary Change, 33(1-2), 185-203, doi:10. 1016/S0921-8181(02)00070-X
-

- 19. Myrttinen, A., Becker, V., Mayer, B., van Geldern, R., and Barth, J.A.C., 2015, Determining in situ pH values of pressurised fluids using stable carbon isotope techniques, Chem Geol, 391,1-6. https://doi.org/10.1016/j.chemgeo.2014.10.015
-

- 20. Raghuraman, B., Gustavson, G., Mullins, O.C., and Rabbito, R., 2006, Spectroscopic pH measurement for high temperatures, pressures and ionic strength, AlChE Journal, 52(9), 3257-3265.
-

- 21. Roberts, J.J., Gilfillan, S.M.V., Stalker, L., and Naylor, M., 2017, Geochemical tracers for monitoring offshore CO2 stores, Int J Greenh Gas Control, 65, 218-234, doi:10.1016/j.ijggc.2017.07. 021
-

- 22. Shitashima, K., Maeda, Y., and Ohsumi, T., 2013, Development of detection and monitoring techniques of CO2 leakage from seafloor in sub-seabed CO2 storage, Appl Geochemistry, 30, 114-124, doi:10.1016/j.apgeochem.2012.08.001
-

- 23. Vesper, D. J., and Edenborn, H. M., 2012, Determination of free CO2 in emergent groundwaters using a commercial beverage carbonation meter. J Hydrol, 438-439, 148-155.
-

- 24. Yang, X., Buscheck, T.A., Mansoor, K., Wang, Z., Gao, K., Huang, L., Appriou, D., and Carroll, S.A., 2019, Assessment of geophysical monitoring methods for detection of brine and CO2 leakage in drinking water aquifers, Int J Green. Gas Control, 90, 102803, doi:10.1016/j.ijggc.2019.102803
-

- 25. Yasemi, S., Khalili, Y., Sanati, A., and Bagheri, M., 2023, Carbon capture and storage: Application in the oil and gas industry, Sustainability, 15(19), 14486, doi:10.3390/su151914486
-

- 26. Zhang, R.H., Zhang, X.T., and Hu, S.M., 2008, Zr/ZrO2 sensors for in situ measurement of pH in high-temperature and-pressure aqueous solutions, Anal Chem, 80(8), 2982-2987.
-

 This Article
This Article
-
2024; 29(1): 1-9
Published on Feb 29, 2024
- 10.7857/JSGE.2024.29.1.001
- Received on Dec 28, 2023
- Revised on Jan 14, 2024
- Accepted on Jan 31, 2024
 Services
Services
Shared
 Correspondence to
Correspondence to
- Soohyeon Moon
-
Korea Institute of Geoscience and Mineral Resources (KIGAM), Daejeon 34132, Korea
- E-mail: munarang@naver.com