- Selection of Plant Species for Phytoremediation of Heavy Metal (As and Cd) Contaminated Soil using Hydroponic Culture
Bumjun Kim1·Bumhan Bae2*·Younghun Kim3
1Beautiful Environment Construction, Seongnam, Gyeonggi 13207, Korea
2Department of Civil & Environmental Engineering, Gachon University, Seongnam 13120, Korea
3Department of Environmental Engineering, Andong University, Andong 36729, Korea- 수경재배에 의한 중금속 (As 및 Cd) 오염토양의 식물상 복원공법 적용 식물종 선별
김범준1·배범한2*·김영훈3
1아름다운환경건설
2가천대학교 토목환경공학과
3안동대학교 환경공학과This article is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Phytoremediation presents a low-carbon and eco-friendly solution for heavy metal-contaminated soils, which pose great health and environmental risks to humans and ecosystems. A hydroponic culture was used to quantitatively assess the phytoremediation potential of plant species to remediate As or Cd-contaminated soil in field application. This study examined the growth, uptake, and distribution of Cd in the roots and shoots of Phalaris arundinacea and Brassica juncea in hydroponic conditions with Cd concentrations ranging from 0 to 20 mg/L for 10 days. Additionally, Aster koraiensis and Pteris multifida were cultivated in hydroponic conditions containing As concentrations ranging from 0 to 40 mg/L for 10 days. The concentrations of Cd in the above-ground part and root tissues of P. arundinacea and B. juncea reached a maximum of 147.7 and 1926.7 mg/kg-D.W.(Dry Weight), and 351.6 and 11305.5 mg/kg-D.W., respectively. Bioconcentration factor (BCF) for P. arundinacea and B. juncea were 68.9 and 122.3, respectively. Both species exhibited a translocation factor (TF) of less than 0.1, indicating their eligibility for phytostabilization. Aster koraiensis exhibited significant As accumulation of 155.1 and 1306.7 mg/kg D.W. in the above-ground part and root, respectively. However, this accumulation resulted with substantial weight loss and the manifestation of toxic symptoms. P. multifida exhibited higher accumulation of As (345.1 mg/kg-D.W.) in the fronds than in the roots (255.4 mg/kg-D.W.), corresponding to BCF values of 18.6 and 7.6, respectively, and a TF greater than 1.2. A TF value greater than 1.0 indicates that P. multifida is a viable option for phytoextraction.
Keywords: Arsenic, BCF, Cadmium, Heavy metal, Hydroponics, Phytoremediation, TF
비소(As)와 카드뮴(Cd)은 자연함량이 낮은 미량금속(trace elements)으로, 유럽과 미국 표토의 As 평균농도는 각각 7.0 및 7.2 mg/kg이고(Stafilov et al., 2010), 지구 지각 Cd 평균농도는 0.15~0.2 mg/kg, 농경지 토양 평균농도는 약 1 mg/kg(Adriano, 1986)에 불과하다. 인위적인 자연개발, 광물채굴/제련, 농약 살포 등과 같은 인간 활동으로 미량 금속이 유출되어 생물이용성이 증가하고 생체에 축적되어 독성이 발현되는 것을 미량금속에 의한 환경오염으로 일컫는다(Adriano, 1986). 미량금속 중에서 As와 Cd는 생명체의 생리적/생화학적 작용에 불필요한 비필수 금속이므로, 생물체가 역치(threshold) 이상 흡수하면 생물체의 정상적 기능을 방해하는 독성이 발현된다(Ali et al., 2013). 두 물질은 미국 ATSDR(Agency for Toxic Substances & Disease Registry)의 독성물질 우선순위에서 As는 1위, Cd는 7위를 점하고 있을 정도로 독성이 강할 뿐 아니라 전 세계적으로 심각한 환경오염문제를 일으키고 있다(ATSDR, 2023).
As는 살충제, 인 함유 비료, 반도체, 광업 및 제련업, 석탄연소, 목재방부제 등과 같은 광범위한 산업공정에서 배출되며(Mondal et al., 2006), 지역적으로는 목재방부제 사용(Lebow et al., 2002), 전 세계적으로는 광업 및 제련(Nriagu, 1994)이 주된 오염원이다. Cd는 금속제련 부산물로 매우 안정하여, 도금, 플라스틱 안정화제, 배터리 및 강철 부식방지 등에 사용되면서 환경으로 유출된다. 특히 Cd는 식용작물에 흡수/축적되기 때문에 인간 건강에 장기적으로 가장 큰 위해를 주는 중금속이다(Cajuste and Laird, 2001). 벵갈 삼각주와 같은 자연적 기원 혹은 브라질 같이 자연함량이 높은 지역을 제외하면, 대부분의 As 혹은 Cd에 의한 환경오염은 산업 활동에 기인한다(Adriano, 1986). 국내에서도 장항 제련소에서 굴뚝에서 중금속이 입상으로 배출되어, 굴뚝을 기점으로 반경 2 km내 토양이 주 오염물질인 As가 대책기준이상으로 검출되었고, Pb, Cd, Ni, Zn 및 Cu에 의한 오염도 확인되어, 반경 2 km를 벗어난 곳에도 국지적으로 As와 Cd 오염토양이 존재하여 국가에서 토지를 매입하고 정화하였다(Moon et al., 2011; Kim et al., 2016).
토양정화공법 중에서 식물상 정화공법은 식물에 의해 토양오염물질을 축적, 분해 및 안정화하는 친환경적이고 경제적인 생태공학기술로, 오염지역이 넓고 심도가 얕으며, 이동성 및 인간 및 생태계에 급성 위해도가 낮아 시급한 정화가 필요하지 않은 오염지역에 적합하다. 그 중에서 식물상 추출법은 오염된 토양/지하수에 중금속을 선택적으로 흡수/축적하는 식물을 재배하고, 중금속을 흡수한 식물체를 수확함으로써 중금속을 제거하는 방법이다. 단점으로는 식물 생장에 의존적이어 정화기간이 길고, 고농도 오염에 적용하기 어렵고 먹이그물로의 유입가능성이 있다(Ali et al., 2013; Marques et al., 2009). 식물상 추출법에 사용하는 식물은 빠른 생장과 고생체량을 가지며, 축적농도가 높을 뿐 아니라 중금속에 대한 내성이 있어야 하고(Marques et al., 2009), 경제적인 종자/종묘 확보가 가능해야 한다.
식물상 안정화법은 근권 토양에서 식물 뿌리에 의한 수착, 침전, 착물화 및 환원 등의 반응으로 지하부에 중금속을 고정시켜 이동성과 생물 이용성을 감소시키는 방법이다(Ali et al., 2013). 식물상 안정화에 사용되는 식물은 과축적종일 필요는 없으나, 생체량이 크고 뿌리밀도가 높으며, 생장속도가 빨라 처리대상 지역을 신속히 식생으로 피복할 수 있어야 하며 중금속 독성에 대한 내성을 가지고 있어 지속적으로 생장할 수 있어야 한다(Yan et al., 2020). 이상과 같이 식물상 추출 혹은 안정화 공법의 성공적 적용을 위해서는 적합한 식물종 선별이 가장 중요하다.
식물체 중에서 As를 흡수하면서 Cd의 독성을 견딜 수 있는 식물은 극소수에 불과하다. Cd 과축적종으로 Thlaspi caerulescens가 보고되고 있으나(Benzarti et al., 2008), 식물 생체량이 작고 재배가 어려우며 외래종으로 국내 반입이 어렵다. 갓(Brassica juncea)은 겨자 과의 쌍떡잎식물로 1년생이며, Cd 축적종으로(Kirkham, 2006; Salt et al., 1995), 종자/묘를 쉽게 구할 수 있으며 재배방법도 널리 알려져 있는 식물이다. As와 Cd를 동시에 제거하는 식물로는 벼과에 속하는 갈풀(Phalaris arundinacea)이 보고된 바 있다. 갈풀은 성체의 길이가 180 cm에 달할 정도로 생체량이 크고, 들이나 물가와 같이 어디서나 잘 성장하는 식물로 질소비료 시비량에 따라 As 흡수량이 500~700 mg/kg에 달할 정도로 높고, As외에도 Cd를 ~2.5 mg/kg 흡수하였다(Poisa, 2010).
갈풀은 다년생 식물로 뿌리줄기로 번식하며, 척박한 지역에 잘 자라므로 As와 Cd를 동시에 제거하는데 적절한 식물종으로 판단된다. 일반적으로 갈풀을 포함하는 부들, 피, 벼 등과 같은 습지생육식물은 일반적으로 뿌리 표면에 Fe-As plaque가 형성되면서 As를 축적한다(Syu et al., 2013). 따라서 갈풀에 축적되는 As가 지하부에 Fe-As plaque로 축적되는지 아니면, 지상부로 이동하여 축적되는 지에 대한 확인도 필요할 것이다. 국내 자생식물로 종묘 취득이 쉬운 벌개미취(Aster koraiensis)는 As 오염토양에서 뿌리/토양 As 농도비가 2.35로 식물상 정화공법 가능성이 있으며(Usman et al., 2012), As 과축적종으로는 봉의꼬리(Pteris multifida)가 가장 많이 연구되었다(Tu and Ma, 2003; Zhao et al., 2002). 다만 봉의꼬리는 종묘가격이 높고, 공급수량이 제한적이라는 단점도 있다.
이상과 같이 식물상 추출공법에 적용할 식물종 선별을 위해 As 제거에는 봉의꼬리와 벌개미취를, Cd 제거에는 갓과 갈풀을 수경 재배하여 각 중금속에 의한 식물 독성을 관측하고, 식물의 지상부 및 지하부 중금속 농도를 측정하여 정량화한 다음 식물상 정화공법에 대한 적합성을 평가하였다.
2.1. 수경재배
수경재배는 식물 뿌리가 용해상태의 중금속에 직접 노출되므로, 중금속 흡수가 빠르고 이에 따른 중금속 독성이 식물체에 명확히 발현되며, 단기간에 설정된 조건하에서 많은 수의 실험이 가능한 장점이 있다. 더불어 식물이 독성을 견디며 식물체내 축적하거나 흡수할 수 있는 중금속 최대량을 산정할 수 있어, 본 연구와 같이 단기간의 선별실험에 적합하다. 수경재배 실험에 사용할 식물은 종묘상에서 구입한 식물을 온실로 이송한 다음, 오염되지 않은 배양토에 정식하여 온실에서 약 3주간 재배하였다. 이후 온실 재배 식물의 지상부 길이가 20 cm 이상 생장하고 뿌리가 잘 발달한 것을 확인한 다음 실험에 사용하였다.
온실 화분에서 재배한 식물은 뿌리가 상하지 않게 토양을 분리하고 세척하여 50% Hoagland 배양액(Epstein, 1972)에 5일간 순응시켰다. 수경재배는 원통형 1 L 반응조에 중금속 배양액을 0.8 L(50% 농도 Hoagland 배양액+중금속) 넣고, 반응조당 식물 1개체씩 식재하여 4배수로 실시하였다. 식물을 정식한 반응조는 식물생장상에서 낮/밤 16시간/8시간, 온도 25 ± 1oC, 습도 70% 조건에서 10일간 배양하였다. 이 때 백색 및 주황색 형광등으로 구성된 광원에서 공급하는 광합성영역의 광자 flux는 300 μmol/m2/s(약 22,000 Lux)이었고, 필터(0.2 μm)로 멸균한 공기(0.2 L/hour)를 지속적으로 공급하여 용액의 교반과 호기성 상태를 유지하도록 하였다. 갓과 갈풀은 Cd 흡수 실험에 적용하고, Cd 농도는 2.5, 5, 10 및 20 mg/L로 변화하였다. 벌개미취와 봉의꼬리는 As 흡수 실험에 사용하고, As 농도는 5, 10, 20 및 40 mg/L로 변화하였다. 또한 대조를 위해 모든 실험에서 무처리구(control)도 운영하였다.
2.2. 분석방법
식물체는 종이수건으로 물기를 제거하고 초기/말기 생체량을 측정하고, 70oC에서 3일간 건조하여 지상부 및 지하부 건량을 측정하였다. 식물체 중금속 농도는 마이크로웨이브 추출방법(EPA 3052 추출법, USEPA, 1996)으로 전처리하고, ICP-MS(Perkin Elmer-Elan DRC-e)로 분석하였다. 식물체 시료 분석의 정도관리를 위해 미국 National Institute of Standard and Technology에서 구매한 Apple leaves(Cat. no 1515)를 SRMs(Standard Reference Materials)으로 같이 분석하였다. 식물체 SRMs은 중금속 함량은 As와 Cd가 각각 0.04(±0.01) 및 Cd 0.01(±0.00) mg/kg이었고, 분석결과 As와 Cd가 각각 0.05(±0.01) 및 0.01(±0.00) mg/kg로 측정되었다. 실험 자료는 Microsoft Excel 2016을 사용하여, 신뢰한계 95% 및 이분산 가정 두 집단의 조건으로 T-test를 실시하였다.
3.1. 갓과 갈풀에 의한 생장 및 Cd 흡수
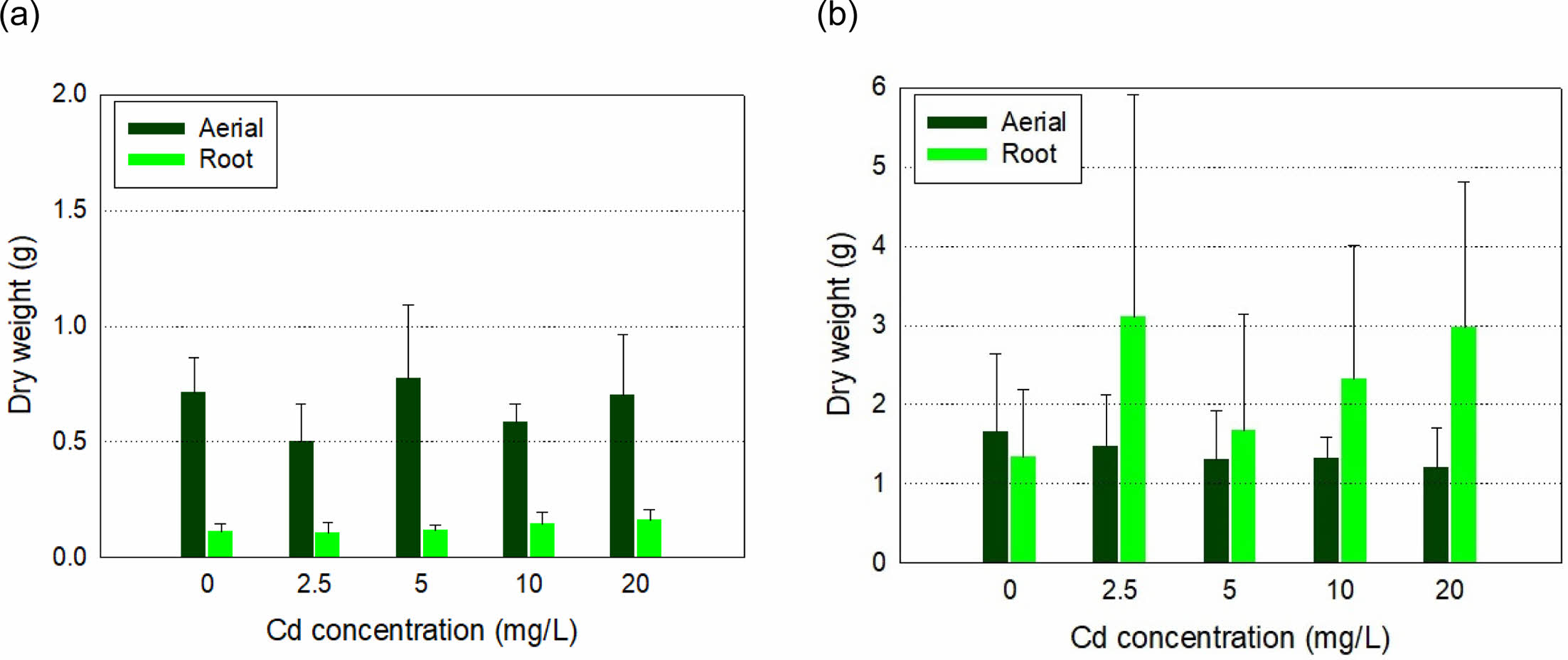
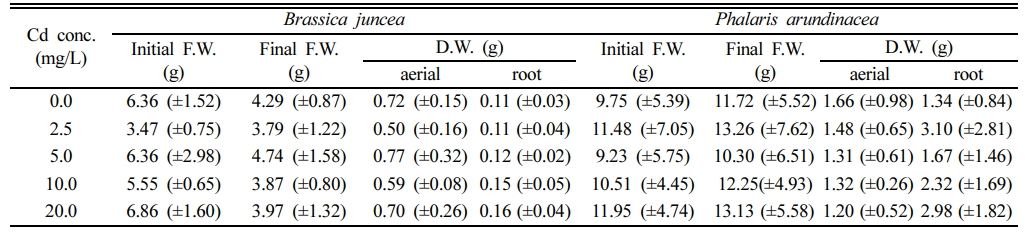
갓은 Cd로 오염된 재배용액에 노출한 경우 무처리군에 비해 지상부 건량이 다소 감소하는 경향을 보였다. 갓을 10~60 mg-Cd/L에서 수경 재배한 경우, Chl.-b 농도가 약 10% 감소하고, 생체 내 Mn 농도가 최대 38% 감소한 경우가 보고되었으나(Salt et al., 1995), 본 연구에서는 처리 농도가 낮아 떡잎과 아랫부분 잎이 황변하고 시든 것 외에 다른 독성은 관측되지 않았다. 또한 실험과정에서 꽃이 피거나, 꽃대가 새로 올라와 꽃이 피는 경우도 있었다(Fig. 1a). Cd 농도 증가가 갓의 건조중량에도 큰 영향을 주지 않았다(Fig. 2a). 재배 10일 후의 Cd 무처리구의 건조중량은 지상부와 지하부가 각각 0.72(±0.15) g 및 0.11(±0.03) g이었고, 20 mg-Cd/L 오염군에서도 각각 0.70(±0.26) g 및 0.16(±0.04) g으로 유의적인 차이가 없어(Table 1), 본 연구에서 사용한 Cd 농도 2.5~20.0 mg/L에 대한 내성이 있는 것으로 판단된다.
갈풀은 벼과의 수변식물이어서 갓보다 왕성하게 생장하였고, 재배과정에서 독성 영향도 관찰되지 않았다(Fig. 1b). 재배 10일의 생체량이 모든 처리구에서 초기 대비 2 g 이상 증가하였는데, 뿌리에서는 뿌리줄기가 새로 생장하였다. 용액 Cd 농도 증가에 따라 오차범위 내에서 지상부 건량이 감소하는 경향을 보였다(Fig. 2b). 최종 건량은 무처리구에서 개체당 지상부 및 지하부가 각각 1.66 (±0.98) g 및 1.34(±0.84) g이었고, Cd 2.5 mg/L 처리구에서 갈풀의 개체당 지상부 및 지하부 건량은 각각 1.48 (±0.65) g 및 3.10(±2.81) g이었다. 지상부 건량은 Cd 용액농도가 20.0 mg/L인 경우에는 1.20(±0.52) g으로 무처리구에 비해 약 38%가 감소하였지만(Table 1), 개체당 지하부 건량은 2.98(±1.82) g으로 무처리구에 비해 2배 이상 증가하였다. 갈풀이 뿌리로 번식하기에 지상부 건량이 감소하였으나, 생장을 위해 뿌리에서 새로운 줄기가 형성되는 과정에서 뿌리 건량이 증가한 것이라 판단된다.
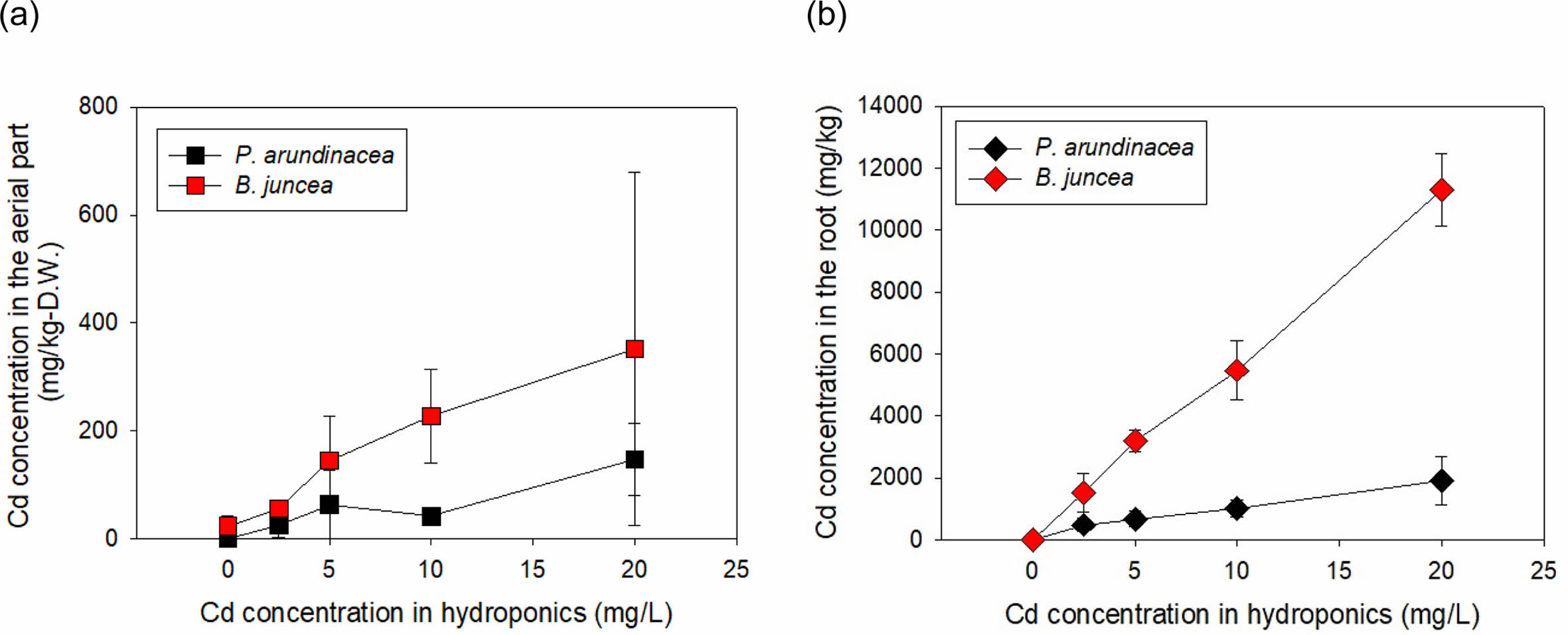
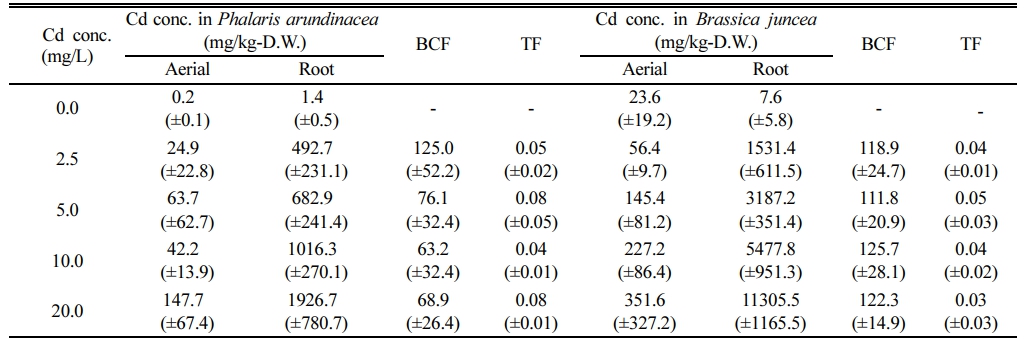
수경재배에서 Cd에 10일 간 노출시킨 갓의 생체 내 중금속 농도는 매우 높았다(Fig. 3). 뿌리 및 지상부에 축적된 Cd 농도는 용액 Cd 농도에 선형적으로 비례하여 증가하였다. 무처리구에서의 Cd 지상부 농도는 23.6 mg/kg-D.W.이었으나, 2.5 mg/L인 경우 56.4 mg/kg-D.W.이고 20.0 mg/L에서는 351.6 mg/kg-D.W.이 축적되었다. 지하부 Cd 농도는 무처리구에서는 7.6 mg/kg에 불과하였으나, 2.5 mg/L에서는 1,531.5 mg/kg-D.W.이며, 20.0 mg/L에서는 11,305.5 mg/kg-D.W.가 축적되었다. Salt et al.(1995)의 연구에서 갓을 60 mg/L 용액에서 7일간 배양한 결과 뿌리에 1,700 mg-Cd/kg-D.W.가 축적되었고, Nouairi et al.(2006)의 실험에서도 갓을 15일간 Cd 11.2 mg/L 오염배지에 수경 재배한 결과 뿌리의 Cd 농도는 약 4800 mg/kg-D.W.이었고, 지상부 Cd 농도는 약 320 mg/kg-D.W.이었다. 본 연구에서도 10 mg/L 용액에 노출되었을 때 지상부내 Cd 농도는 227.2 mg/kg-D.W.로 상기 연구와 유사한 경향을 보였다. 이상의 실험 결과로만 판단한다면, 갓은 최고 20 mg/L 농도의 Cd 독성에 내성이 있으며, 식물체에 축적된 Cd 농도로 보아 생물학적으로 이용가능한 Cd 농도가 높을 경우, 식물상축적에 적합한 식물로 판단된다.
갈풀을 10일간 수경 재배하여 측정한 식물체 중금속 농도는 갓에서와 같이 뿌리 및 지상부에 축적된 Cd 농도가 용액 Cd 농도에 선형적으로 비례하여 증가하였다(Fig. 3). 무처리구 갈풀의 지상부 및 지하부 Cd 함량은 각각 0.2 및 1.4 mg/kg-D.W.이었으나, 5.0 mg/L에서는 지상부 및 지하부 Cd 함량이 각각 63.7 및 682.9 mg/kg-D.W.이고, 20.0 mg/L에서 각각 169.9 mg/kg-D.W. 및 1,926.7 mg/kg- D.W.이었다. 강변에서 채취한 갈풀을 중금속(5 mg/L의 Cd, Pb 및 Ni)로 오염된 수경재배장치에서 6주간 배양한 결과, 갈풀 지하부 Cd 농도가 3.8 mg/L이었고, 지상부에서는 1.6 mg/L이었고(Bello et al., 2018), 오염지역의 하천변에서 채취한 갈풀의 Cd 최고 농도는 9.87 mg/kg이었지만 하천 오염도가 높을수록 증가하였다(Senze et al., 2022). 두 연구 모두 자연 조건에서 완전히 생장한 성체인 데 반해, 본 연구에서는 최적의 조건에서 활발히 생장하는 유식물이기에 Cd 생체 농도에서 차이가 발생한 것이라 사료된다. 본 실험의 갈풀이 타 연구에 비해 고농도 Cd를 흡수하였으나, 갓에 비하면 지상부와 지하부 Cd 농도는 각각 41 및 17%에 불과하였다.
3.2. 봉의 꼬리와 벌개미취에 의한 As 생장거동 및 흡수
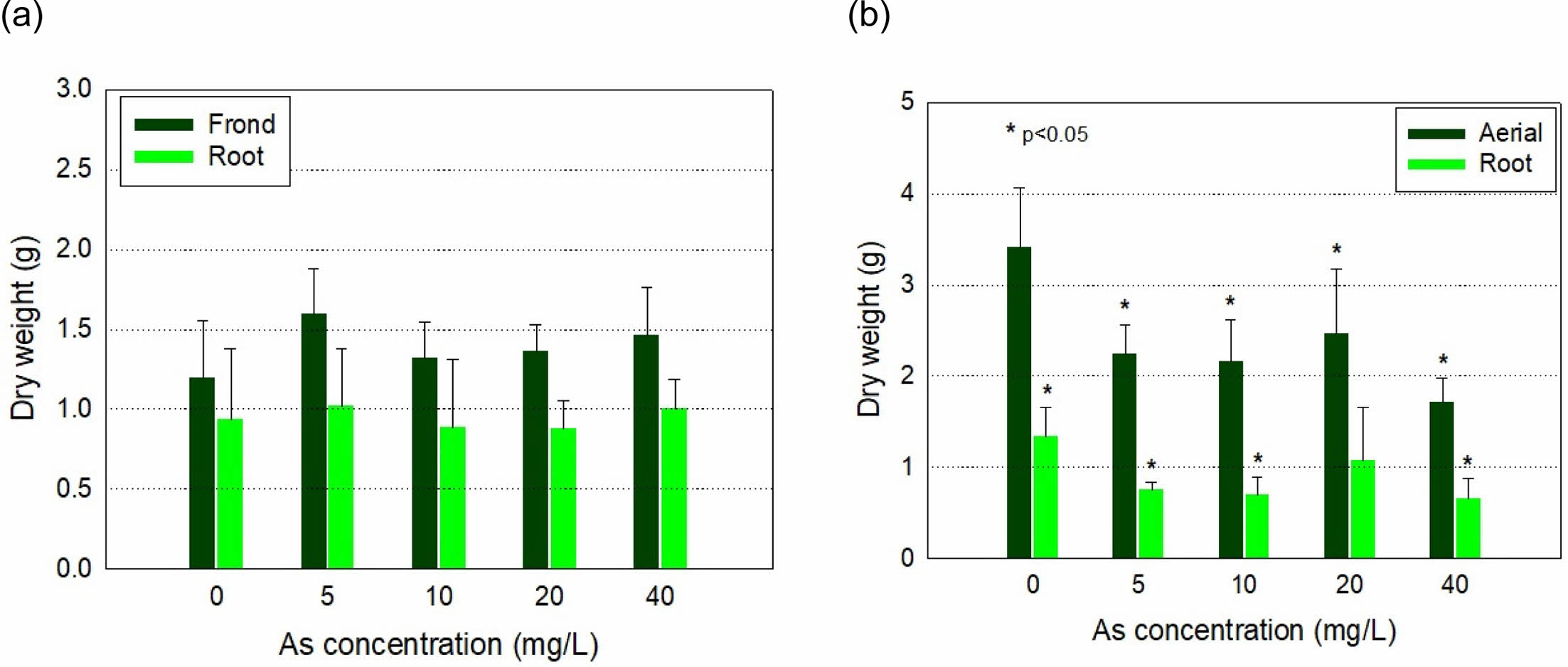
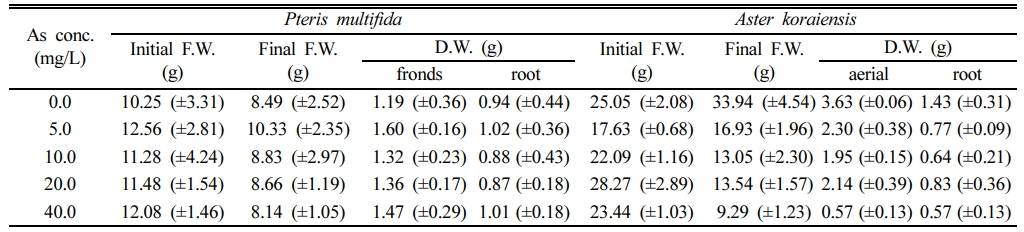
봉의꼬리와 벌개미취를 As 농도 5, 10, 20 및 40 mg/L로 인공오염 배지에서 수경 재배하여 생체량의 변화를 측정한 결과는 Table 2와 같다. 봉의꼬리 초기 생체량은 약 11 g이었으나, 정식 스트레스로 대조군을 비롯한 모든 처리구에서 잎의 건조현상이 발생했다. 이에 따라 수경 재배를 완료한 10일 후 생체량은 대부분의 처리구에서 8.6 g 내외로 약 2 g 이상 감소하였다. 그 이외의 황백화 현상 등 As 독성에 의한 식물체량 감소는 없었다(Fig. 3a).
반면 벌개미취에서는 As에 의한 독성으로 잎의 꼬이거나 처지고 줄기가 동그랗게 말리며, 천공 및 황백화 현상이 관찰되었다. As 10.0 mg/L 이상에서 생체량이 감소하였으며, As 40.0 mg/L 처리구에서는 초기 생체량 24.43 g에서 재배 10일 후 9.71 g으로 약 60% 감소하였다. 반면, 무처리구에서는 초기 생체량 22.53 g에서 10일 후 31.29 g으로 39% 증가하였다(Table 2). 건조중량을 측정하여 비교한 결과, 봉의꼬리는 지상부 및 지하부 모두에서 유의적인 변화가 일어나지 않았으나, 벌개미취에서는 As 첨가군의 지상부 건조중량 전부와 As 20 mg/L 첨가군을 제외한 지하부 건조중량이 모두 유의적(p < 0.05)으로 감소하였다(Fig. 3b).
두 종류의 무기 As arsenate(As(V), AsO43-) 혹은 arse- nite(As(III), AsO33-)는 식물 뿌리에서 쉽게 흡수되며, 직접적인 세포막 손상에 의한 전해질 유출, 활성산소(reactive oxygen species) 발생과 제거를 위한 항산화작용에 필요한 에너지 손실, 다양한 효소의 저해와 함께 잎에서의 안토시아닌 축적이 발생한다(Poynton et al., 2004; Zhao et al., 2008). As(V)는 인의 유사체로 인 전달경로를 통해 세포질로 이동한 다음, 산화적 인산화 과정에서 인과 경쟁하며 ATP 생산을 저해하고, As(III)는 dithiol (SH-) 친화적 특성으로 cystein이나 thiol 결합을 가진 효소를 저해한다(Finnegan and Chen, 2012). 이상의 작용으로 벌개미취에서 관측된 황백화, 생체량 감소 및 잎의 말림과 지상부의 처짐 등과 같은 현상이 발생한 것이라 할 수 있으며, 벌개미취는 As 처리 적합종은 아닌 것으로 판단된다.
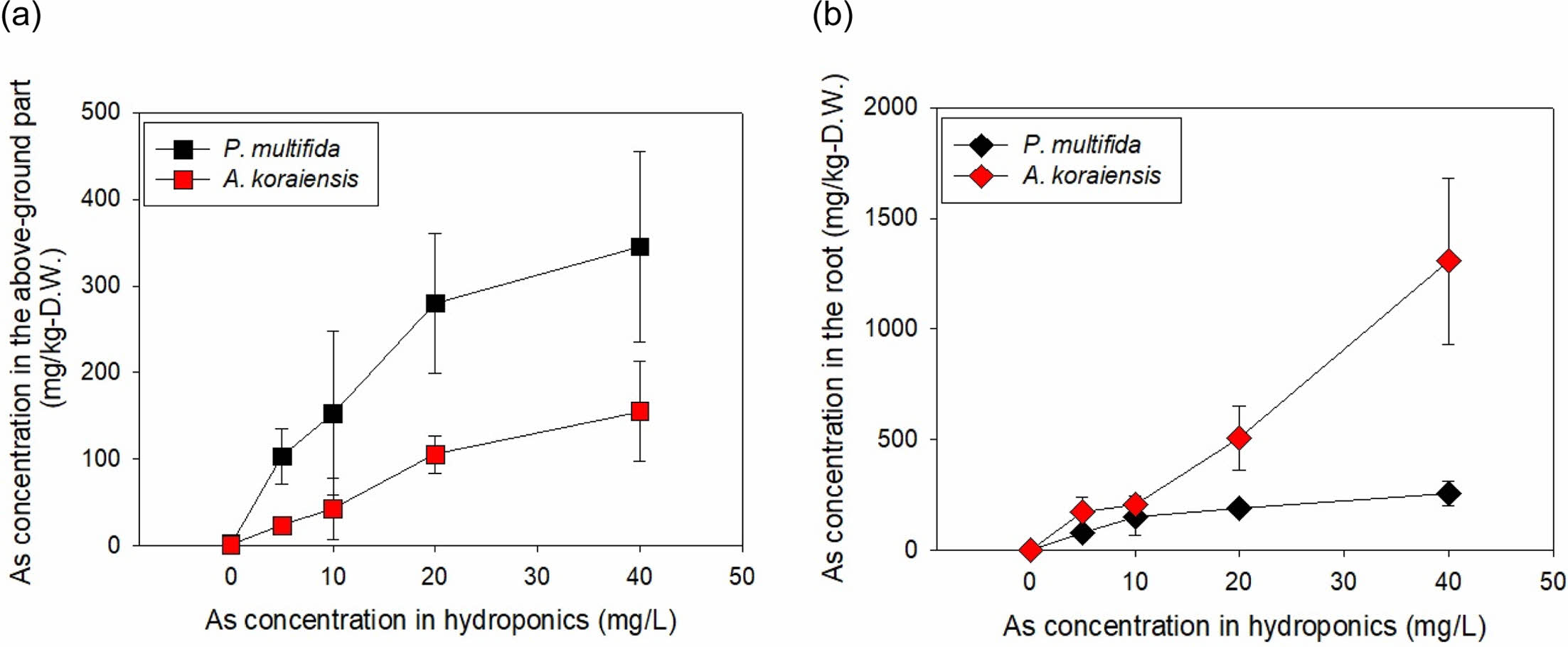
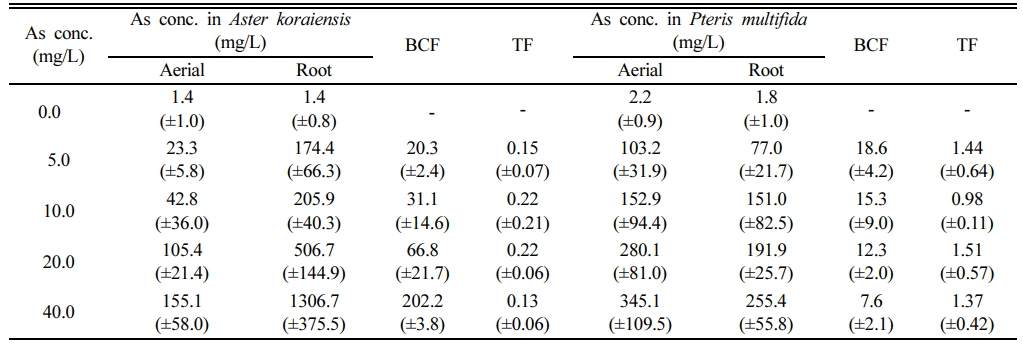
봉의꼬리를 As 인공오염배지에서 10일간 수경 재배한 후, 측정한 지상부 및 지하부 내 As 농도는 Fig. 4와 같다. 봉의꼬리에 의한 As 흡수는 Tu et al.(2004)의 연구에서와 같이, 포화곡선과 같이 용액 As 증가에 따라 생체(fronds 및 뿌리)농도가 감소하는 경향을 보였다. 무처리구에서는 봉의꼬리 지상부 및 지하부내 As 농도가 각각 2.23 및 1.83 mg/kg-D.W.이었으나, 배양액 As 농도가 5.0 mg/L에서 지상부 및 지하부 As 농도는 각각 103.21 및 77.01 mg/kg-D.W.으로 증가하였고, 배양액 As 농도 증가에 따라 봉의꼬리 식물체의 As 농도도 증가하였다. As 40.0 mg/L에서는 지상부 As 농도는 345.08 mg/kg-D.W., 지하부 As 농도는 255.41 mg/kg-D.W.이었다. 그러나 수경재배임에도 불구하고 봉의꼬리 지상부 As 농도가 과축적종의 기준인 1,000 mg/kg-D.W.를 초과하지는 못하였다(Reeves and Brooks, 1983). 이와 같은 결과는 실험에 사용한 식물체가 작고 노출기간이 짧았으며, 타 연구에 비해 As 농도가 낮았을 뿐 아니라(Zhao et al. 2002), 용액 pH가 As 이동성이 높은 알칼리성이 아닌 약산성(pH 6.0)이었기 때문이라 판단된다. Fig. 5
수경재배 실험에서 벌개미취 내 중금속 농도도 Fig. 6과 같이 용액 As 농도가 증가할수록 식물체 As 농도도 증가하였다. 지하부의 경우, As 40 mg/L에서 최대 1306.7 mg/kg-D.W.까지 축적되었다. 그러나 수경재배 실험과정에서 관측된 바와 같이 용액 As 농도가 5.0 mg/L 이상을 초과하면 독성으로 인해 벌개미취 생장이 극히 제한되었다. 따라서 수경재배 실험에서 의미 있는 자료는 As 5.0 mg/L에서의 농도인 지상부 23.26 및 지하부 174.40 mg/kg-D.W.에 국한하는 것으로 판단된다.
3.3. 식물농축계수 산정 및 식물종 평가
수경재배에서 수확한 식물체 건량당 중금속 농도(Table 3 and 4)에서 노출 농도별 BCF(Bioconcentration Factor)와 TF(Translocation Factor)를 각각 다음 식(1) 및 (2)으로 산정하고 Fig. 6에 정리하였다(Ali et al., 2013). BCF 계산에 사용한 식물체 중금속 평균농도는 지하부 및 지상부 건량과 각각의 중금속 농도를 고려하여 산정하였다.
토양 혹은 오염수에서 중금속을 흡수할 수 있는 능력은 BCF로, 흡수한 중금속을 수확가능한 지상부로 이송하는 능력은 TF로 평가하며, BCF와 TF가 큰 값일수록 식물상 정화법에 적합한 식물로 분류한다(Nouri, et al., 2011; Sakakibara et al., 2011). BCF는 주변 환경에서 식물이 흡수하여 축적하는 정도를 평가하는 값이며, 식물에 의한 중금속 축적여부를 나타내는 중요한 지표중의 하나이다.
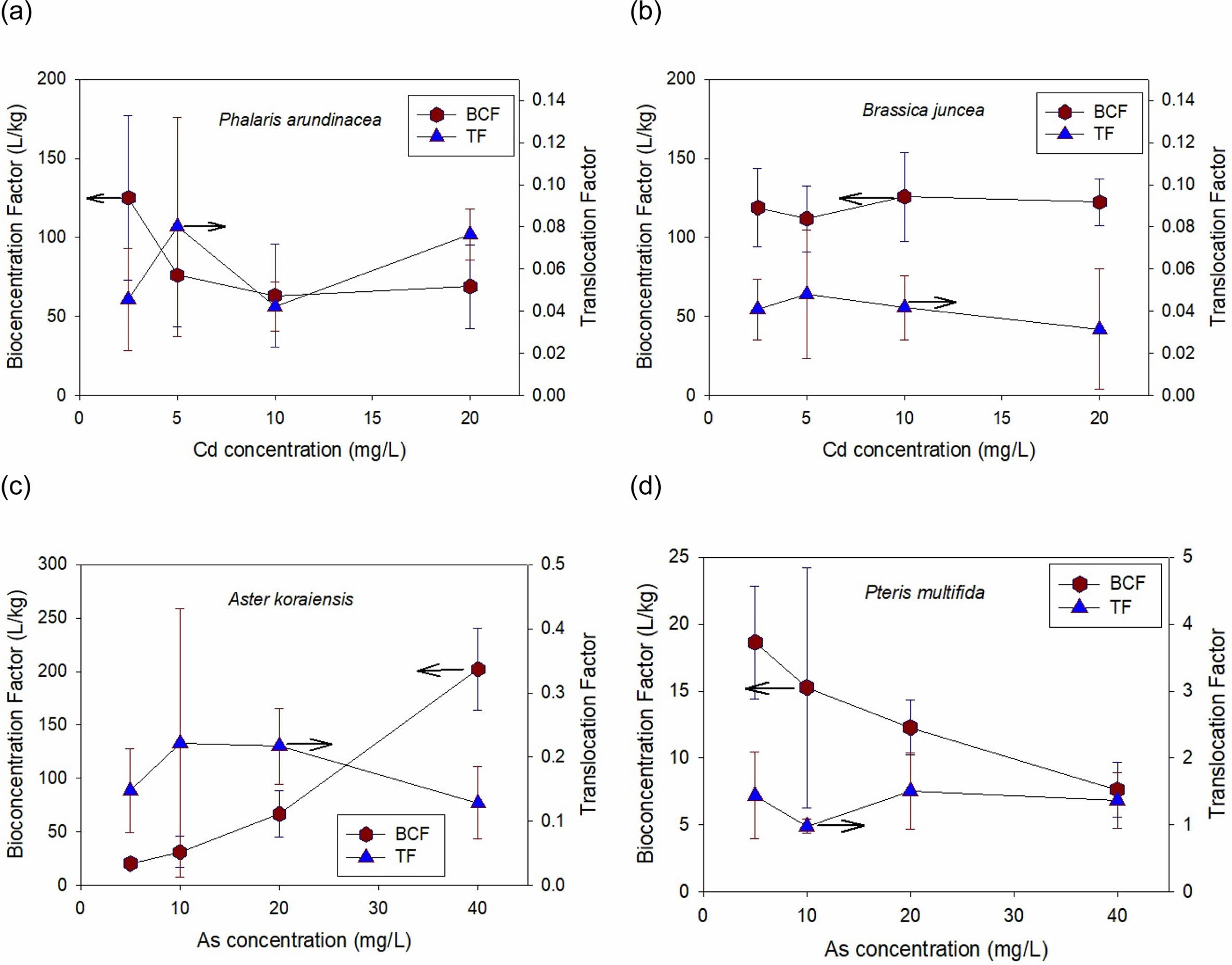
벌개미취의 BCFAs는 2.5 mg-As/L에서는 20.3 L/kg이었으나 농도에 거의 선형적으로 비례 증가하여, 40 mg-As/L에서는 202.3 L/kg에 달하였다. 그러나 TFAs는 0.13~0.22로 높지 않았다. 식물체 뿌리 As농도가 1000 mg/kg-D.W.을 넘고, 지상부에도 155 mg/kg-D.W.으로 상대적으로 높은 값의 As를 축적하지만, 벌개미취는 상기한 바와 같이 As의 독성에 대한 내성이 없어 정화공법에 사용하기에는 부적절한 것을 판단된다.
봉의꼬리의 BCFAs는 농도 증가에 반비례하여 감소하는 경향을 보였다. As 농도 5 mg/L에서는 BCFAs는 18.6 L/kg이고, 40 mg/L에서는 7.6 L/kg으로 59% 감소하였다. 그러나 TFAs 값이 1.32(±0.24)로 높아 식물상 추출법에 적합한 식물임이 재확인되었다. Pteris 속의 P. vittata, P. cretica, P. longifolia 및 P. umbrosa 등의 고사리종은 비소의 과축적종으로 널리 알려져 있다(Zhao et al., 2002). 봉의꼬리를 사용한 연구결과에 의하면 수경재배와 현장실험에서 산정한 BCFAs값의 범위는 각각 0.6~7.43 L/kg 및 6~24 L/kg로 현장실험의 BCF값이 더 높은 경향이 있으며, 이는 봉의꼬리의 As 흡수능 변화보다 현장실험의 오염도가 낮은 것이 더 큰 원인이다(Danh et al., 2014). 따라서 본 연구에서 용액농도 증가에 따라 BCFAs값이 감소하는 것도 동일한 원인이라 사료된다.
그러나 본 연구의 갈풀 및 봉의꼬리에서와 같이, BCF는 오염농도가 높으면 작아지는 경향이 있으므로 절대적인 기준은 될 수 없으며(Ali et al., 2013), 식물상 안정화에 적합한 식물선정에 참고값 만으로의가치가 있다. 반면 TF는 정화공법을 적용하고 지상부를 수확하여 제거하는 식물상 추출공법에 적합한 식물종 선별에 매우 유용하며, TF > 1.0인 식물을 적합종으로 판단한다(Yoon et al., 2006). 따라서 식물상 추출공법에 적합한 식물은 봉의꼬리에 국한되며, 벌개미취의 지하부 As 농도가 1000 mg/kg-D.W.를 상회하지만 TF가 낮아 As 정화에는 적합하지 않은 식물로 분류된다. 식물 생장도 매우 중요한 선정요인중의 하나이다. 봉의꼬리는 온난대 지역에서 서식하는 식물로 강수량에는 큰 영향을 받지 않으나, 생장에 필요한 생물기후지수의 최저온도(Bio6)는 -5oC 미만이며(Xu et al., 2022), 우리나라에서는 해안가 및 제주도 지역만이 Bio6에 해당한다(Lim and Kim, 2020). 그러므로 봉의꼬리를 정화식물로 사용할 수 있는 현장은 매우 제한적일 것이다.

|
Fig. 1 Images depicting hydroponic reactors within a growth chamber with a controlled environment. |
|
Fig. 2 Dry weight of the root and the above-ground part of (a) Brassica juncea and (b) Phalaris arundinacea after 10 days of exposure to Cd in hydroponics. |
|
Fig. 3 Concentration of Cd in the aerial part and root of Brassica juncea and Phalaris arundinacea after 10 days of exposure to Cd in hydroponics. |
|
Fig. 4 Dry weight of the root and the above-ground part of (a) Pteris multifida and (b) Aster koraiensis after 10 days of exposure to As in hydroponics. |
|
Fig. 5 Concentration of As in the root and above-ground parts of Aster koraiensis and Pteris multifida after 10 days of exposure to As in hydroponics. |
|
Fig. 6 Calculated values of bioconcentration factor (BCF) and translocation factor (TA) based on As or Cd concentrations in hydroponic solutions. |
|
Table 1 Fresh and dry weight of plants before and after 10 days of exposure to Cd in hydroponic culture. (±standard deviation) |
|
Table 2 Fresh and dry weight of plants before and after 10 days of exposure to As in hydroponic culture. (±standard deviation) |
|
Table 3 Concentration of Cd in aerial parts and roots of plants and calculated values of the respective BCF and TF values after exposure to cadmium in a hydroponic system. (±standard deviation) |
|
Table 4 Concentration of As in aerial parts and roots of plants and calculated values of the respective BCF and TF values after exposure to arsenic in a hydroponic system. (±standard deviation) |
중금속 As 혹은 Cd로 오염된 토양에 식물상 정화공법을 적용할 때 사용할 적합 식물종 선별을 위해 As(0~ 40 mg/L) 처리구에는 벌개미취와 봉의꼬리를, Cd 처리구(0~20 mg/L)에는 갓과 갈풀을 각각 식재하고 10일간 재배하여 식물생장 및 중금속 흡수를 관측하였다.
그 결과, 벌개미취는 뿌리 As 농도가 1,306 mg/kg-D.W.까지 관측되고, 이 때의 BCFAs가 202.2 L/kg이었으나, As 독성에 의해 잎의 황백화와 생채량 감소의 악영향이 관측되어 적절하지 않은 식물종으로 판별하였다. 봉의꼬리에서는 As 독성영향이 관측되지 않았고, BCF는 18.6~ 7.6 L/kg으로 As 농도에 반비례하는 경향을 보였으나, TF가 1.0 이상이었고 지상부 As 최고농도가 345.1 mg/kg-D.W.로 식물상 추출에 적합한 종이라 판단된다.
수변식물인 갈풀은 Cd 오염배지에서 생체량이 증가하였다. 갈풀 뿌리 및 지상부 Cd 최고농도는 각각 1,926.7 및 147.7 mg/kg-D.W.이고, BCFCd는 125~68.9 L/kg으로 Cd 농도에 반비례하였다. 그러나 TF값이 0.1이하로, 식물상 추출보다는 식물상 안정화에 적합한 종으로 판단된다. 갓의 경우에는 Cd 노출에 의해 떡잎 및 1차 잎(primary leaf)이 황백화로 시들었다. 갓의 뿌리 및 지상부 Cd 최고농도는 각각 11,305.5 및 321.6 mg/kg-D.W.로 매우 높았고, BCFCd는 농도에 무관하게 약 120 L/kg이 관측되었다. 그러나 TF가 0.05 이하로 매우 낮아 식물상 안정화에 적합한 식물로 판단된다.
이상과 같이 4종의 식물에서의 중금속 이동을 관측한 결과, 갓과 갈풀은 고농도 Cd을 뿌리에 축적하였으나 지상부로 이송할 수 없기에 첨가제를 사용한 TF 증가공법에 대한 연구가 필요할 것이다. 갈풀은 수변식물로 밭이나 산토양보다는 논토양에 적합하며, 생체량이 크기에 TF만 증가시킬 수 있다면 정화시간도 단축할 수 있는 장점이 있다. 봉의꼬리는 지상부에 고농도 As를 축적하였으나 온난대에서 생장하는 식물로 현장적용에 의한 월동 가능성에 대한 확인이 필요할 것이다.
본 연구는 한국환경공단의 연구비 지원으로 수행되었습니다.
- 1. Adriano, D.C., 1986, Trace Elements in Terrestrial Environments, Second edition, Springer-Verlag, New York, USA.
- 2. Ali, H., Khan, E., and Sajad, M.A., 2013, Phytoremediation of heavy metals-Concepts and applications, Chemosphere, 91(7), 869-881.
-

- 3. ATSDR (Agency for Toxic Substances & Disease Registry), 2013, ATSDR Substance Priority List. http://www.atsdr.cdc.gov/SPL/index.html. Accessed 23.12.15.
-

- 4. Bello, A.O., Tawabini, B.S., Khalil, A.B., Boland, C.R., and Saleh, T.A., 2018, Phytoremediation of cadmium-, lead- and nickel-contaminated water by Phragmites australis in hydroponic systems, Ecol. Eng., 120, 126-133.
-

- 5. Benzarti S., Mohri S., and Ono Y., 2008, Plant response to heavy metal toxicity: comparative study between the hyperaccumulator Thlaspi caerulescens (ecotype Ganges) and nonaccumulator plants: lettuce, radish, and alfalfa, Environ. Toxicol., 23(5), 607-616.
-

- 6. Cajuste, L.J. and Laird, R.J., The relationship between the phytoavailability and extractability of heavy metals in contaminated soils. In, Iskandar, I.K. (Ed.) Environmental Restoration of Metals-Contaminated Soils, Lewis-Publishers, Washington D.C., USA, 189-198.
-

- 7. Danh, L.T., Truong, P., Mammucari, R., and Foster, N., 2014, A critical review of the arsenic uptake mechanisms and phytoremediation potential of Pteris vittata, Int. J. Phytorem., 16(5), 429-453.
-

- 8. Epstein, E., 1972, Mineral Nutrition of Plants: Principles and Perspectives, J. Wiley and Sons, Inc., New York, 68-82.
-

- 9. Finnegan, P.M. and Chen, W., 2012, Arsenic toxicity: The effects on plant metabolism, Front. Physiol., 3, 182.
- 10. Kim, E.J., Yoo, J.C., Park, S.M., Park, E.R., and Baek, K., 2016, Distribution of arsenic and heavy metals in soil particle sizes in the areas affected by the former smelter, J. of Kor. Soc. Env. Anal., 19, 54-62. (in Korean)
- 11. Kirkham, M.B., 2006, Cadmium in plants on polluted soils: Effects of soil factors, hyperaccumulation, and amendments, Geoderma, 137(1-2), 19-32.
-

- 12. Lebow S., Brook, K., and Simonsen, J., 2002, Environmental impact of treated wood in service, Proceedings of Enhancing the Durability of Lumber and Engineered Wood Products, Forest Products Soc., Orlando, FL., USA, 205-215.
- 13. Lim, C.-H. and Kim, H.-J., 2020, Machine learning application for identifying habitat suitability changes of indicator tree species against recent climate change, J. Climate Change Res., 11, 793-805. (in Korean)
-

- 14. Nriagu J.O., 1994, Arsenic in the Environment: Part 1 Cycling and Characterization, John Wiley & Sons, New York, USA, 119-132.
- 15. Moon, S.Y., Oh, M., Jung, J., Choi, S.I., and Lee, J.Y., 2011, Assessment of soil washing efficiency for arsenic contaminated site adjacent to Jang Hang refinery, J. Soil Groundw. Environ., 16, 71-81.
-

- 16. Marques, A.P., Rangel, A.O., and Castro, P.M., 2009. Remediation of heavy metal contaminated soils: phytoremediation as a potentially promising clean-up technology, Crit. Rev. Env. Sci. Technol., 39, 622-654.
-

- 17. Nouairi, I., Ammar, W.B., Youssef, N.B., Daoud, D.B.M., Ghorbal, M.H., and Zarrouk, M., 2006, Comparative study of cadmium effects on membrane lipid composition of Brassica juncea and Brassica napus leaves, Plant Sci., 170, 511-519.
-

- 18. Nouri, J., Lorestani, B., Yousefi, N., Khorasani, N., Hasani, A.H., Seif, F., and Cheraghi, M., 2011, Phytoremediation potential of native plants grown in the vicinity of Ahangaran lead-zinc mine (Hamedan, Iran), Environ. Earth Sci., 62, 639-644.
-

- 19. Mondal, P., Majumder, C.B., and Mohanty, B., 2006. Laboratory based approaches for arsenic remediation from contaminated water: Recent developments, J. Haz. Mater., 137(1), 464-479.
-

- 20. Poynton, C.Y., Huang, J.W., Blaylock, M.J., Kochian, L.V., and Elless, M.P., 2004, Mechanisms of arsenic hyperaccumulation in Pteris species: Root As influx and translocation, Planta, 219, 1080-1088.
-

- 21. Poisa, L., Adamovics, A., and Platace, R., 2010, Content of heavy metals in the Reed Canarygrass (Phalaris Arundinacea L.) in the first year of harvest, Scientific Journal of Riga Technical University, 5, 86-90.
-

- 22. Reeves, R.D. and Brooks, R.R., 1983, Hyperaccumulation of lead and zinc by two metallophytes from a mining area in central Europe, Environ. Pollut., 31(4), 277-287.
-

- 23. Sakakibara, M., Ohmori, Y., Ha, N.T.H., Sano, S., and Sera, K., 2011, Phytoremediation of heavy metal contaminated water and sediment by Eleocharis acicularis, Clean: Soil, Air, Water, 39(8), 735-741.
-

- 24. Salt, D.E., Prince, R.C., Pickering, I.J., and Raskin, I., 1995, Mechanisms of cadmium mobility and accumulation in indian mustard, Plant Physiol., 109(4), 1427-1433.
-

- 25. Senze, M., Kowalska-Goralska, M., Czyż, K., and Wondo©©owska-Grabowska, A., 2022, Possibility of metal accumulation in reed canary grass (Phalaris arundinacea L.) in the aquatic environment of south-western polish rivers, Int. J. Environ. Res. Public Health, 19(13), 7779.
-

- 26. Stafilov, T., Šajn, R., Pančevski, Z., Boev, B., Frontasyeva, M.V., and Strelkova, L.P., 2010. Heavy metal contamination of surface soils around a lead and zinc smelter in the Republic of Macedonia, J. Haz. Mater., 175(1-3), 896-914.
-

- 27. Syu, C.H., Jiang, P.Y., Huang, H.H., Chen, W.T., Lin, T.H., and Lee, D.Y., 2013, Arsenic sequestration in iron plaque and its effect on As uptake by rice plants grown in paddy soils with high contents of As, iron oxides, and organic matter, Soil Sci. Plant Nutr., 59(3), 463-471.
-

- 28. Tu, S. and Ma, L.Q., 2003, Interactive effects of pH, arsenic and phosphorus on uptake of As and P and growth of the arsenic hyperaccumulator Pteris vittata L., under hydroponic conditions, Environ. Exp. Bot., 50(3), 243-251.
-

- 29. Tu, S., Ma, L.Q., Fayiga, A.O., and Zillioux, E.J., 2004, Phytoremediation of arsenic-contaminated groundwater by the arsenic hyperaccumulating fern Pteris vittata L., Int. J. Phytorem., 6(1), 35-47.
-

- 30. Uddin M.M., Chen Z., and Huang, L., 2020, Cadmium accumulation, subcellular distribution and chemical fractionation in hydroponically grown Sesuvium portulacastrum [Aizoaceae], PLoS ONE, 15, e0244085.
-

- 31. USEPA, 1996, Hazardous Waste Test Methods/SW-846 Test Method 3052: Microwave Assisted Acid Digestion of Siliceous and Organically Based Matrices.
- 32. Usman, A.R.A., Lee, S.S., Awad, Y.M., Lim, K.J., Yang, J.E., and Ok, Y.S., 2012, Soil pollution assessment and identification of hyperaccumulating plants in chromated copper arsenate (CCA) contaminated sites, Korea, Chemosphere, 87(8), 872-878.
-

- 33. Xu, W., Du, Q., Yan, S., Cao, Y., Liu, X., Guan, D.-X., and Ma, L.Q., 2022, Geological distribution of As-hyperaccumulator Pteris vittata in china: Environmental factors and climate changes, 2022, Sci. Total Environ., 803, 149864.
-

- 34. Yan, A., Wang, Y., Tan, S.N., Yusof, M.L.M., Ghosh, S., and Chen, Z., 2020, Phytoremediation: A promising approach for revegetation of heavy metal-polluted land, Front. Plant Sci., 11, 359.
-

- 35. Yoon, J., Cao, X., Zhou, Q., and Ma, L.Q., 2006, Accumulation of Pb, Cu, and Zn in native plants growing on a contaminated Florida site, Sci. Total Environ., 368(2-3), 456-464.
-

- 36. Zhao, F.J., Dunham, S.J., and McGrath, S.P., 2002, Arsenic hyperaccumulation by different fern species, New Phytol., 156 (1), 27-31.
-

 This Article
This Article
-
2024; 29(1): 28-38
Published on Feb 29, 2024
- 10.7857/JSGE.2024.29.1.028
- Received on Jan 12, 2024
- Revised on Jan 15, 2024
- Accepted on Jan 24, 2024
 Services
Services
Shared
 Correspondence to
Correspondence to
- Bumhan Bae
-
Department of Civil & Environmental Engineering, Gachon University, Seongnam 13120, Korea
- E-mail: bhbae@gachon.ac.kr





