- Improvement of Cadmium Toxicity Assessment in Sediments under Oxidizing Condition: Incorporating Bioavailability Changes Associated with Iron Oxide Formation
Buyun Jeong1, Jinsung An2, and Kyoungphile Nam3*
1Institue for Environment and Energy, Pusan National University
2Department of Civil & Environmental Engineering, Hanyang University ERICA
3Department of Civil & Environmental Engineering, Seoul National University- 산화 퇴적토 내 카드뮴의 독성 평가 기법 개선: 철 산화물 형성에 따른 생물학적 이용성 변화 반영
정부윤1ㆍ안진성2ㆍ남경필3*
1부산대학교 환경·에너지연구소, 2한양대학교 ERICA 건설환경공학과, 3서울대학교 건설환경공학부
This article is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Accurate evaluation of sediment toxicity remains challenging due to complex interactions among sediment geochemistry, contaminant partitioning, and bioavailability. Conventional sediment quality guidelines classify sediments based on bulk contaminant concentrations, often overlooking bioavailability and yielding low predictive accuracy near threshold levels. Likewise, equilibrium partitioning models mainly consider organic carbon and acid volatile sulfides, limiting their applicability under oxidizing conditions where iron oxides dominate metal binding. This study developed a predictive framework for cadmium (Cd) toxicity assessment in freshwater sediments by incorporating multiple sorption phases and bioavailability metrics. A mechanistic model for the sediment–water distribution coefficient (Kd) of Cd was established using pH, total organic carbon (TOC), and amorphous/crystalline iron oxides. Windermere Humic Aqueous Model 7 simulations and adsorption experiments showed that Kd varied over three orders of magnitude across pH ranges, with amorphous iron oxides exhibiting the strongest affinity at alkaline pH (>7.5). Application to 21 field sediments yielded predictions within one order of magnitude of measured Kd values. Predicted Kd values were further used to estimate porewater Cd concentrations and derive Interstitial Water Toxic Units. Comparison with Hyalella azteca bioassays increased classification accuracy from 43 to 76%. This bioavailability-based framework improves sediment toxicity prediction under oxidizing conditions where previous models are inadequate.
Keywords: Sediment toxicity, Sediment effect concentration, Oxidized sediment, Sediment geochemistry, Hyalella azteca bioassay
퇴적토는 수중의 오염물질이 침강하여 축적되는 저장소이자, 환경 조건 변화에 따라 다시 수중으로 방출될 수 있는 잠재적 2차 오염원으로 작용한다. 이러한 과정에서 중금속은 유기물, 황화물, 철·망간 산화물 등 다양한 성분과 결합하여 존재할 수 있으며, 이들의 분포 특성은 생물학적 이용성(bioavailability)과 저서생물에 대한 생태독성에 직접적인 영향을 미친다(Burton, 2002; Feyte et al., 2010; Yin et al., 2011; Kwok et al., 2014). 나아가 pH, 산화환원 전위(Eh), 유기물 조성 등 환경 조건의 변화로 인해 퇴적토에 고정되어 있던 중금속이 공극수로 재용출되면서 독성 위험이 증폭될 수 있다(USEPA, 1999; USEPA, 2007).
퇴적토 내 중금속의 생물학적 이용성은 전통적으로 평형분배이론(Equilibrium Partitioning, EqP)에 기초해 설명되어 왔다. 특히 산휘발성 황(acid volatile sulfide; AVS)은 무산소 조건에서 중금속과 1:1 몰비로 반응하여 불용성 황화합물(MeS)을 형성함으로써 중금속의 생물학적 이용성을 현저히 감소시키는 주요 상(phase)으로 알려져 있다(Di Toro et al., 1990; Ankley et al., 1996). 이에 따라 아래 식과 같이 AVS 및 총 유기탄소(total organic carbon; TOC)를 기반으로 한 독성 예측 모델인 sediment biotic ligand model(s-BLM)과 이를 활용한 평형분배기반 퇴적기준(Equilibrium Partitioning Sediment Benchmarks; ESB)이 제안되었으며(USEPA, 2005; Di Toro et al., 2005), 현재까지도 중금속 독성 예측에 널리 활용되고 있다.
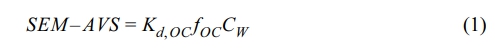
여기서 SEM(simultaneously extracted metal)은 AVS 분석 과정에서 6 M HCl 처리 시 동시에 용출되는 중금속 농도를 의미한다. Kd,OC(L/kg OC)는 유기탄소에 대한 분배계수이며, fOC(kg OC/kg dry wt)는 퇴적토 내 유기탄소 함량을 나타낸다. CW는 수중에서 생물에게 50% 치사율을 유발하는 금속 농도를 의미하나, s-BLM에서는 이를 USEPA가 제시한 만성 독성 기준치(final chronic value; FCV)로 대체하여 적용한다.
그러나 AVS는 산화 과정에서 황산염으로 빠르게 전환되어 소멸하고, 이 과정에서 CdS와 같은 화합물이 분해되며 중금속이 다시 공극수로 방출된다(Gambrell et al., 1977; USEPA, 1999; Dang et al., 2020). 이 때 철 산화물이 중금속 흡착의 주요 상으로 작용하게 되는데, 이는 기존 AVS와 TOC 기반 모델이 산화 조건의 퇴적토에서는 정확한 예측력을 확보하기 어려운 이유가 된다(Costello et al., 2011; Turner et al., 2008).
철 산화물의 역할을 정량적으로 규명한 여러 연구들은 Cd를 비롯한 중금속이 유기물보다 철 산화물에 더 강하게 결합한다는 사실을 보여주었다(Davies-Colley et al., 1984; Jain et al., 2007; Yin et al., 2011). 예를 들어 Davies-Colley et al.(1984)는 하구 퇴적토에서 Cd의 최대 80%가 철 산화물에 결합되어 있음을 보고하였으며, Oakley et al.(1981)은 Fe(OH)3, MnO2, 점토광물이 humic 물질보다 높은 금속 친화성을 가진다고 제시하였다. 이러한 결과는 TOC만을 흡착 상으로 고려하는 기존의 방식이 철 산화물이 풍부한 산화 조건의 퇴적토에서는 Cd의 독성을 과대평가할 가능성이 있음을 시사한다. 실제로 Costello et al.(2015)은 산화된 퇴적토에서 s-BLM 기반 예측과 관찰된 독성 간 불일치를 보고하며, 이를 철 산화물의 기여를 반영하지 않은 모델의 한계로 설명하였다.
한편, 퇴적토 독성 기준으로서 유럽연합 등에서 적용하고 있는 Sediment Effect Concentrations(SECs)는 현장 생태 자료와 생물검정 결과를 토대로 산출된 임계값으로, Lowest effect levels(LEL), Threshold Effect levels(TEL), Severe effect levels(SEL), Probable effect levels(PEL) 등의 기준치를 통해 오염 수준과 생태 위해 가능성을 구분하는 데 활용된다(Persaud et al., 1993; De Deckere et al., 2011). SEC는 현장 생물군집에 대한 영향과 생태독성학적인 관점에서 퇴적토의 위해 기준을 제시한다는 측면에서 기존의 EqP 이론보다 현장 특이적이라는 장점이 있으나, USEPA의 ESB와 마찬가지로 기준 값들 사이에 불확실한 영역이 존재한다는 한계가 있다. 특히 Cd과 같이 환경 조건 변화에 따라 퇴적토 내 분배 상태가 영향을 받는 중금속의 경우, SEC 단독으로는 경계값 부근의 시료를 정확히 분류하기 어렵다(Shine et al., 2003; Hübner et al., 2009).
이러한 한계를 개선하기 위해 생물학적 이용성을 지표로 오염도를 평가하는 것이 필요하며, 이를 위해 본 연구에서는 퇴적토의 주요 결합 상(TOC, Fe(OH)3, ferrihydrite)에 대한 분배계수(Kd)를 Windermere Humic Aqueous Model version 7(WHAM 7) 모델링과 흡착 실험을 통해 산정하고, 이를 바탕으로 총 분배계수(total Kd)를 예측하였다. 나아가 total Kd로부터 산출된 공극수 농도(CW)를 FCV로 정규화하여 Interstitial Water Toxic Units(IWTU)에 근거하여 평가 하였다. 본 연구의 접근은 SEC 기반 분류의 생태학적 다양성 반영과 IWTU의 정량적 정밀성을 통합하여, 단일 지표 접근의 한계를 보완하고 불확실성을 줄이는 계층적(tiered) 평가 틀을 적용한 것이다. 이는 Ankley et al.(1996)과 Berry et al. (1996)이 제안한 바와 같이, 단일 기준값에 의존하기보다 여러 지표를 교차 검증함으로써 예측력을 높이는 다단계 평가 개념과 일맥상통한다.
Cd는 대표적인 중금속으로서 퇴적토 내 거동이 주변 환경 조건에 크게 의존하고, 생태 위해성 측면에서도 중요성이 크기 때문에 본 연구의 모델 금속으로 선정되었다. 본 연구는 산화 조건에서 Cd의 분배 및 독성 예측력을 개선하고, SEC와 IWTU를 통합한 계층적 평가 체계를 구축하여 퇴적토 독성 평가의 신뢰성과 적용성을 향상시키는 것을 목표로 한다.
2.1. WHAM 7에서 분배계수(Kd) 산정 원리
Cd의 퇴적토 내 분배 특성을 모사하기 위하여, 본 연구에서는 금속-유기물 및 금속-철 산화물 간의 평형반응을 정량적으로 해석할 수 있는 지화학 평형모델인 WHAM 7을 활용하였다(Tipping et al., 2011). WHAM 7은 Humic Ion-Binding Model V를 기반으로, 무기종 분포, 양이온 교환, Al·Fe 수산화물 반응, fulvic acid-금속 상호작용 등을 포함하는 다수의 부속 모델을 통합하여 토양 및 수환경에서의 금속 거동을 모사할 수 있도록 개발되었다(Tipping, 1993; Tipping, 1994; Tipping and Hurley, 1992).
WHAM 7에서 유기탄소 상(phase)의 대표물질로는 humic acid가 사용되는데 이는 Cd²⁺와 같은 금속 양이온이 결합할 수 있는 카르복실기와 페놀기 등의 작용기가 풍부하기 때문이다. Humic acid에 대한 금속 결합은 pH 의존성이 크며, pH가 증가함에 따라 작용기가 탈양성자화(deprotonation)되어 음전하를 띠게 되고, 이로 인해 금속 결합능이 강화된다. WHAM은 이러한 다자리 결합(multidentate binding), 양이온 경쟁, pH에 따른 종 분포 변화를 고려하여 다양한 환경 조건에서의 금속–유기물 흡착을 정밀하게 예측한다.
또한 본 모델에서 Cd의 Fe(OH)3 표면 흡착은 surface complexation 모형을 통해 모사하였다. WHAM 7은 Fe(OH)3 표면의 수산기(≡FeOH)의 양성자화 및 탈양성자화 반응을 고려하며, 이에 따라 표면 전하와 금속 결합 친화도가 변화한다. 낮은 pH에서는 표면기가 양성자화(≡FeOH + H⁺ → ≡FeOH2⁺)되어 양전하를 띠게 되므로 Cd²⁺와 같은 금속 양이온을 반발하지만, 높은 pH에서는 탈양성자화(≡FeOH → ≡FeO⁻ + H⁺)가 일어나 음전하를 띠게 되어 Cd²⁺의 흡착이 강화된다. 또한 WHAM 7은 다자리 결합, 금속 종 분포, 이온강도 등의 요인을 함께 고려하여 Fe(OH)3 표면에서의 금속 흡착 안정성을 모사한다. 이 과정에서 surface site density와 binding constant와 같은 매개변수는 다양한 실험 연구에서 보고된 자료를 기반으로 설정된다.
이와 같이 WHAM 7은 금속–유기물 및 금속–산화철 상호작용을 통합적으로 고려하여, 다양한 pH 조건에서 금속의 평형 분포를 계산하고 최종적으로 Kd를 예측한다.
2.2. SEC의 산정
본 연구에서 적용한 SECs는 De Deckere et al.(2011)이 제시한 방법론을 따랐다. SEC는 네 가지 기준값인 LEL, SEL, TEL, PEL을 바탕으로 산정하는데, 이러한 임계값들은 퇴적토 내 오염물질 농도를 생태학적, 생태독학적 위해 수준에 따라 구분하는 지표로 기능한다. 이 중 LEL은 저서생물에 유해한 영향이 나타나지 않는 농도를 의미하며, SEL은 반대로 유해 영향이 높은 확률로 발생하는 농도를 나타낸다. TEL은 독성 반응이 나타나지 않을 것으로 예상되는 농도를 의미하며, PEL은 독성이 발생할 가능성이 높은 농도를 나타낸다.
LEL과 SEL은 현장 생태학 자료를 기반으로 도출한다. 즉, 특정 저서 분류군이 서식하는 지점에서 관찰된 중금속 농도 분포를 활용하며, 산출의 신뢰성을 높이기 위해 최소 5개 이상의 지점에서 출현한 분류군만을 분석에 포함한다. 또한, 민감성과 내성을 고르게 반영하기 위해 최소 20개 이상의 분류군을 대상으로 한다. LEL은 해당 분류군이 출현한 모든 지점에서 중금속 농도의 5백분위수(5th percentile)로 정의하며, SEL은 95백분위수(95th percentile)로 정의한다. 이러한 백분위수 기반 접근은 민감한 종과 내성이 강한 종을 모두 고려할 수 있는 장점이 있다.
반면, TEL과 PEL은 생물검정시험 결과를 기반으로 산정한다. Hyalella azteca를 이용한 독성실험에서 사망률을 기준으로 유·무해(effect/no effect)로 구분하며, 각 범주에 해당하는 중금속 농도의 분포를 이용해 기하평균을 계산한다. 이 과정에서 TEL은 “무해” 범주와 “유해” 범주 경계의 하위 백분위수(예: 15th percentile)와 중앙값을 반영하여 산출되며, PEL은 “유해” 범주의 상위 백분위수(예: 85th percentile)를 포함하여 계산한다.
또한, 이렇게 도출 한 임계값들을 바탕으로 도출한 두 가지 합의값(consensus thresholds)을 퇴적토 독성의 평가 기준으로 제안한다. 이 때, Consensus 1은 LEL과 TEL의 평균값으로 정의되며, 퇴적토의 안전성을 판단하기 위한 보수적 기준으로 사용된다. Consensus 2는 SEL과 PEL의 평균값으로 산출되며, 퇴적토의 독성이 높을 가능성이 큰 상위 기준으로 기능한다.
2.3. IWTU를 이용한 독성 평가
퇴적토 내 중금속의 독성을 평가하는 기준 중 하나인 IWTU는 공극수 내 중금속의 농도를 FCV로 정규화한다. 이 때 FCV는 수생 생물에 만성적인 유해 영향이 나타나지 않을 것으로 예상되는 농도로, 퇴적토 위해성 평가에서 USEPA가 권고하는 기준이다(Ankley et al., 1996; USEPA, 2005). IWTU는 다음 식으로 도출한다.

여기서 [M]은 중금속의 용존 농도를 의미하며, 산출된 IWTU 값의 해석은 다음과 같다. IWTU가 0.5 이하인 경우 만성 독성이 발생할 가능성이 낮은 것으로 판단되며, 0.5를 초과하는 경우 독성 발생 가능성이 높아지고, 값이 증가할수록 그 심각성이 강화되는 것으로 해석된다. 이러한 기준은 USEPA(2005)에서 제시한 지침과 부합하며, 퇴적토 평가에 생물학적 이용성을 반영할 수 있도록 한다.
3.1. 퇴적토 시료의 채취 및 분석
본 연구에 사용된 퇴적토는 국내 주요 하천 유역에 인접한 21개 담수호에서 표층(0–15 cm)을 대상으로 트렌치 삽을 이용하여 채취하였다. 산화에 의한 변화를 최소화하기 위하여, 채취 직후 시료는 밀봉하여 아이스팩과 함께 운반하였으며, 분석 전까지 냉동 보관하였다가 사용하였다.
분석 전 모든 기구와 유리기구는 질산(HNO3)으로 산처리 후 증류수로 세척하여 잠재적 오염원을 제거하였다. 퇴적토 내 Cd의 총 농도는 USEPA Method 3052를 준수하여 시료를 불산(HF) 등 강산으로 완전 용해하여 ICP-OES(iCAP 7400, Thermo Fisher Scientific, USA)를 이용하여 측정하였다.
퇴적토 슬러리의 pH는 pH 전극(Orion 8157BNUMD, Thermo Fisher Scientific, USA)으로 측정하였고, Eh는 Eh 전극(Orion 9678BNWP)과 복합 pH/Eh 측정기(Orion STAR A329, Thermo Fisher Scientific, USA)를 이용하여 측정하였다.
TOC 함량은 TOC 분석기(Sievers 5310 C, GE, USA)를 이용하여 USEPA Method 415.3(Potter and Wimsatt, 2005)에 따라 전탄소(TC)에서 무기탄소(IC)를 차감하는 방식으로 산출하였다.
철 산화물 함량은 Kostka와 Luther(1994)의 연속 추출법에 따라 총 산화 철 함량(비정질 및 결정질 포함)은 sodium hydrosulfite 완충용액(pH 5)을 사용하여 60°C에서 4시간 추출하였다. 비정질 철 산화물은 ascorbate 용액(pH 8)으로 25°C에서 24시간 진탕하여 분리하였으며, 결정질 철 산화물 함량은 총 산화 철 함량에서 비정질 철 산화물 함량을 차감하여 산출하였다. 모든 용액은 추출 후 0.45 μm 필터로 여과하여 분석하였다.
퇴적토 입도는 pipette method(Gee and Bauder, 1986)를 이용하여 평가하였으며, 모래·실트·점토 함량을 정량하여 퇴적토의 입도 특성을 파악하였다.
3.2. Kd 산정
3.2.1. Humic acid와 Fe(OH)3의 Kd
본 연구에서는 WHAM 7을 활용하여 Cd의 humic acid 및 Fe(OH)3에 대한 Kd를 시뮬레이션하였다. 세 가지 시나리오를 설정하였으며, (i) humic acid와 Fe(OH)3가 각각 5 g/L 농도로 함께 존재하는 경우, (ii) Fe(OH)3만 존재하는 경우, (iii) humic acid만 존재하는 경우로 구분하였다. 모든 경우에서 용액 내 총 Cd 농도는 0.16 mM으로 고정하였으며, 이는 기존 연구에서 보고된 흡착 실험 조건을 반영한 것이다(Johnson, 1990; Bruemmer et al., 1998; Mustafa et al., 2004; Wang and Xing, 2002). 실제 자연계의 공극수 내 Cd 농도보다 높은 수준이지만, 정량 분석의 정확성을 확보하고 흡착 평형 거동을 명확히 관찰하기 위한 실험적 농도 설정이다. 또한 s-BLM에서의 접근과 동일하게, humic acid는 퇴적토 내 입자상 유기탄소(particulate organic carbon, POC)의 대리물질로, Fe(OH)3는 대표적인 Fe 산화물 상으로 설정하였다(Di Toro et al., 2005). 시뮬레이션은 pH 1–9 범위에서 수행하여, 환경적으로 관련 있는 조건에서 금속 흡착 거동의 변화를 포괄적으로 반영하였다.
3.2.2. Ferrihydrite의 Kd
Ferrihydrite는 WHAM 7 모델로 모사가 불가능하기 때문에, 본 연구에서는 합성 시료를 제작하여 Cd 흡착 실험을 통해 분배계수(Kd)를 산정하였다. 합성은 Schwertmann and Cornell(2000)의 방법을 일부 변형하여 수행하였다. 우선 1 M Fe(NO3)3 용액을 조제한 뒤, 500 mL 비커에 80 mL를 취하고 1 M NaOH 용액 약 220 mL를 서서히 첨가하면서 교반하여 pH 7.0–7.2 범위에 도달하도록 조정하였다. 혼합용액은 상온에서 마그네틱 바를 사용해 3시간 동안 교반한 후, 원심분리기(8,000 × g, 10분)를 이용해 침전물을 분리하였다. 회수된 침전물은 증류수로 4회 세척후 40°C 오븐에서 48시간 건조하였다. 이후 고형물을 곱게 분쇄하여 분말화하고 흡착 실험 전까지 -80°C에서 보관하였다. 이렇게 합성된 물질은 X-선 회절 분석을 통해 ferrihydrite임을 확인하였다.
흡착 실험은 Cd(NO3)2로 조제한 수용액을 이용하여 수행하였으며, 초기 Cd 농도는 WHAM 7에서와 동일하게 0.16 mM으로 설정하였다. 각 용액의 pH는 0.1 M NaOH와 0.1 M HNO3를 이용해 1–9 범위로 조정하였다. 이후 합성된 ferrihydrite를 5 g/L 농도로 첨가하여 Cd 흡착 실험을 상온에서 24시간 동안 진행하였다.
실험 종료 후, 초기 및 최종 Cd 농도는 ICP-OES (iCAP 7400, Thermo Fisher Scientific, USA, 검출한계 0.07 μg/L)를 이용해 분석하였다. 각 pH 조건에서의 Kd는 흡착된 Cd의 양을 평형 상태에서 용액에 잔류하는 농도로 나누어 산정하였다.
3.2.3. total Kd 산정
본 연구에서 total Kd는 Davies-Colley et al.(1984)에서 제안한 방법으로 산출 하였는데, 퇴적토 내 개별 흡착상의 기여도를 가중 평균하여 다음과 같이 계산한다.

여기서 Kd,n (L/g)은 n번째 흡착상의 분배계수를 의미하며, fn은 해당 상의 분율로, 퇴적토 건조 중량 대비 각 상의 질량 비율로 산정된다.
본 연구에서는 WHAM 7 시뮬레이션 결과와 흡착 실험을 통해 도출된 값을 바탕으로 humic acid, Fe(OH)3, ferrihydrite의 세 가지 주요 흡착상을 고려하여 Cd의 total Kd 값을 산출하였다.
3.3. 퇴적토 시료에서의 Cd 흡착 실험
예측된 total Kd 값과 비교하기 위하여, 21개 퇴적토 시료를 대상으로 Cd 흡착 실험을 수행하였다. 실험에는 Cd(NO3)2 용액을 사용하였으며, 농도는 3.2, 1.6, 0.8, 0.4, 0.2, 0.16 mM로 설정하였다. 배치 흡착 실험은 250 mL 플로렌스 플라스크에 시료를 담아 고무마개로 밀봉한 상태에서 수행되었으며, 전 과정에서 고액비(solid-to-liquid ratio)는 1:5 (w/v)로 유지하였다.
선행 연구와 예비 실험 결과(Mahony et al., 1996; Mustafa et al., 2004; Davies-Colley et al., 1984)에 따르면 흡착 평형은 1–2시간 이내에 도달하는 것으로 알려져 있으나, 본 연구에서는 보수적으로 20시간을 상한으로 설정하였다. 이에 따라 퇴적토 현탁액을 마그네틱 바를 사용하여 상온에서 24시간 동안 지속적으로 교반하였다. 이후 퇴적토에 흡착한 Cd의 양과 평형에 도달 후 수용액 상의 Cd 농도를 대상으로 Kd를 산정하였다.
3.4. SEC에 따른 퇴적토 시료 구분 기준
2.2절에서 제시한 방법으로 도출한 두 합의값을 토대로 본 연구에서는 퇴적토 시료를 세 가지 범주로 구분하였다. Cd 농도가 Consensus 1 미만인 경우는 비독성으로, Consensus 2를 초과한 경우는 독성으로 분류하였으며, 두 값 사이에 해당하는 경우는 불확실(uncertain) 범주로 분류하였다. 이러한 계층적 구분은 현장 생태학적 자료와 실험실 생태독학적 반응을 동시에 반영함으로써, 퇴적토의 위해성을 보다 체계적이고 정밀하게 평가할 수 있는 틀을 제공한다.
3.5. IWTU를 이용한 독성 평가
식 (2)에 따라, [M]은 total Kd와의 관계식을 통해 산출된 수중 Cd 농도(μg/L)를 사용하였으며, FCV는 Cd에 대한 만성 독성 기준(Chronic Criterion Continuous Concentration, CCC)인 0.72 μg/L를 적용하였다. 이는 경도 100 mg/L as CaCO3 조건에서 산출된 값으로, 실제 환경 조건을 반영하도록 조정된 것이다(USEPA, 2016).
본 연구에서 IWTU를 적용함으로써, total Kd를 이용해 예측된 Cd 농도를 독성 평가와 직접적으로 연관된 정량적 지표로 전환할 수 있었으며, 이를 통해 퇴적토의 지화학적 특성과 생물학적 반응 간의 연계성을 강화하였다.
3.6. Hyalella azteca를 이용한 독성 실험
퇴적토 독성 평가는 담수성 단각목 옆새우 Hyalella azteca를 대상으로 수행하였다. H. azteca는 퇴적토에 존재하는 오염물질에 민감하게 반응하며, 생태독성 평가에서 널리 활용되는 표준 지표종으로서 Cd과 같은 금속류의 생물학적 이용성과 독성 잠재력을 평가하는 데 적합하다. 또한, 이 종은 퇴적토 독성 기준(SEC) 산정에도 국제적으로 빈번히 적용되고 있다.
독성 시험은 USEPA(2000)에서 제시한 표준 지침에 따라 수행하였다. 실험에는 7–8일령의 어린 H. azteca를 사용하였으며, 각 개체는 10일간 퇴적토 시료에 노출되었다. 시험 용기는 300 mL 유리 비커를 사용하였으며, 각 비커에는 퇴적토 100 mL와 피복수 175 mL를 넣은 후 개체 10마리를 도입하였다. 모든 실험은 3반복으로 진행하였다. 피복수는 KCl, CaSO4·2H2O, MgSO4, NaHCO3 등 시약급 화합물을 이용하여 조제한 중경도 합성수로, USEPA 지침에 따라 조성하였다.
시험 기간 동안 수질은 경도 90–100 mg/L (as CaCO3), 알칼리도 50–70 mg/L (as CaCO3), 전기전도도 330–360 μS/cm, pH 7.8 ± 0.2의 범위에서 유지하였다. 안정적인 조건 유지를 위해 피복수는 매일 교환하였으며, 사료는 Tetramin®을 챔버당 0.5 mL씩 매일 급여하였다.
본 연구는 자연 퇴적토를 대상으로 하였기 때문에 별도의 무처리 대조군 퇴적토는 두지 않았다. 다만 Cd가 첨가되지 않은 피복수를 이용한 보조 대조 실험에서는 10일간 H. azteca의 생존율이 100%로 확인되어, 시험 조건이 적절하고 비독성임이 검증되었다.
평가 지표는 생존율로 설정하였으며, 기존 연구에서 제시된 독성 기준에 따라 생존율이 76% 미만일 경우 해당 퇴적토를 독성이 있는 것으로 판정하였다. 시험 기간 동안 pH, 용존산소, 수온 등 수질 인자는 지속적으로 모니터링하여 USEPA 퇴적토 독성 지침을 준수하였다.
4.1. total Kd 예측 결과
4.1.1. WHAM 7을 통한 humic acid와 Fe(OH)3의 Kd 산정
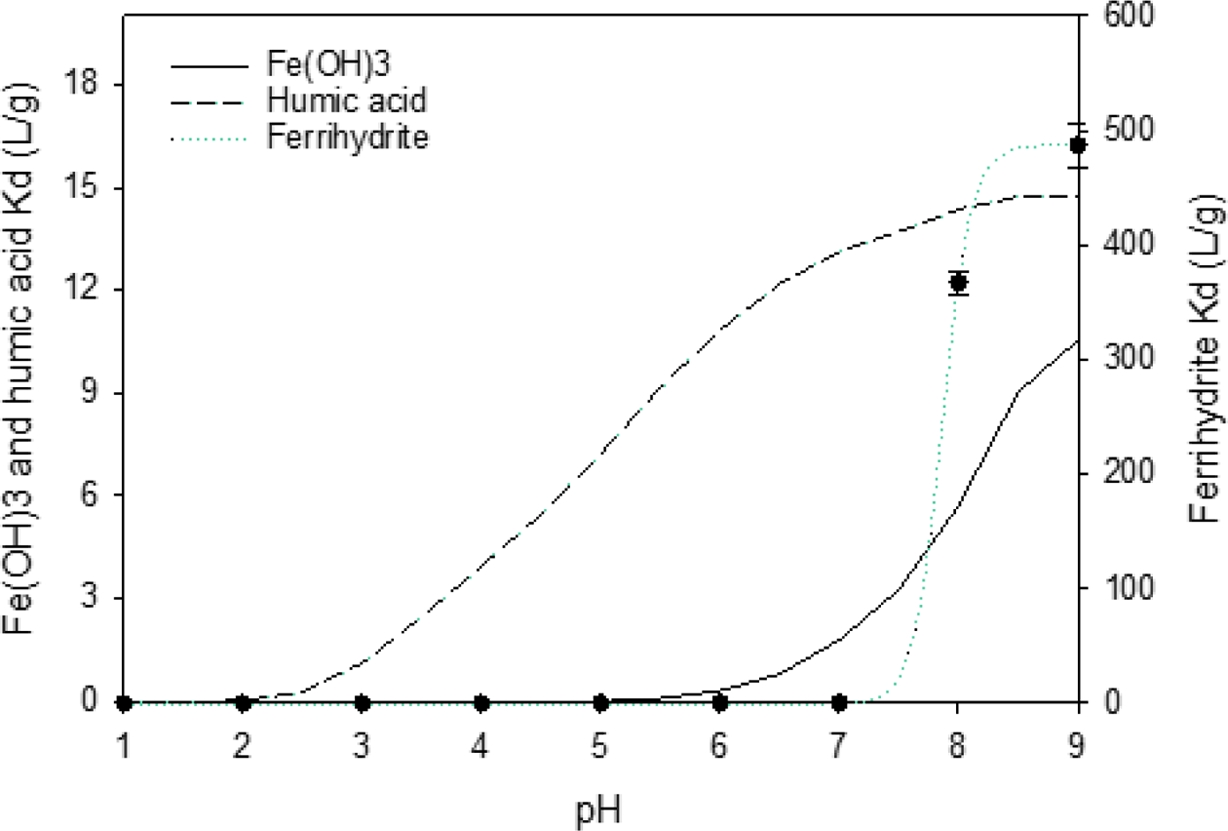
WHAM 7 시뮬레이션을 통해 pH 1-9 범위에서 Cd의 humic acid 및 Fe(OH)3에 대한 분배 계수 Kd의 변화를 Fig. 1에 나타냈다. 두 흡착상 모두 pH 증가에 따라 Kd 값이 점진적으로 상승하는 시그모이드(sigmoidal) 형태를 보였으며, 특히 각 물질의 영전하점(point of zero charge; PZC) 부근인 pH 4 (humic acid)와 pH 7-8(Fe(OH)3)에서 뚜렷한 변화가 나타났다. pH > PZC인 구간에서는 탈양성자화(deprotonation)로 인해 흡착상의 표면 전하가 음전하를 띠게 되고, 이에 따라 양이온 형태의 Cd²⁺와의 정전기적 인력이 강화되므로 Kd 값이 증가하는 경향을 보였다.
각 흡착상에서의 Cd 흡착량을 정량적으로 산정하기 위해 비선형 회귀분석을 적용하여 모형식을 도출한 결과는 아래와 같다. Fe(OH)3의 경우, pH 4.5 이하에서는 Cd 흡착이 거의 관찰되지 않았으며, 4.5–6.0 구간에서는 제시된 지수함수식 및 6.0–9.0 구간에서는 2차 다항식이 각각 적합한 설명력을 보였다.
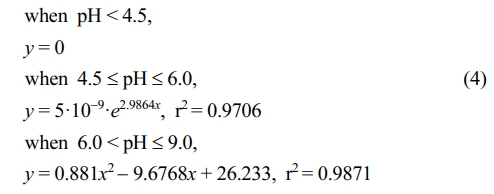
한편, humic acid 또한 시그모이드 함수의 형태로 pH 변화에 따른 Kd의 변화를 정밀하게 묘사할 수 있었으며, 비선형 회귀분석 결과 도출된 매개변수 값은 a = 15.31, b = 0.9928, x0 = 5.126이었다.
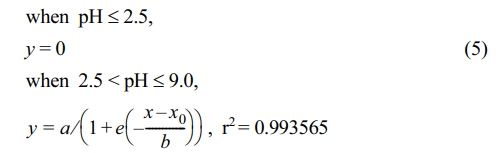
이러한 방식으로 예측된 두 흡착상의 Kd 값들은 기존 문헌 자료와도 대체로 일치하였는데, Oakley et al.(1981)과 Luoma and Davis(1983)는 pH 8에서 Fe(OH)3에 대한 Kd를 각각 4.4, 5.7 L/g으로 보고하였으며, Turner et al.(2008)은 pH 8.1 및 염분 4.8‰ 조건에서 수산화철(FeOOH)에 대해 5.5 L/g을 제시하였다. Bäckström et al.(2004)은 pH 6.3에서 goethite에 대한 Kd 값을 0.562 L/g으로 보고하였으며 Laxen(1983)이 정리한 33개 연구에서의 freshwater sediment의 Kd 값(pH 6.5–8.5) 또한 WHAM 7 예측치와 오차 범위 내에서 대체로 일치하였다. humic acid에 대한 문헌 자료는 상대적으로 제한적이지만, Davies-Colley et al.(1984)는 pH 6.75–8.5 및 약 5‰의 염분 조건에서 10–23 L/g을, Gardiner(1974)는 pH 7.5–8.0 조건에서 14–18 L/g을 보고하였다. 이는 WHAM 7에서 예측된 값과 약 2배 이내의 차이를 보였다.
4.1.2. 실험으로 도출된 Ferrihydrite의 Kd 분포
WHAM 7 모델은 humic acid와 Fe(OH)3만을 모사할 수 있어, 비정질 철 산화물의 영향을 평가하기 위해 ferrihydrite를 직접 합성하여 pH 1–9 구간에서 Cd 흡착 실험을 수행하였다. Fig. 1은 ferrihydrite의 Cd 흡착 특성을 WHAM 7 모델의 예측 결과와 함께 비교한 것이다. Ferrihydrite는 pH 증가에 따라 시그모이드 형태의 흡착 곡선을 보였으며, pH 7.5 부근에서 급격히 흡착이 증가하여 pH 8 이상에서 평형에 도달하였다. 이는 표면전위가 양전하에서 음전하로 전환되는 지점과 일치하며, Cd2+에 대한 정전기적 흡착 강화에 기인한다. 이를 수식으로 나타내면 다음과 같다.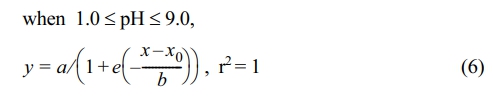
이때 도출된 상수는 a = 487.2, b = 0.1213, x0 = 7.864 이다.
측정된 Kd 값은 pH 5 이하에서 거의 흡착이 없었으나, pH 8에서 약 367 L/g으로 급증하였다. 이는 Davies-Colley et al.(1984)가 보고한 130 L/g(pH 8) 및 Laxen(1983)이 제시한 비정질 철산화물 Kd 범위(0.07–3,162 L/g, 일반적으로 200–2,000 L/g)에 부합한다. 즉, 본 연구에서 도출된 값은 문헌 범위 내에서 신뢰 가능한 수준임을 확인하였다.
Ferrihydrite의 Kd가 결정질 산화물보다 최대 300배 높게 나타난 것은 비표면적 및 구조적 특성 차이에 기인한다. Buekers et al.(2008)은 goethite(70 m2/g)와 hematite (10 m2/g)에 비해 ferrihydrite(270 m2/g)와 hydrous ferric oxide(500 m2/g)의 비표면적이 월등히 높다고 보고했으며, Luoma and Davis(1983) 또한 amorphous Fe oxyhydroxide의 비표면적(600 m2/g)이 goethite(50 m2/g)의 10배 이상임을 확인하였다. 이러한 구조적 특성은 반응성이 높은 edge site를 증가시켜 Cd²⁺ 결합에 유리하게 작용한다(Trivedi and Axe, 2001).
다만 본 연구는 합성 ferrihydrite를 이용한 단기 평형 조건에서 수행되어 장기적인 aging 효과는 반영하지 못한다. 실제 환경에서는 구조 재배열 및 미세공극 변화로 흡착능이 변할 수 있으며, Buekers et al.(2008)은 70일 동안 Cd의 Freundlich 상수가 513에서 1698로 증가함을 보고하였다. 본 연구에서는 이러한 영향을 최소화하기 위해 ferrihydrite를 -80oC에서 보관 후 실험 직전에 해동하여 사용하였다.
따라서 본 연구의 결과는 비정질 철 산화물이 산화 조건에서 Cd 흡착에 중요한 역할을 수행함을 입증하며, 향후 연구에서는 Mn oxide 등 추가 흡착상과 시간 경과에 따른 구조적 변화를 포함하여 보다 동적인 평가로 확장할 필요가 있다.
4.1.3. 실제 퇴적토에서의 total Kd 예측값과 실측값 비교
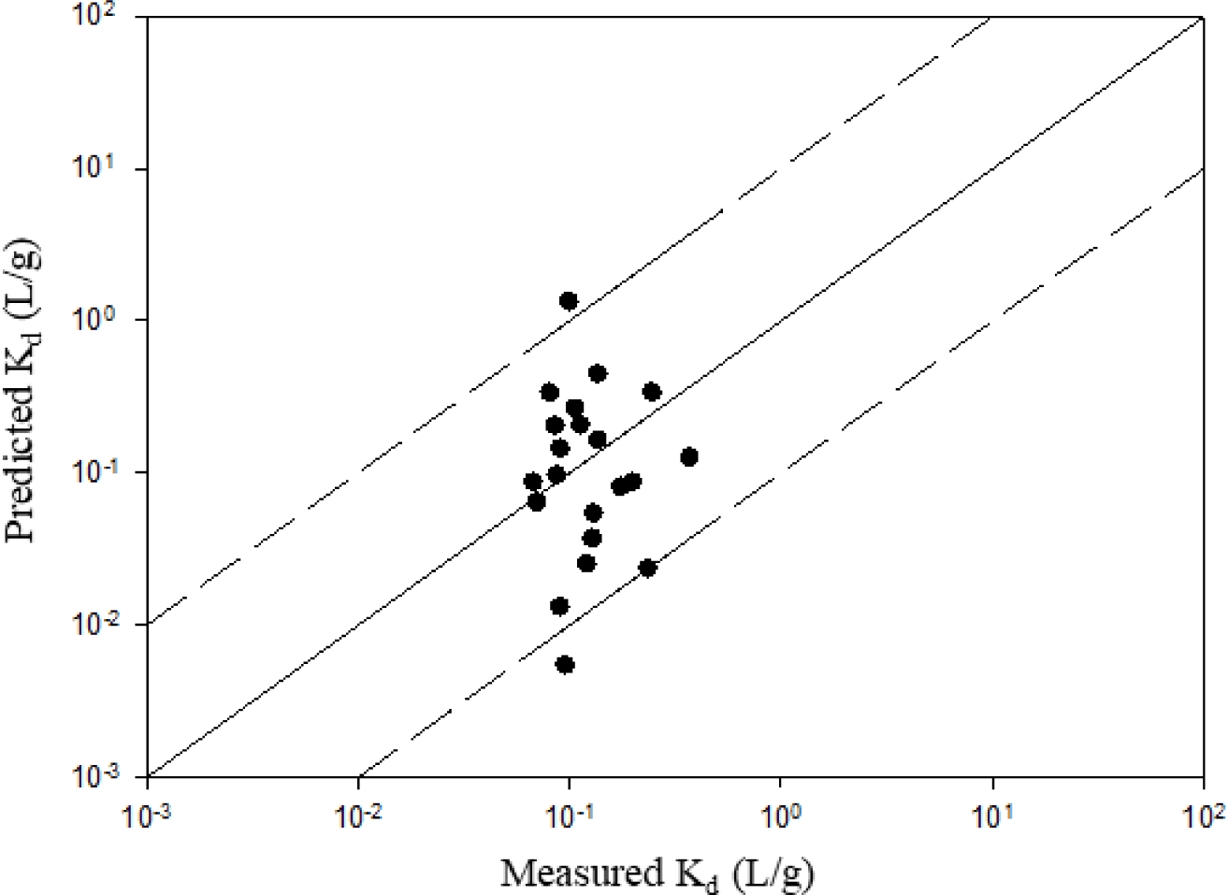
Total Kd 예측값은 퇴적토 내 Cd 결합의 주요 상(총 유기탄소, 비정질 철 산화물, 결정질 철 산화물) 세 가지를 반영한 식 (3)을 이용하여 산정하였다. 국내 21개 지점에서 채취한 퇴적토 시료의 물리·화학적 특성은 Table 1에 제시하였으며, 이렇게 예측된 Kd 값은 해당 시료를 이용한 흡착 실험으로부터 산출된 실험적 Kd 값과 비교하였다. 그 결과는 Fig. 2에 나타내었다.
본 연구에서 예측된 Kd 값은 대부분 실측값과 한 자릿수 차이 이내에서 일치하는 경향을 보였으며, 그중 AD2와 SY 시료에서 두드러진 차이가 관찰되었다. 여섯 개 시료(DHC, JJC, SG1, SG2, OPC, CW)는 예측값과 실측값이 특히 잘 부합하였는데, 이들 시료는 TOC 함량이 0.30–1.65% 범위에 분포하고, 비정질 철 산화물이 상대적으로 높은 특성을 공유하였다. 반면 결정질 철 산화물은 total Kd 값에 미치는 영향이 미미한 것으로 나타났다.
AD2 시료는 예측값(0.005 L/g)이 실측값(0.095 L/g)에 비해 약 20배 낮게 산정되어 큰 차이를 보였다. 이는 AD2 시료가 매우 낮은 TOC(0.02%)와 철 산화물(비정질 0.02%, 결정질 0.09%) 함량을 가지며, 토성이 모래(sand)인 것에 기인한 것으로 판단된다. 즉, 모델에서 고려한 주요 흡착상이 매우 낮은 농도로 존재하여 예측력이 제한된 결과로 해석되며, 이 때 높은 실측 Kd는 모델에서 고려하지 않은 다른 흡착상이 존재 할 수 있음을 시사한다. 본 연구에서 고려하고 있는 흡착상 이외에 Mn oxide, silicate 등이 중금속에 대해 강한 친화성을 가지는 것으로 알려져 있기 때문에 (Laxen,1983) 이러한 차이가 발생할 수 있다. 본 연구에서 제안하는 모델은 Mn oxide를 포함하지 않는다는 한계가 있는데, 이는 대부분의 경우 철 산화물 보다 낮은 함량으로 존재하며 다양한 pH 조건에서의 Kd 값들을 제시하는 문헌 데이터의 부족, 초기 모델 제안시 단순화 필요성 때문이다.
한편 SY 시료는 예측값이 과대 산정된 경우로, 예측된 Kd는 1.341 L/g으로 실측값(0.099 L/g)에 비해 13배 이상 높게 나타났다. SY는 21개 시료 중 가장 높은 TOC 함량(4.07%)과 pH(8.7)를 보였다. 본 연구는 s-BLM의 가정과 마찬가지로 모든 TOC가 humic acid로 작용한다고 가정하기 때문에 이로 인한 오차가 발생했을 개연성이 있다.
이러한 결과는 본 모델이 대부분의 퇴적토 유형에 대해서는 적절한 예측력을 보이지만, Mn oxide와 같이 중요한 흡착상이 제외되거나 TOC가 반응성이 낮은 성분에 의해 지배되는 경우에는 정확도가 저하될 수 있음을 시사한다.
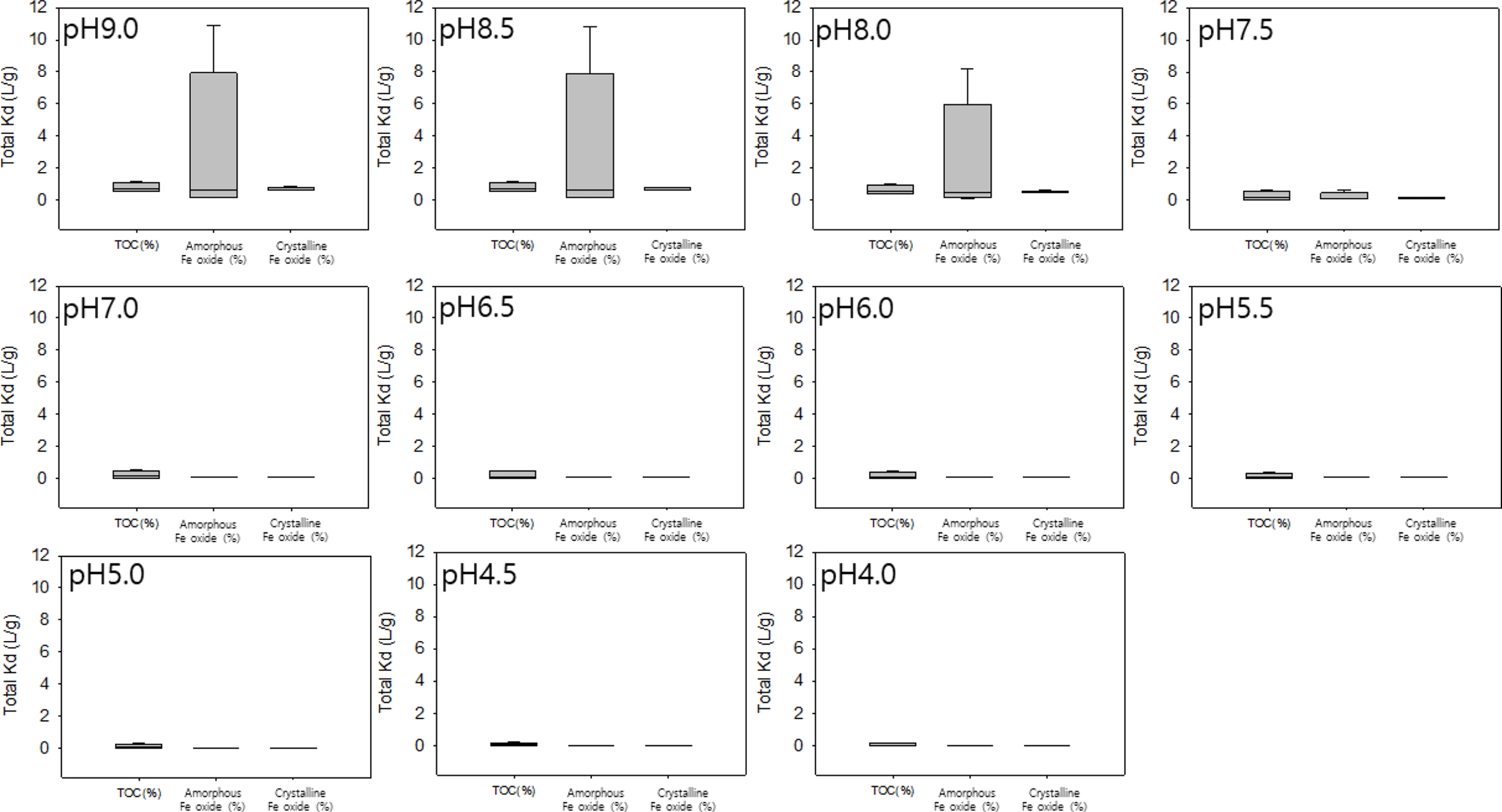
4.1.4. 예측된 total Kd 값의 민감도 분석
예측된 total Kd에 대한 주요 퇴적토 흡착상의 영향을 평가하기 위해 민감도 분석을 수행하였다. 분석은 YD 시료를 대표 사례로 선정하여 진행하였으며(Fig. 3), 주요 변수로는 총 유기탄소(TOC), 비정질 철 산화물(HFO), 결정질 철 산화물(CFO)을 고려하였다. 각 인자는 다른 인자를 일정하게 유지한 상태에서 독립적으로 변화시켰으며, 각 상의 Kd 값은 일정한 pH에서 안정적이라는 가정하에 수행되었다.
분석 과정에서 TOC는 0.01%에서 5%까지 변화시켰고, 비정질 및 결정질 철 산화물은 각각 0.001%에서 3% 범위 내에서 조정하였다. 이러한 범위는 자연 퇴적토 및 토양에서 보고된 값들을 참고 하였다(DeForest et al., 2021; Costello et al., 2011; Fairchild et al., 2012; Jain et al., 2007; Navrot et al., 1978; Nedrich et al., 2017; Ok et al., 2003; Casas and Crecelius, 1994). 고정 변수로는 TOC 0.62%, 비정질 철 산화물 0.11%, 결정질 철 산화물 0.4%를 기본값으로 적용하였다.
Fig. 3에서 예측된 total Kd는 pH에 따라 뚜렷한 변화를 보였으며, 특히 pH 7.5 부근에서 급격히 증가하였다. pH 7.5 이하에서는 두 철 산화물의 기여가 미미해 TOC가 Cd 분배에 주요한 영향을 미쳤으나, 그 이상에서는 ferrihydrite의 기여가 지배적으로 전환되었다. 이는 ferrihydrite의 PZC= 7.5와 일치하며, pH 상승에 따라 표면 전하가 양(+)에서 음(–)으로 전환되면서 Cd 흡착이 급격히 강화된 결과로 해석된다.
따라서 pH가 낮을 때는 TOC가, 알칼리 조건에서는 비정질 철 산화물이 Cd 거동을 결정하는 주요 결합상으로 작용한다. 이러한 상호전환을 고려하지 않을 경우 Kd 예측에서 큰 오차가 발생할 수 있으며, 철 산화물의 함량을 분배모델에 포함하는 것이 Cd의 생물학적 이용성 평가에 필수적임을 시사한다.
4.2. 퇴적토 독성 평가 방법
4.2.1. total Kd 예측 값으로부터 산정한 용존 Cd 농도
Table 1에 나타낸 바와 같이 국내 21개 지점의 퇴적토에서 측정된 Cd 농도(Cₛ)는 0.05–1.28 mg/kg 범위였으며, 특히 BH 시료는 1.28 mg/kg으로 가장 높은 값을 보여 국지적 오염 가능성을 시사하였다. 이러한 Cₛ 값은 기존 문헌에서 보고된 범위와 일치한다. 예를 들어, Besser et al.(2009)은 광산 영향을 받은 퇴적토에서 0.04–18 mg/kg의 Cd 농도를, Fairchild et al.(2012)는 담수 환경에서 불검출 수준부터 4 mg/kg까지의 범위를 보고한 바 있다.
예측된 total Kd는 0.005–1.34 L/g의 범위를 보였으며, 이는 각 지역 퇴적토의 지화학적 특성 차이에 기인한 것으로 판단된다.
측정된 Cs와 본 연구를 통해 예측된 Kd 값을 바탕으로 산출된 수중 Cd 농도(Cw)는 0.15–97 μg/L 범위로 나타났다. 이러한 Cw 값은 퇴적토 공극수 내 생물학적으로 이용 가능한 Cd 농도를 의미하며(Ankley et al., 1994; Di Toro et al., 2005), 단순한 총 농도 기반 평가보다 잠재적 독성을 보다 정밀하게 추정할 수 있다.
특히 BH 시료의 경우, CS가 1.28 mg/kg으로 가장 높았고 Kd 값은 0.013 L/g으로 상대적으로 낮았다. 이에 따라 산출된 Cw는 97 μg/L로 21개 시료 중 가장 높은 값을 보였다. 이는 해당 퇴적토 내 Cd가 이동성이 높고 용존상으로 쉽게 전환될 수 있음을 시사하며, 잠재적으로 생물학적 이용성과 독성 위험성이 크게 증가할 수 있음을 보여준다.
이러한 결과는 SEC와 같은 전통적인 퇴적토 독성 기준을 산정시 부지별 지화학적 특성을 반드시 고려해야 함을 강조한다. 총 Cd 농도가 높다고 해서 반드시 높은 독성 잠재력을 의미하는 것은 아니며, 유기탄소와 철 산화물과 같은 퇴적토의 성분이 용존 Cd의 농도를 크게 저감시킬 수 있다(Mahony et al., 1996; Costello et al., 2015; Kwok et al., 2014).
4.2.2. SEC 산정 결과
본 연구에서 산정한 퇴적토 SEC는 Table 2에 요약하였다. 이들 임계값—LEL, TEL, SEL, PEL—은 Cd의 퇴적토 독성을 생태학적 및 생태독성학적 관점에서 평가하기 위한 주요 기준점으로 기능한다.
LEL은 0.06 mg/kg으로 산정되었으며, 이는 저서생물의 95% 이상이 유의한 독성 반응 없이 생존할 수 있는 농도를 의미한다. 반면 TEL은 0.12 mg/kg으로 계산되었으며, 이는 표준화된 H. azteca 생물검정시험에서 독성이 나타나지 않는 수준을 나타낸다. LEL은 현장 생태 자료를 기반으로 도출되어 자연 저서생물 군집의 민감도를 반영하는 반면, TEL은 실험실 조건에서의 독성시험 자료를 기반으로 도출되어 보다 제한적이지만 정밀한 생물학적 관점을 제공한다. LEL과 TEL 간의 차이는 자연 퇴적토 환경의 복잡성을 반영하며, 이는 다양한 스트레스 요인과 종 간 상호작용이 실험실 조건보다 낮은 농도에서도 생태적 영향을 유발할 수 있음을 시사한다. 또한 자연 퇴적토에는 H. azteca보다 Cd에 더 민감한 종들이 공존할 수 있어 LEL이 TEL보다 낮게 산정되는 결과를 설명할 수 있다. 이러한 경향은 기존 연구 및 가이드라인 산정 과정에서도 일관되게 보고된 바 있다(De Deckere et al., 2011; Burton, 2002; Hübner et al., 2009; MacDonald et al., 1996).
보다 높은 독성 임계값에 해당하는 SEL은 0.51 mg/kg으로, 특정 저서생물이 여전히 관찰되는 지점의 Cd 농도 중 95번째 백분위에 해당하며, 이를 초과할 경우 5% 미만의 종만이 생존할 것으로 예상된다. PEL은 생물검정 자료를 기반으로 0.21 mg/kg으로 산정되었으며, 실험실 노출실험에서 이 농도를 초과할 때 독성 효과가 빈번히 나타날 수 있음을 의미한다. SEL이 PEL보다 높은 것은 두 지표의 역할 차이를 반영한다. 즉, SEL은 군집 차원의 심각한 교란을 나타내는 생태학적 지표이며, PEL은 단일 종 기반 생물검정에서의 잠재적 독성 발현 기준이다. 이러한 구분을 통해 장기적 생태학적 위험과 단기적 실험실 독성 모두를 평가할 수 있다.
이러한 임계값들을 토대로 Consensus 1은 0.09 mg/kg으로 산출되었으며, 이는 “양호한 생태 상태”에 해당하는 보수적 기준으로 기능한다. Consensus 2는 0.36 mg/kg으로 산정되었으며, 이를 초과할 경우 독성 효과가 발현될 가능성이 높아 해당 부지의 퇴적토 관리를 위한 제도적 개입이 필요할 수 있음을 시사한다.
문헌 값과 비교했을 때, 특히 De Deckere et al.(2011)이 보고한 값에 비해 본 연구에서 산출된 SEL과 PEL은 낮은 수준을 보였다. 예를 들어, De Deckere et al.(2011)은 Consensus 1과 2를 각각 0.93 mg/kg 및 7.8 mg/kg으로 제시하였는데, 이는 본 연구에서 산정한 값보다 현저히 높았다. 이러한 차이는 부지별 퇴적토 특성과 생물 군집 차이에 기인하며, 현장 기반 지침을 개발할 때 지역 맞춤형 접근이 필요함을 강조한다.
4.2.3. SEC와 total Kd 계수를 바탕으로 평가한 퇴적토 독성
본 연구에서 산정된 SEC 임계값을 기준으로 퇴적토 시료를 세 가지 범주로 분류하였다(Table 3). Cd 농도가 Consensus 1 미만인 경우를 “Not Toxic”, Consensus 2를 초과하는 경우를 “Toxic”, 그리고 두 기준값 사이에 해당하는 경우를 “Uncertain”으로 정의하였다.
이 분류 결과를 H. azteca 생물검정실험 결과와 비교하였는데, Cd 독성을 나타내는 기준으로 24% 치사율을 적용하였다(Berry et al., 1996). 21개 퇴적토 시료 중 SEC 기준에 따라 정확히 “Not Toxic” 또는 “Toxic”으로 분류된 것은 9개 시료에 불과하였다. 이 중 AD1, AD2, AD3 시료는 “Not Toxic”으로 분류되었음에도 불구하고 유의한 독성이 관찰되어 오분류된 사례에 해당하였다. 또한 9개 시료는 “Uncertain” 범주에 포함되었으며, 이들에서는 생물검정 결과와 일관성이 확보되지 않았다. 결과적으로 SEC 기반 분류의 전체 예측 정확도는 43%에 그쳐, 경계 농도에 해당하는 시료에 대해서는 한계가 있음을 보여주었다.
이러한 한계를 개선하기 위하여, total Kd를 이용해 예측된 CW 농도를 활용한 IWTU 평가 방법을 적용하였을때 퇴적토 독성 예측 성능은 크게 향상되었다. 전체 21개 시료 중 17개가 정확하게 분류되었으며, 예측 정확도는 81%로 증가하였다. 다만 CW, DHC, SG1, SG2의 네 시료는 생물검정에서 독성이 관찰되지 않았음에도 불구하고 “Toxic”으로 과대평가되었다. 이들 시료의 CW 값은 0.55–1.04 μg/L 범위로, IWTU 기준치인 0.5 μg/L를 초과하였다. 이는 Kd 예측 자체는 정확했음에도 불구하고 모델에서 고려되지 않은 추가적인 지화학적 상호작용에 의해 발생했을 가능성이 있다. 예를 들어, Cd가 용존유기탄소(DOC)나 무기 리간드(탄산염, 황산염, 염화물 등)와 착물을 형성할 경우 자유 이온 활성이 감소하고 생물학적 이용성이 낮아져 독성이 과대 추정될 수 있다. 이러한 결과는 IWTU 기반 예측을 해석할 때에도 부지별 지화학적 맥락을 고려할 필요성을 보여준다.
또한 DHC 시료는 치사율이 23%로 독성 기준치(24%)에 근접한 경계 사례였다. 만약 De Deckere et al.(2011)이 제안한 바와 같이 기준치를 20%로 적용할 경우, 이 시료는 “Toxic”으로 분류되었을 것이다. 이는 임계값 기반 분류에서 발생할 수 있는 주관성을 보여주며, 기준치의 작은 변화가 독성을 판단함에 큰 영향을 미칠 수 있음을 시사한다.
이러한 불확실성은 SEC 접근법에만 국한되지 않는다. 예를 들어, 평형분배(EqP) 접근법에서도 “무독성” 기준(<130 μmol/g OC)과 “독성 가능성 높음” 기준(>3000 μmol/g OC) 사이에 넓은 불확실 구간이 존재한다(Di Toro et al., 2005). 따라서 SEC 평가 방식에서 “Uncertain” 범주가 설정되는 것은 환경독성 평가 전반에서 흔히 나타나는 한계로, 실제 생물학적 반응은 이분법적 기준에 깔끔하게 들어맞기보다는 여러 변수에 의해 영향을 받는 연속적인 스펙트럼을 따른다.
따라서 SEC는 여전히 신속한 선별 도구로 활용할 수 있으나, 보다 정밀하고 현실적인 퇴적토 독성 평가를 위해서는 IWTU와 같은 2차적 접근을 고려한 계층적(tiered) 평가 방법을 병행하는 것이 권고된다. 이러한 결과는 다양한 증거와 예측 모델을 통합하여 분류 정확도를 향상시키고, 퇴적토 평가에서 불확실성을 줄이는 데 중요한 의의를 가진다.
4.3. Tiered approach: SEC와 IWTU를 병합한 퇴적토 독성 분류
SEC와 IWTU 접근법을 통합한 결과, 퇴적토 독성 예측의 정확도가 크게 향상되었으며(Table 4), SEC 단독 적용 시 43%에 불과하던 예측률이 76%로 증가하였다. 특히 SEC에서 “Uncertain”으로 분류된 9개 시료 중 8개가 IWTU 적용 후 올바르게 재분류되어, 경계 구간의 판별력이 개선되었다.
IWTU는 공극수 내 Cd의 생물학적 이용가능성을 정량화하여 SEC의 한계를 보완하는 지표로, 두 접근법의 통합은 정성적 생태정보(SEC)와 정량적 반응성 지표(IWTU)의 상호 보완적 장점을 결합한다. SEC가 기준 농도를 기반으로 한 안정적 분류를 제공한다면, IWTU는 경계 구간에서의 예측 정밀도를 높인다.
한편 독성 기준치 설정은 평가 결과에 영향을 미칠 수 있다. 본 연구에서는 Berry et al.(1996)의 24% 치사율 기준을 적용하였으나, De Deckere et al.(2011)의 20% 기준을 적용할 경우 일부 시료의 분류가 달라질 수 있었다. 이는 독성 분류의 민감성을 시사한다.
전반적으로 CW가 증가할수록 H. azteca의 치사율도 상승하였으나, 일부 고농도 구간에서는 다소 불규칙한 반응이 나타났다. 이는 단일 종 급성시험에서의 생물학적 변동성, 퇴적물 이질성, 실험적 불확실성 등의 복합적 영향으로 해석된다.
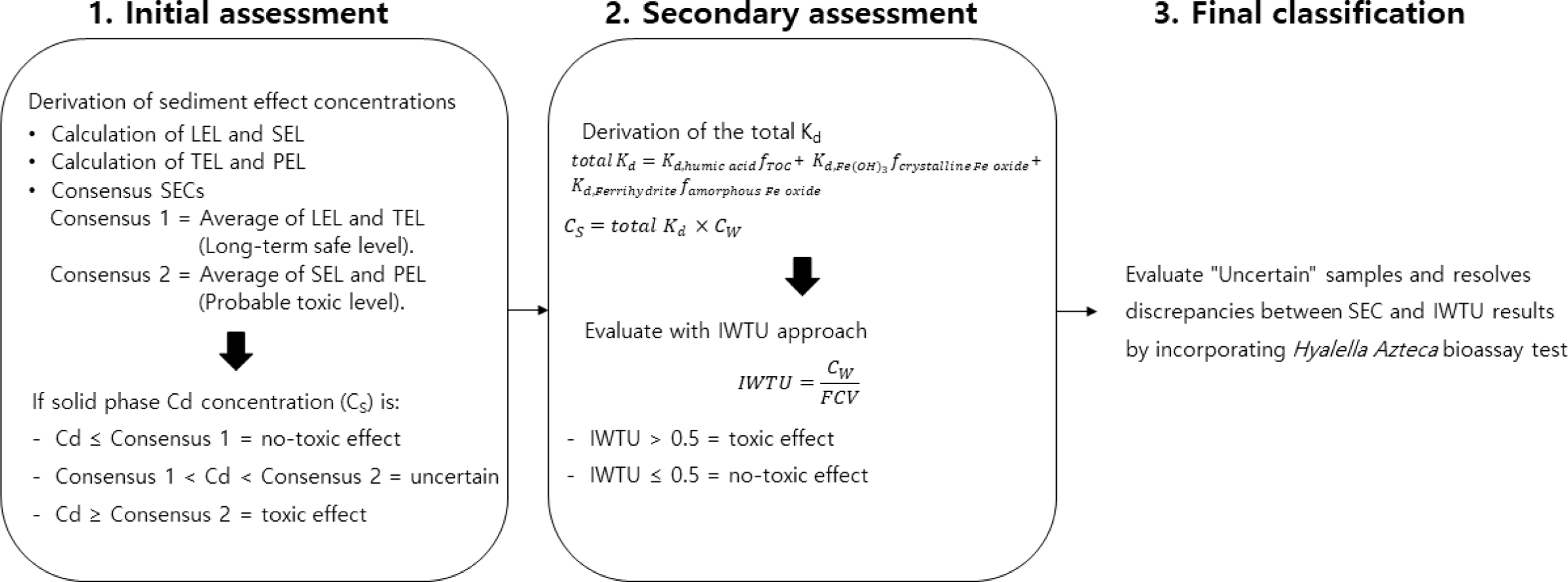
구체적으로, 제안된 프레임워크는 SEC를 이용한 1차 분류 → 본 연구에서 제시한 total Kd 예측 방법을 활용한 IWTU 적용에 따른 2차 분류 → 생물검정을 통한 최종 검증의 단계로 구성된다(Fig. 4). 먼저 SEC 기준(Consensus 1, Consensus 2)에 따라 시료를 Not Toxic, Uncertain, Toxic으로 1차 분류한다. 이어서, 본 연구에서 도출한 total Kd 예측치를 기반으로 IWTU 평가 기준(CW/FCV)을 적용하여 2차 분류를 수행한다. 마지막으로, 1차와 2차 결과가 불일치하거나 해석이 모호한 시료에 대해서는 H. azteca 생물검정을 통해 최종 독성 여부를 확정한다.
|
Fig. 1 pH-dependent variation in Cd partition coefficients (Kd), showing WHAM 7-predicted values for humic acid and Fe(OH)3 together with regression-fitted ferrihydrite data. Measured Kd values for ferrihydrite are plotted as filled circles with error bars indicating standard deviations. |
|
Fig. 2 Comparison between predicted and measured total partition coefficients (Kd) for 21 sediment samples. The solid line represents a 1:1 relationship, while the dashed lines indicate a difference of one order of magnitude. |
|
Fig. 3 Sensitivity analysis of total predicted Kd values for the YD sediment sample. The contents of TOC, amorphous Fe oxides, and crystalline Fe oxides were varied within environmentally relevant ranges, while other parameters were kept constant, to examine their individual influence on total Kd. |
|
Fig. 4 lowchart of the proposed tiered framework integrating Sediment Effect Concentrations (SECs) with the Interstitial Water Toxic Unit (IWTU) approach to improve the accuracy and reliability of sediment toxicity assessment. |
|
Table 1 Physicochemical characteristics of the sediment samples, including pH, total organic carbon, and iron oxide content, describing geochemical variability among sites |
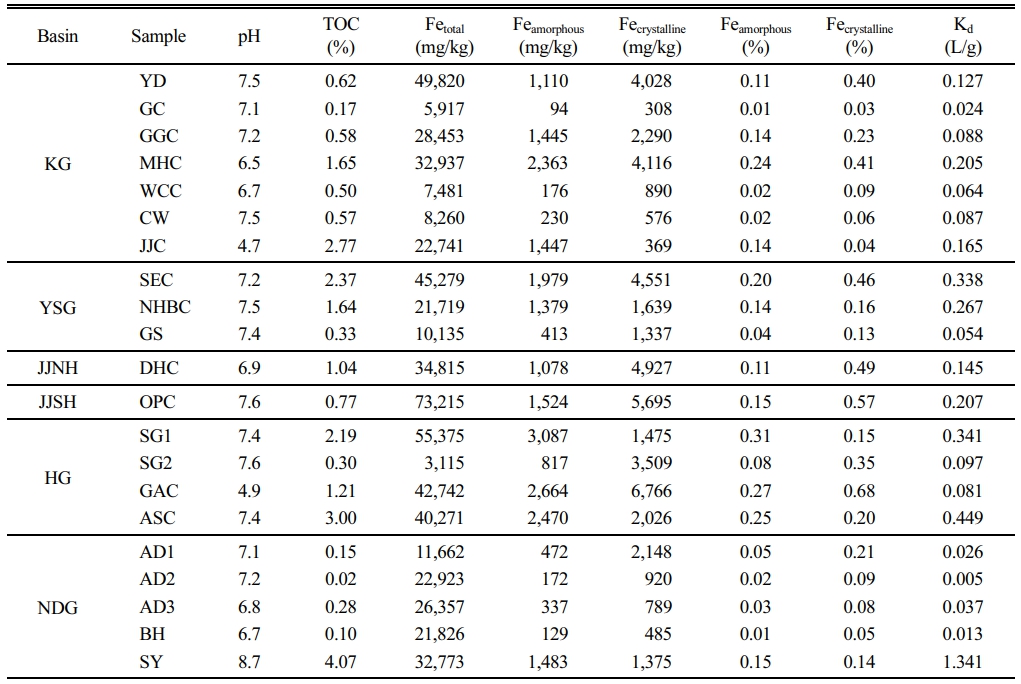
|
Table 2 Threshold values for sediment toxicity assessment, including LEL, TEL, SEL, PEL, and the derived consensus values (Consensus 1 and Consensus 2) |
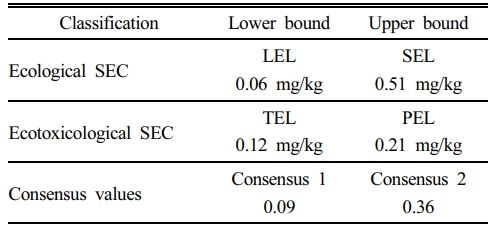
|
Table 3 Comparison of consensus-based classifications with Hyalella azteca mortality results. Data are presented as mean (%) with standard deviation from triplicate bioassays |
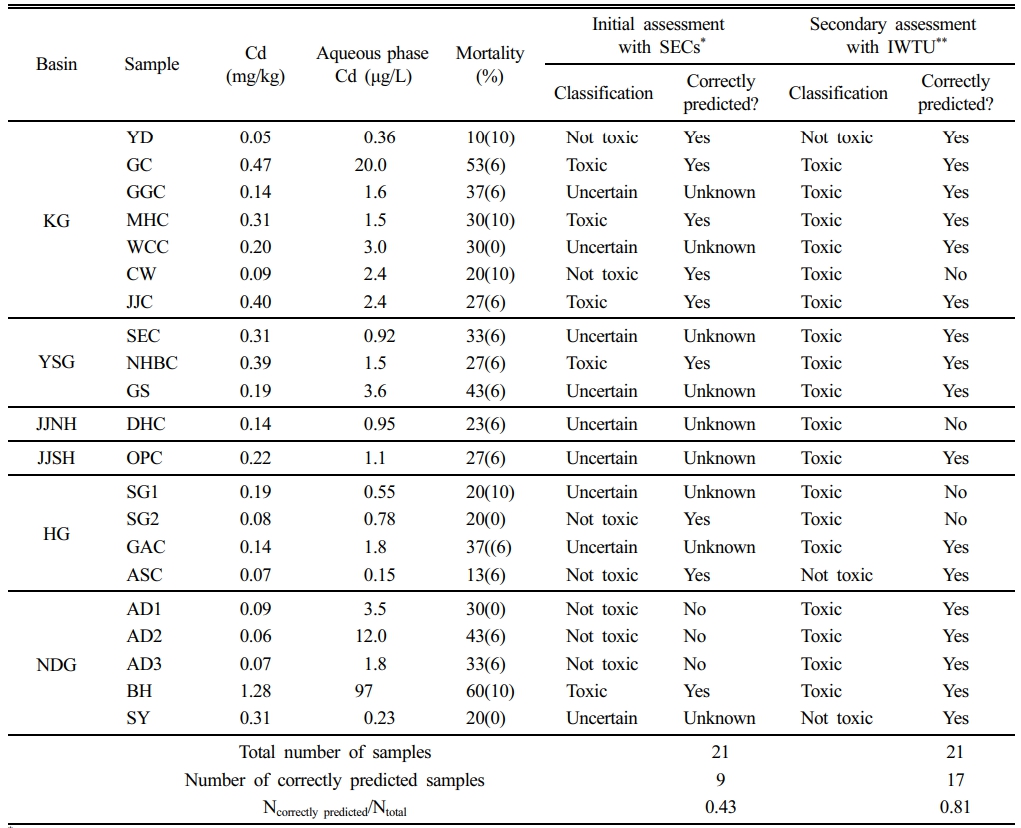
*SECs: Sediment Effect Concentrations (De Deckere et al., 2011) |
|
Table 4 Prediction performance of the final classification, showing the number of correctly identified samples and overall accuracy |
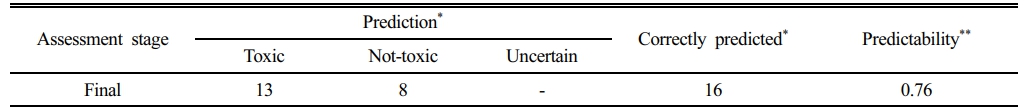
*Prediction and Correctly predicted values represent the number of sites classified into each category and the number of those sites that were correctly predicted by the proposed framework, respectively. |
본 연구에서는 퇴적토 내 Cd의 독성을 보다 정밀하게 평가하기 위하여, total Kd 예측을 기반으로 한 CW 산출과 이를 활용한 IWTU 평가 방법 적용, 그리고 전통적인 SEC 접근을 통합하는 방법을 제안하였다.
첫째, WHAM7 소프트웨어를 이용한 humic acid 및 Fe(OH)3에서의 Cd 흡착 시뮬레이션과 ferrihydrite에 대한 실험적 흡착 특성을 반영하여 total Kd를 예측하고, 이를 21개 국내 퇴적토 시료에 적용한 결과, 예측값은 대체로 실측값과 한 자릿수 차이 이내에서 일치하였다. 이를 통해 본 연구에서 제안한 Kd 예측 방법이 현장 퇴적토에 적용 가능한 수준의 설명력을 지님을 확인하였다. 다만, 본 모델은 주요 결합상을 TOC와 철 산화물로 한정하여 단순화한 초기 형태로, 일부 시료에서는 퇴적물 내 다른 흡착상(Mn oxide, silicate 등)의 기여가 충분히 반영되지 못했을 가능성이 있다. 또한 TOC를 단일한 humic acid 상으로 가정함으로써 실제 퇴적유기물 내 fulvic 또는 non-humic 성분의 영향을 완전히 반영하지는 못하였다. 향후 연구에서는 Mn oxide 등 추가적인 결합상을 포함한 흡착 실험을 병행하고, 유기탄소의 화학적 분획을 고려한 모형 확장을 통해 보다 다양한 지화학적 조건에서도 예측 정확도를 향상시킬 수 있을 것이다.
둘째, 예측된 Kd를 바탕으로 산출된 수중 Cd 농도(CW)는 SEC 기준치와의 비교를 통해 저서 생물에 대한 독성 가능성을 평가하는 데 활용되었다. 그러나 SEC 단독 분류의 경우 전체 예측 정확도가 43%에 그쳤으며, 특히 “Uncertain” 범주에 해당하는 시료에서는 독성 평가의 신뢰성이 낮았다. 동일한 시료들에 대해 IWTU 방식으로 평가한 결과 예측 정확도는 81%로 향상되었으며, SEC 기준에서 “Uncertain”으로 분류된 다수의 시료가 보다 명확히 재분류되었다. 이는 IWTU가 Cd의 생물학적 이용성을 반영하여 SEC의 한계를 보완할 수 있음을 보여준다. 두 방법을 통합적으로 사용하는 경우의 예측 정확도는 76%로 SEC를 단독으로 적용할 때 보다 개선 되었다.
마지막으로, 본 연구는 SEC와 IWTU를 결합한 계층적(tiered) 평가 프레임워크를 제안하였다. SEC를 활용한 1차 분류, Kd 예측 기반 IWTU 적용을 통한 2차 분류, 그리고 불일치 시료들에 대해 생물검정시험 결과와 비교하는 최종 검증의 단계적 절차는 단일 지표에 의존할 때 발생할 수 있는 오분류를 줄이고, 퇴적토 독성 평가의 정밀성과 현장 적용성을 향상시킬 수 있다.
종합하면, 본 연구는 전통적 SEC 접근과 예측 기반 IWTU 평가를 통합함으로써 Cd의 퇴적토 독성을 보다 신뢰성 있게 평가할 수 있는 과학적 근거를 제시하였다. 이러한 접근은 Cd뿐만 아니라 다양한 중금속 오염 상황에도 적용 가능하며, 향후 혼합금속 독성 및 확률론적 위해성 평가로 확장될 수 있는 기반을 마련한다.
본 연구는 환경부의 재원으로 한국환경산업기술원의 지중환경오염∙위해관리기술개발사업의 지원을 받아 연구되었습니다(RS-2018-KE000140). 또한, 서울대학교 공학연구원의 기술적 지원에도 감사드립니다.
- 1. Ankley, G.T., Thomas, N.A., Di Toro, D.M., Hansen, D.J., Mahony, J.D., Berry, W.J., Swartz, R.C., Hoke, R.A., Garrison, A.W., Allen, H.E., and Zarba, C.S. (1994). Assessing potential bioavailability of metals in sediments: a proposed approach. Environ. Manage., 18, 331-337.
-

- 2. Ankley, G.T., Di Toro, D.M., Hansen, D.J., and Berry, W.J. (1996). Technical basis and proposal for deriving sediment quality criteria for metals. Environ. Toxicol. Chem.: An International Journal, 15(12), 2056-2066.
-

- 3. Bäckström, M., Dario, M., Karlsson, S., and Allard, B. (2003). Effects of a fulvic acid on the adsorption of mercury and cadmium on goethite. Sci. Total Environ., 304(1-3), 257-268.
-

- 4. Berry, W.J., Hansen, D.J., Mahony, J.D., Robson, D.L., DiToro, D.M., Shipley, B.P., Rogers, B., Corbin, J.M., and Boothman, W.S. (1996). Predicting the toxicity of metal‐spiked laboratory sediments using acidvolatile sulfide and interstitial water normalizations. Environ. Toxicol. Chem.: An International Journal, 15(12), 2067-2079.
-

- 5. Besser, J.M., Brumbaugh, W.G., Hardesty, D.K., Hughes, J.P., and Ingersoll, C.G. (2009). Assessment of metal-contaminated sediments from the Southeast Missouri (SEMO) mining district using sediment toxicity tests with amphipods and freshwater mussels. United States Geological Survey Administrative report submitted to the United States Fish and Wildlife Service, Ecological Services Office, Region, 3.
-

- 6. Bruemmer, G.W., Gerth, J., and Tiller, K.G. (1988). Reaction kinetics of the adsorption and desorption of nickel, zinc and cadmium by goethite. I. Adsorption and diffusion of metals. J. Soil Sci., 39(1), 37-52.
-

- 7. Buekers, J., Amery, F., Maes, A., and Smolders, E. (2008). Long‐term reactions of Ni, Zn and Cd with iron oxyhydroxides depend on crystallinity and structure and on metal concentrations. Eur. J. Soil Sci., 59(4), 706-715.
-

- 8. Burton, Jr, G.A. (2002). Sediment quality criteria in use around the world. Limnol., 3, 65-75.
-

- 9. Casas, A.M. and Crecelius, E.A. (1994). Relationship between acid volatile sulfide and the toxicity of zinc, lead and copper in marine sediments. Environ. Toxicol. Chem.: An International Journal, 13(3), 529-536.
-

- 10. Costello, D.M., Burton, G.A., Hammerschmidt, C.R., Rogevich, E.C., and Schlekat, C.E. (2011). Nickel phase partitioning and toxicity in field-deployed sediments. Environ. Sci. Technol., 45(13), 5798-5805.
-

- 11. Costello, D.M., Hammerschmidt, C.R., and Burton, G.A. (2015). Copper sediment toxicity and partitioning during oxidation in a flow-through flume. Environ. Sci. Technol., 49(11), 6926-6933.
-

- 12. Dang, D.H., Layglon, N., Ferretto, N., Omanovic ́, Mullot, J.-U. Lenoble, V., Mounier, S., and Garnier, C. (2020). Kinetic processes of copper and lead remobilization during sediment resuspension of marine polluted sediments. Sci. Total Environ., 698, 134120.
-

- 13. Davies-Colley, R.J., Nelson, P.O., and Williamson, K.J. (1984). Copper and cadmium uptake by estuarine sedimentary phases. Environ. Sci. Technol., 18(7), 491-499.
-

- 14. De Deckere, E., De Cooman, W., Leloup, V., Meire, P., Schmitt, C., and von der Ohe, P.C. (2011). Development of sediment quality guidelines for freshwater ecosystems. J. Soils Sediments, 11, 504-517.
-

- 15. DeForest, D.K., Toll, J.E., Judd, N.L., Shaw, A., McPeek, K., Tobiason, K., and Santore, R.C. (2021). Sediment toxicity data and excess simultaneously extracted metals from field‐collected samples: Comparison to United States Environmental Protection Agency benchmarks. Integr. Environ. Assess. Manag., 18(1), 174-186.
-

- 16. Di Toro, D.M., Mahony, J.D., Hansen, D.J., Scott, K.J., Hicks, M.B., Mayr, S.M., and Redmond, M.S. (1990). Toxicity of cadmium in sediments: the role of acid volatile sulfide. Environ. Toxicol. Chem.: An International Journal, 9(12), 1487-1502.
-

- 17. Di Toro, D.M., McGrath, J.A., Hansen, D.J., Berry, W.J., Paquin, P.R., Mathew, R., Wu, K.B., and Santore, R.C. (2005). Predicting sediment metal toxicity using a sediment biotic ligand model: methodology and initial application. Environ. Toxicol. Chem.: An International Journal, 24(10), 2410-2427.
-

- 18. Fairchild, J.F., Kemble, N.E., and Allert, A.L. (2012). Laboratory toxicity and benthic invertebrate field colonization of upper Columbia River sediments: finding adverse effects using multiple lines of evidence. Arch. Environ. Contam. Toxicol., 63, 54-68.
-

- 19. Feyte, S., Tessier, A., Gobeil, C., and Cossa, D. (2010). In situ adsorption of mercury, methylmercury and other elements by iron oxyhydroxides and organic matter in lake sediments. Appl. Geochem., 25(7), 984-995.
-

- 20. Gambrell, R.P., Khalid, R.A., Verloo, M.G., and Patrick Jr, W.H. (1977). Transformations of Heavy Metals and Plant Nutrients in Dredged Sediments as Affected by Oxidation Reduction Potential and pH. Volume 2. Materials and Methods/Results and Discussion.
- 21. Gardiner, J. (1974). The chemistry of cadmium in natural water—II. The adsorption of cadmium on river muds and naturally occurring solids. Water Res., 8(3), 157-164.
-

- 22. Gee, G.W. and Bauder, J.W. (1986). Particle Size Analysis. Methods of Soil Analysis: Part 1. Physical and Mineralogical Methods. Klute, A.(Ed). Agronomy Monograph No. 9. 2nd Edition. American Society of Agronomy/Soil Science Society of America, Madison, WI, 383-411.
-

- 23. Hübner, R., Astin, K.B., and Herbert, R.J. (2009). Comparison of sediment quality guidelines (SQGs) for the assessment of metal contamination in marine and estuarine environments. J. Environ. Monit., 11(4), 713-722.
-

- 24. Jain, C.K., Malik, D.S., and Yadav, R. (2007). Metal fractionation study on bed sediments of Lake Nainital, Uttaranchal, India. Environ. Monit. Assess., 130, 129-139.
-

- 25. Johnson, B.B. (1990). Effect of pH, temperature, and concentration on the adsorption of cadmium on goethite. Environ. Sci. Technol., 24(1), 112-118.
-

- 26. Kostka, J.E. and Luther III, G.W. (1994). Partitioning and speciation of solid phase iron in saltmarsh sediments. Geochim. Cosmochim. Acta, 58(7), 1701-1710.
-

- 27. Kwok, K.W., Batley, G.E., Wenning, R.J., Zhu, L., Vangheluwe, M., and Lee, S. (2014). Sediment quality guidelines: challenges and opportunities for improving sediment management. Environ. Sci. Pollut. Res., 21, 17-27.
-

- 28. Laxen, D.P. (1983). Cadmium adsorption in freshwaters—a quantitative appraisal of the literature. Sci. Total Environ., 30, 129-146.
-

- 29. Luoma, S.N., and Davis, J.A. (1983). Requirements for modeling trace metal partitioning in oxidized estuarine sediments. Mar. Chem., 12(2-3), 159-181.
-

- 30. Macdonald, D.D., Carr, R.S., Calder, F.D., Long, E.R., and Ingersoll, C.G. (1996). Development and evaluation of sediment quality guidelines for Florida coastal waters. Ecotoxicology, 5, 253-278.
-

- 31. Mahony, J.D., Di Toro, D.M., Gonzalez, A.M., Curto, M., Dilg, M., De Rosa, L.D., and Sparrow, L.A. (1996). Partitioning of metals to sediment organic carbon. Environ. Toxicol. Chem.: An International Journal, 15(12), 2187-2197.
-

- 32. Mustafa, G., Singh, B., and Kookana, R.S. (2004). Cadmium adsorption and desorption behaviour on goethite at low equilibrium concentrations: effects of pH and index cations. Chemosphere, 57(10), 1325-1333.
-

- 33. Navrot, J., Singer, A., and Banin, A. (1978). Adsorption of Cadmium and its Exchange Characteristics in Some Israeli Soils. J. Soil Sci., 29, 205-511.
-

- 34. National Institute of Environmental Research (NIER). (2023). National protocol for biological monitoring and assessment: Benthic macroinvertebrate survey methods. Ministry of Environment, Republic of Korea.
- 35. Nedrich, S.M. and Burton Jr, G.A. (2017). Sediment Zn-release during post-drought re-flooding: Assessing environmental risk to Hyalella azteca and Daphnia magna. Environ. Pollut., 230, 1116-1124.
-

- 36. Oakley, S.M., Nelson, P.O., and Williamson, K.J. (1981). Model of trace-metal partitioning in marine sediments. Environ. Sci. Technol., 15(4), 474-480.
-

- 37. Ok, Y.S., Lee, O.M., Jung, J.H., Lim, S.K., and Kim, J.G. (2003). Soil-water partition coefficients for cadmium in some Korean soils. Korean J. Soil Sci. Fertil., 36(4), 200-209.
- 38. Persaud, D.J.R.H.A., Jaagumagi, R., and Hayton, A. (1993). Guidelines for the protection and management of aquatic sediment quality in Ontario.
- 39. Schwertmann, U. and Cornell, R.M. (2000). Iron oxides in the laboratory: preparation and characterization. John Wiley & Sons.
- 40. Shine, J.P., Trapp, C.J., and Coull, B.A. (2003). Use of receiver operating characteristic curves to evaluate sediment quality guidelines for metals. Environ. Toxicol. Chem., 22(7), 1642-1648.
-

- 41. Tipping, E. and Hurley, M.A. (1992). A unifying model of cation binding by humic substances. Geochim. Cosmochim. Acta, 56(10), 3627-3641.
-

- 42. Tipping, E. (1993). Modeling the competition between alkaline earth cations and trace metal species for binding by humic substances. Environ. Sci. Technol., 27(3), 520-529.
-

- 43. Tipping, E. (1994). WHAMC—A chemical equilibrium model and computer code for waters, sediments, and soils incorporating a discrete site/electrostatic model of ion-binding by humic substances. Comput. Geosci., 20(6), 973-1023.
-

- 44. Tipping, E., Lofts, S., and Sonke, J.E. (2011). Humic Ion-Binding Model VII: a revised parameterisation of cation-binding by humic substances. Environ. Chem., 8(3), 225-235.
-

- 45. Trivedi, P. and Axe, L. (2001). Ni and Zn sorption to amorphous versus crystalline iron oxides: macroscopic studies. J. Colloid Interface Sci., 244(2), 221-229.
-

- 46. Turner, A., Le Roux, S.M., and Millward, G.E. (2008). Adsorption of cadmium to iron and manganese oxides during estuarine mixing. Mar. Chem., 108(1-2), 77-84.
-

- 47. USEPA (1999). Understanding variation in partition coefficient, Kd, values, Volume II: Review of geochemistry and available Kd values for cadmium, cesium, chromium, lead, plutonium, radon, strontium, thorium, tritium, and uranium. EPA 402-R-99-004B. USEPA, Office of Air and Radiation.
- 48. USEPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates, Second Edition. EPA/600/R-99/064. USEPA, Office of Water.
- 49. USEPA (2005). Procedures for the derivation of equilibrium partitioning sediment benchmarks (ESBs) for the protection of benthic organisms: Metal mixtures (Cadmium, Copper, Lead, Nickel, Silver, and Zinc). EPA-600-R-02-011. USEPA, Office of Research and Development.
- 50. USEPA (2007). Framework for metals risk assessment. EPA 120/R-07/001. USEPA, Office of the Science Advisor.
- 51. USEPA (2016). Aquatic life ambient water quality criteria update for cadmium-2016. EPA 822-F-16-003. USEPA, Office of Water.
- 52. Wang, K. and Xing, B. (2002). Adsorption and desorption of cadmium by goethite pretreated with phosphate. Chemosphere 48, 665-670.
-

- 53. Yin, H., Deng, J., Shao, S., Gao, F., Gao, J., and Fan, C. (2011). Distribution characteristics and toxicity assessment of heavy metals in the sediments of Lake Chaohu, China. Environ. Monit. Assess., 179(1), 431-442.
-

 This Article
This Article
-
2025; 30(6): 73-87
Published on Dec 31, 2025
- 10.7857/JSGE.2025.30.6.073
- Received on Oct 10, 2025
- Revised on Oct 17, 2025
- Accepted on Nov 11, 2025
 Services
Services
Shared
 Correspondence to
Correspondence to
- Kyoungphile Nam
-
Department of Civil & Environmental Engineering, Seoul National University
- E-mail: kpnam@snu.ac.kr





