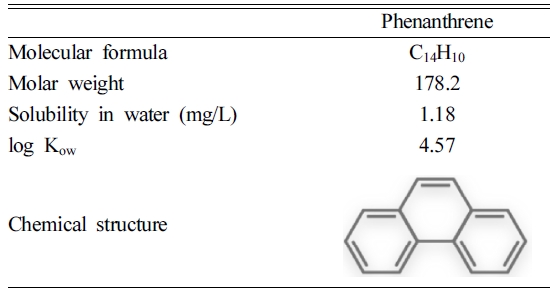
- o-DGT as a Biomimic Surrogate to Assess Phytoaccumulation of Phenanthrene in Contaminated Soils
Jiyeon Choi·Won Sik Shin*
School of Architecture, Civil, Environmental and Energy Engineering, Kyungpook National University, Daegu 41566, Korea
- o-DGT를 생체모사 대표물질로 이용한 오염토양에서 phenanthrene의 식물축적 평가
최지연·신원식*
경북대학교 건설환경에너지공학부
Anthropogenic polycyclic aromatic hydrocarbons (PAHs) are formed by the
incomplete combustion of fuels and industrial waste. PAHs can be widely exposed
to the environment (water, soil and groundwater). PAHs are potentially toxic,
mutagenic and/or carcinogenic. Fundamental studies such as biota uptake (e.g.,
earthworm and plant) of PAHs are highly needed. It is necessary to develop
alternative ways to evaluate bioavailability of PAHs instead of using living
organisms because it is time-consuming, difficult to apply in the field, and
also exaction method is tedious and time-consuming. In this study, sorption
behaviors of phenanthrene were evaluated to predict the fate of PAHs in soils.
Moreover, bioaccumulation of PAHs in an artificially contaminated soil was evaluated
using pea plant (Pisum sativum) as a bioindicator. A novel passive
sampler, organic-diffusive gradient in thin-film (o-DGT) for PAHs was newly
synthesized, tested as a biomimic surrogate and compared with plant
accumulation. Sorption partitioning coefficient (KP) and
sorption capacity (KF) were in the order of natural soil >
loess corresponding to the increase in organic carbon content (foc).
Biota-to-soil accumulation factor (BSAF) and DGT-to-soil accumulation factor
(DSAF) were evaluated. o-DGT uptake was linearly correlated with pea plant
uptake of phenanthrene in contaminated soil (R2=0.863). The Tenax TA
based o-DGT as a biomimic surrogate can be used for the prediction of pea plant
uptake of phenanthrene in contaminated soil.
Keywords: PAHs, o-DGT, Biomimic surrogate, Bioavailability, Plant uptake
다환방향족탄화수소(polycyclic aromatic hydrocarbons, PAHs)는 2개 이상의 벤젠링의 구조를 가지는 방향족
탄화수소를 의미한다. 이는 수계나 토양 또는 공기 중으로 노출되어 환경 전체에 지속적으로 영향을 끼칠 수 있는 오염물질이다. 환경에 노출된
PAHs는 유독성을 띄어 암을 유발할 가능성이 있으며 돌연변이와 기형의 발생률을 높일 수 있다. 또한 PAHs는 소수성을 나타내므로 식물 등의
생물체에 축적되어 간접적으로 인체에도 노출될 수 있다(Lin et al., 2001; Yang and Zhu, 2007; Mei et al., 2009). 미국
EPA에서는 16종의 PAHs(Σ16PAHs)를 우선 대상 물질로 선정하여 관리하고 있다. 이러한 이유로 식물체 내에 PAHs의 이동 및 축적을
연구하는 것은 먹이사슬에 의해 인체 내로 오염물질인 PAHs가 유입될 가능성이 있다는 점에서 매우 중요하다. 국내 위해성평가 지침(Ministry
of Environment, 2018)에서도 평가대상 오염물질로 유류, 중금속류만 해당되었던 것이 그 외에도 인체와 환경에 위해를 줄 우려가 있는
물질까지 포함하여 확대된 바, PAHs의 위해성을 고려하면 오염물질로 포함될 가능성이 있다고 판단된다.
일반적으로 토양 내 유기오염물질의 농도평가를 위해서는 주로 유기용매 추출법을 통하여 이루어지는데 이 경우 용매 종류와 추출시간에 따라
추출량이 달라질 수 있으며, 이 방법을 생물학적 평가방법으로 이용하는 것은 추출과정이 생물과 토양간의 기작을 저해할 수 있기 때문에
바람직하지 못하다. 토양내 오염물질의 총 농도가 아니라 오염물질의 생이용성 및 독성을 기준으로 위해성을 평가하는 것이 적절하며, 토양내 잔류 오염물질의
생이용성은 생물체로의 노출 경로와 생체축적에 직접적인 영향을 미치는 요소이다. 생이용성(bioavailability)에 관한 평가는 오염물질이
생물체에 노출되는 경우를 의미하며, 오염물질이 용액상태로 녹아 있는 경우가 대부분이며 또한 토양 내에 장시간 머무르면서 휘발하거나 분해되어 실제
남아있는 양은 달라질 수 있다(Shin, 2007). 토양 내에 존재하는 농도를 신속 정확하게 측정하는 것은 생이용성의 정확도에 중요한 판단 기준이
될 수 있다. PPCPs(Pharma- ceutical and
Personal Care Products)에 대한 생물 흡수(uptake), 이송(traslocation) 및 축적(accumulation)에 대한 연구가 이루어져 왔으며(Wu et
al., 2013; Dodgen et al., 2015; Al-Farsi et al., 2017), PAHs에 대한 식물 축적 실험이 수행된 바
있다(Nicola et al, 2008; Khan et al., 2008). 생이용성 평가를 위해 실질적으로 생물을 이용하여 토양 내 오염물질의
축적을 평가할 경우 장기간의 실험기간, 비용, 실험 오차 등이 발생할 수 있으며(Liste and Alexander., 2002), 토양의 유기물
및 미네랄과 대상오염물질 간의 화학적 작용, 흡착 등의 작용(Al-Farsi et al., 2017)이 오염물질의 생체 내 거동에 큰 변수로 작용할
수 있다는 점에서 한계가 있다. 보다 신속하고 정확한 PAHs의 생물학적 이용 가능성 평가를 위한 대체방안 확보가 필요하다. 대체방안으로는 화학적
추출법이나 수동형 샘플러(passive sampler)를 이용한 방법이 있다. 토양내 PAHs의 지렁이(Eisenia fetida)를
이용한 축적 결과와 부탄올 추출 농도간의 상관관계를 도출한 연구(Liste and Alexander, 2002), 사이클로덱스트린 추출로 생이용성을
평가한 연구(Cachada et al., 2014) 및 SPE(Solid-Phase Extraction)를 이용한 생이용성 평가 연구(Tang
et al., 1999) 등의 연구사례가 있다. 그러나 수동형 샘플러 중의 하나인 DGT(Diffusive Gradient in
Thin-films)를 이용하여 중금속의 생체축적과의 상관관계를 연구한 사례(Bade et al., 2012)는 있으나 PAHs에 대한 연구는
수행된 바 없다.
본 연구에서는 토양 내 PAHs의 흡착 실험을 수행하여 토양내 거동을 살펴보고, 생이용성을 평가하기 위하여 식물을 이용한 생체축적 실험을
수행하였다. 대상 식물로는 농작물 가운데 재배가 쉽고, 생장 기간이 비교적 짧은 완두콩을 선정하여 PAHs로 인공오염된 토양에서의 생체축적
평가를 수행하였다. 기존에 중금속과 무기물을 위해 주로 사용되었던 DGT를 활용하여 PAHs 농도를 예측하기 위한 유기물 전용 DGT인
o-DGT(organic-Diffusive Gradient in Thin-films)를 새롭게 개발하였으며, 식물을 이용한 생체축적 결과와의
비교를 통해 o-DGT의 생체 모사(biomimic surrogate) 대표물질로서의 적용가능성을 평가하였다.
2.1. 실험재료
본 연구에서 사용된 토양 시료는 경상남도 창녕군에 위치한 야산(35o, 34’, 38.69”N, 128o, 28’, 30.86”E)에서 오염되지 않은 자연토양을 채취하여 사용하였으며, 자연토양의 대조군으로 신원중기로부터
황토를 구입하여 사용하였다. 자연토양과 황토는 3일 동안 풍건시킨 후 표준 2 mm(Sieve #10)로 체거름한 후 플라스틱 밀폐용기에 보관하여
실험에 사용하였다.
인공오염토양은 오염에 필요한 적당량의 phenanthrene (Sigma
Chemical Co., >96% HPLC grade)을 25 mL의 아세톤(Merck,
HPLC grade, >99.8%)에 녹여 자연토양과 황토 1 kg(dry wt.)에 주입한
후 24시간 동안 10 rpm으로 tumbler에서 잘 섞어주고, 16시간 동안 암실에서 아세톤을 휘발시켜서 인공 오염토양을
제조하였다(Brinch et al., 2002).
본 실험에서 오염물질로 PAHs 중 phenanthrene을 대상으로 하였으며, 물리화학적 특성을 Table 1에 나타내었다.
2.2. 실험방법
2.2.1. 토양 분석방법
본 연구에 사용된 토양의 pH는 토양오염공정시험기준(Ministry of Environment, 2018)에 따라 측정하였다. 유기탄소
함량(organic carbon content, foc)은 염산을 이용하여 무기탄소를 제거한 후 원소분석기(LECO,
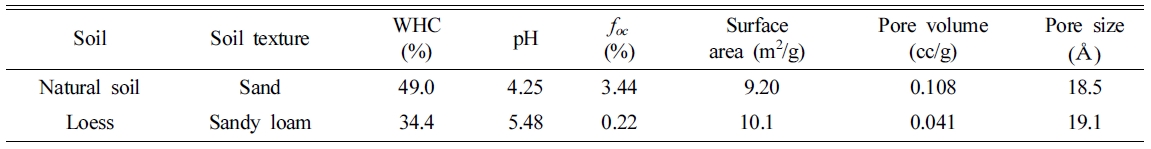
SC-444, USA)를 이용하여 측정하였다(Gomez-Eyles et al., 2011). 각 토양의 비표면적과 기공도는 비표면적 및 기공도
분석기(Autosorb-iQ & Quadrasorb SI, Quantachrome)를 이용하여 분석하였다. 토양내 수분 보유능(WHC,
water holding capacity)은 OECD guidelines(OECD, 2007)에 따라 측정하였다. 사용된 토양시료의 물리화학적
특성은 Table 2에 나타내었다.
토양내 phenanthrene 농도 분석을 위해 USEPA method 3541과 3541a의 pressurized
extraction method에 따라 ASE(Automated Soxhlet Extraction, Dionex-350, Thermo Scientific)을
이용해 추출하였고, 추출한 용매는 실리카겔(silica gel, Sigma-Aldrich, 35-60 mesh)로 정제한 다음
GC-MS(Gas
Chromatograph-Mass Spectrometer, Agilent, 7890A/5975C)를 이용하여 분석하였다.
DB-5MS(Agilent, 30 m × 250 mm i.d., 0.25 mm film
thickness, USA) 컬럼과 MS(Mass Spectrometer, Agilent, 5975C, USA)가 장착된 GC-MS를 사용하였고,
온도 조건은 45oC에서 10oC/min 속도로 170oC까지 상승시켜 10분간 유지,
다시 10oC/min 속도로 200oC까지 상승시켜 8분간 유지, 10oC/min 속도로 240oC까지 상승시켜 15분간 유지,
10oC/min 속도로 300oC까지 상승시켜 10분간 정지시켰다. 시료 주입부와 MS 온도는 각각 300, 310oC이며, carrier
gas는 He을 사용하여 유속은 1.0 mL/min으로 하였다. 공극수 농도는 Liu et
al.(2012)에 따라 토양 시료를 원심분리하여 추출하였으며, 추출용액은 HPLC(High Performance Liquid
Chromatography, Waters, 2695/2487)를 이용하여 분석하였다. HPLC는 자외/가시광선 흡광검출기(UV/VIS
absorbance detector, UVD)를 이용하여 분석하였으며, 컬럼은 LC-PAH(SupelcoTM, 15 cm × 3 mm i.d., 5 mm film
thickness, USA)를 사용하였고, acetonitirile과 초순수를 이용하여 70:30으로 이동상 비율을 조절하였으며, 유량은
0.7 mL/min으로 설정하였다. 컬럼 온도는 30oC로 하고, UVD는 파장
254 nm에서 분석하였다.
2.2.2. 완두콩(Pisum Sativum)을 이용한 식물흡수 실험
PAHs의 식물내 생체축적(bioaccumulation)을 평가하기 위해 완두콩 씨앗을 ㈜다농으로부터 구입하여 사용하였다. 실험에 사용하기 전
24시간 동안 증류수에 담궈 물을 흡수시키고, α-셀룰로오즈 섬유 재질의 여과지 paper (Advantec, 5B, Φ = 70 mm)를 페트리디쉬 크기에
맞게 준비한 뒤 증류수로 filter paper 표면을 적셔 주었다(Zezulka et al., 2014). 페트리디쉬내 여과지 위에 완두콩 씨앗을
올리고 페트리디쉬를 알루미늄 호일로 싸서 인공적인 암기 상태를 만들어준 뒤 항온항습실에서 3일 동안 발아시켰다. 항온항습실은 온도 25oC, 습도 35%, 조도는
광합성이 최대로 일어나는 빛의 세기인 광보상점에 맞추어 약 4,110~5,580 LUX로 유지하고, 발아한
완두콩은 수분보유능을 60%로 조절한 비오염 자연토양에 심어 3주간 생장시켰다. 생장시키는 동안 무게를 측정하여 감소한 무게만큼 수분을 보충하여
수분보유능을 유지하였다(Mundus et al., 2012; Ni et al., 2014). 최종적으로 3주간 생장시킨 완두콩들 가운데 잎, 줄기,
뿌리가 구분되는 식물을 생체흡수 실험에 사용하였다.
시간에 따른 식물흡수 실험은 150 mg/kg으로 오염시킨 토양을
250 mL 비커에 185 g 씩 넣고, 생장된 완두콩을
옮겨 심은 후 1주일 간격으로 6주간 각각 3개씩의 완두콩을 채취하여 증류수로 뿌리에 붙은 토양 입자를 제거하고, 뿌리, 줄기, 잎으로 분리한
다음 1~2 cm 정도의 크기로 잘라서 분석에 사용하였다. 농도별 흡수 실험은 20, 50, 80,
100, 150 mg/kg인 오염토양을 대상으로 4주간 수행하였으며, 실험조건은 kinetic 실험과 동일하며,
4회 반복 실험을 수행하였다. Control 실험으로는 식물이 없는 토양 시료를 준비하였다.
작은 입자로 자른 식물은 동결건조기(FDU-2100, Eyela)로 48시간 동안 동결건조시킨 후, tissue homo- genizer(Ultra
Turrax Disperser, IKA, T10 Basic)를 이용하여 균질화하고, 600 mm 체(Sieve # 30)로
체거름하여 1:1(v:v) 아세톤:헥산 혼합용액 10 mL를 넣어 초음파세척기(Branson 8510, USA)로 1시간 동안 추출하였다(Gao
and Zhu, 2004). 추출용액은 최종 용매인 dichlo- romethane(Merck, GC grade, 99.8%) 3 mL로 농축하였고,
Florisil SPE(1 g/6 mL, Agilent
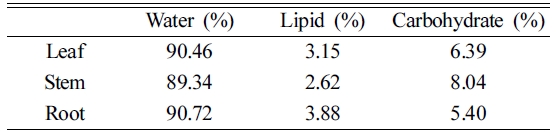
Technologies, USA)로 정제(Tao et al., 2008)한 다음 GC-MS로 분석하였다. 식물내 수분함량, 지질함량 및 탄수화물
함량을 측정하였다. 수분 함량은 105oC에서 24시간 동안 건조하여 건조 전후의 무게차를 이용하여 측정하였으며, 지질함량(lipid
content)은 아세톤:헥산 혼합용액(1:1, v:v%)을 건조된 식물에 넣고 1시간 동안 초음파 세척기를 이용하여 추출한 후 추출용액을
24시간 동안 휘발시켜 휘발 전후의 무게차를 이용하여 측정하였다(Simonich and Hites, 1994). 식물내 수분함량과 지질함량을 제외한
부분은 탄수화물 함량(carbohydrate)으로 정의하였다(Li et al., 2005). 본 연구에서 사용한
완두콩내 수분, 지질, 탄수화물 함량은 다음 Table 3에 나타내었다.
2.2.3. o-DGT(organic-Diffusive
Gradients in Thin-film)를 이용한 흡수 실험
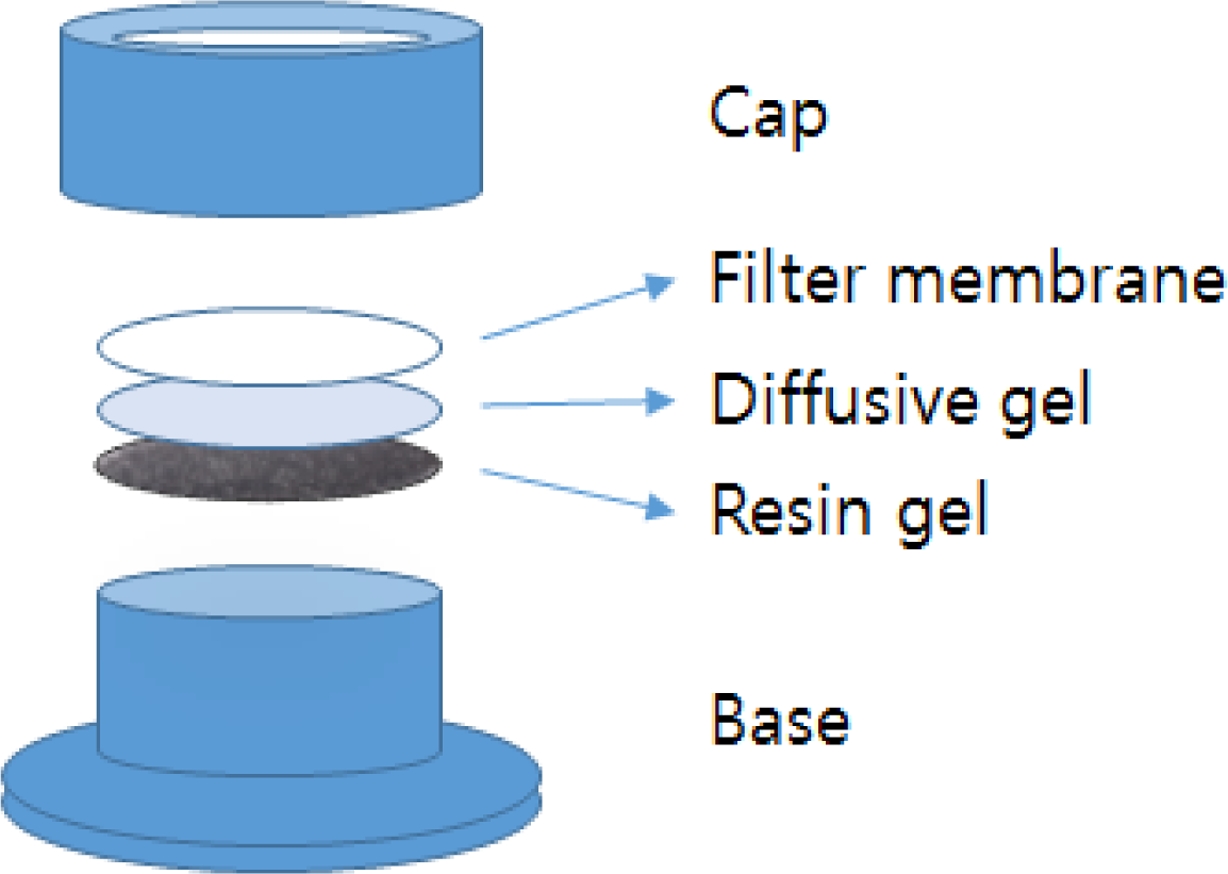
본 실험에서 사용된 DGT는 DGT Research(www. dgtresearch.com, Lancaster,
UK) 사에서 테플론 재질의 DGT® device를 구입하여
사용하였다. Base 부분 위에 본 실험실에서 제조한 Tenax® TA로 만든 레진젤을 올린 후 agarose diffusion gel(확산젤),
PTFE(polytetrafluoreethy- lene) 필터(Φ = 2.5 mm, 0.45 mm, Chmlab
group, Spain) 순서로 올리고 Cap을 덮어 o-DGT를 고정시켜 준비하였다(Fig. 1 참조).
레진젤을 합성하기 위하여 20 mL의 1.5% 아가로스(Agarose,
Sigma-Aldrich) 젤 용액을 비커에 넣고 80oC로 가열하며 끓이면서 투명해지면 0.1 g의 Tenax® TA (60-80 mesh, Alltech)를 첨가하여 균질한 혼합 용액을 만들었다. 상온에서 틀에 부어 레진젤의
두께가 0.075 cm가 되도록 제조하였다. 확산젤은 Tenax® TA를 포함하지 않은 1.5% 아가로스 젤 용액을 두께가
0.05 cm가 되도록 제조하였다(Zhang and Davison, 1995).
o-DGT의 레진젤내 흡수된 PAHs 추출은 Cui et al. (2010)에 따라 수행하였으며,
추출용매 9 mL를 10 mL의 Ultima
Gold scintillation cocktail(Perkin Elmer, USA)와 혼합하여 liquid scintillation
counter(LSC, 2910TR, QuantaSmartTM, Perkin-Elmer)로 분석하였다.
2.2.4. Phenanthrene 흡착 실험
모든 흡착실험은 테프론 재질의 실리콘 septa가 부착된 40 mL 암갈색 바이알(Fisher
Scientific)을 이용하여 회분식으로 수행하였다. 흡착 실험에는 선행실험 결과에 근거하여 자연토양은 0.1 g, 황토는 6.0 g으로 각각 설정하여 사용하였다.
흡착 등온 실험에 사용된 용액의 초기 농도는 phenanthrene의 용해도를 고려하여 1.0 mg/L까지 제조하였으며,
용액은 전해질로 1 mM 염화칼슘(Calcium Chloride, CaCl2, Yakuri
Chemical)과 0.5 mM 염화마그네슘(Magnesium Chloride, MgCl2,
Duksan, 98-100%), 미생물 생장억제제로 200 ppm의 아지드화나트륨(Sodium
Azide, NaN3, Daejung, 98%)를 첨가하여 제조하였으며 LSC 분석을 위해 각 농도별로 제조한 용액의
radioac- tivity가 2,000 cpm/mL가 되도록 14C-tracer(14C-phenan- threne, 1.0 mCi/mL,
Sigma-Aldrich)를 추가하였다. 또한 휘발에 의한 손실을 최소화하기 위해 흡착제가 들어있는 암갈색 바이알에 headspacee가 최소화되도록
흡착 용액을 채운 다음 상온(약 25oC)에서 텀블러를 이용하여 흡착시켰다. 흡착 후 1,500 rpm에서 15 분간 원심분리한
다음, 상등액 1 mL를 분취해 8 mL의
scintillation cocktail (Ecolite+, MP Biochemicals,
LLC)이 들어있는 20 mL scintillation vial(Wheaton)에 넣고 LSC를 이용하여 용질의 흡착후
평형농도를 측정하였다.
등온흡착 실험 결과는 Linear, Freundlich 모델을 사용하여 곡선맞춤(curve-fitting)하였다. Linear 모델은
다음의 식 (1)과 같이 표현된다.
q = KPC (1)
여기서 q(mg/kg)과 C(mg/L)는 고체상의 평형농도, 액체상의
평형농도를 각각 나타내며, Kp(L/kg)는 분배 상수(partitioning coefficient)이다.
Freundlich 모델은 다음의 식 (2)와 같이 표현된다.
q = KFCN (2)
여기서 KF((mg/kg)/(mg/L)N)는 Freundlich 모델
상수로 어떤 특정한 수용액상의 용질의 농도에서 고체상의 흡착능을 나타내고, 지수 N(-)은 흡착 과정에서 에너지의 크기와 불균일성을
나타낸다. 각 흡착모델의 매개변수는 Table Cruve 2D®(Version 5.1, SYSTAT, Inc.)를 사용하여 결정하였다.
뿌리 흡착 시험(Zhang and Zhu, 2009)은 동결건조한 식물의 뿌리를 tissue homogenizer를 이용하여 균질화하고,
600 mm 체로 체거름하여 40 mL 암갈색 바이알에 각각
20.0 mg을 넣어 흡착용액을 채운 다음 토양 흡착실험과 동일한 조건으로 흡착실험을 진행하였으며,
LSC를 이용하여 식물뿌리에 흡착된 용질의 평형농도를 측정하였다.
|
Fig. 1 Schematic structure of the DGT assembly. |
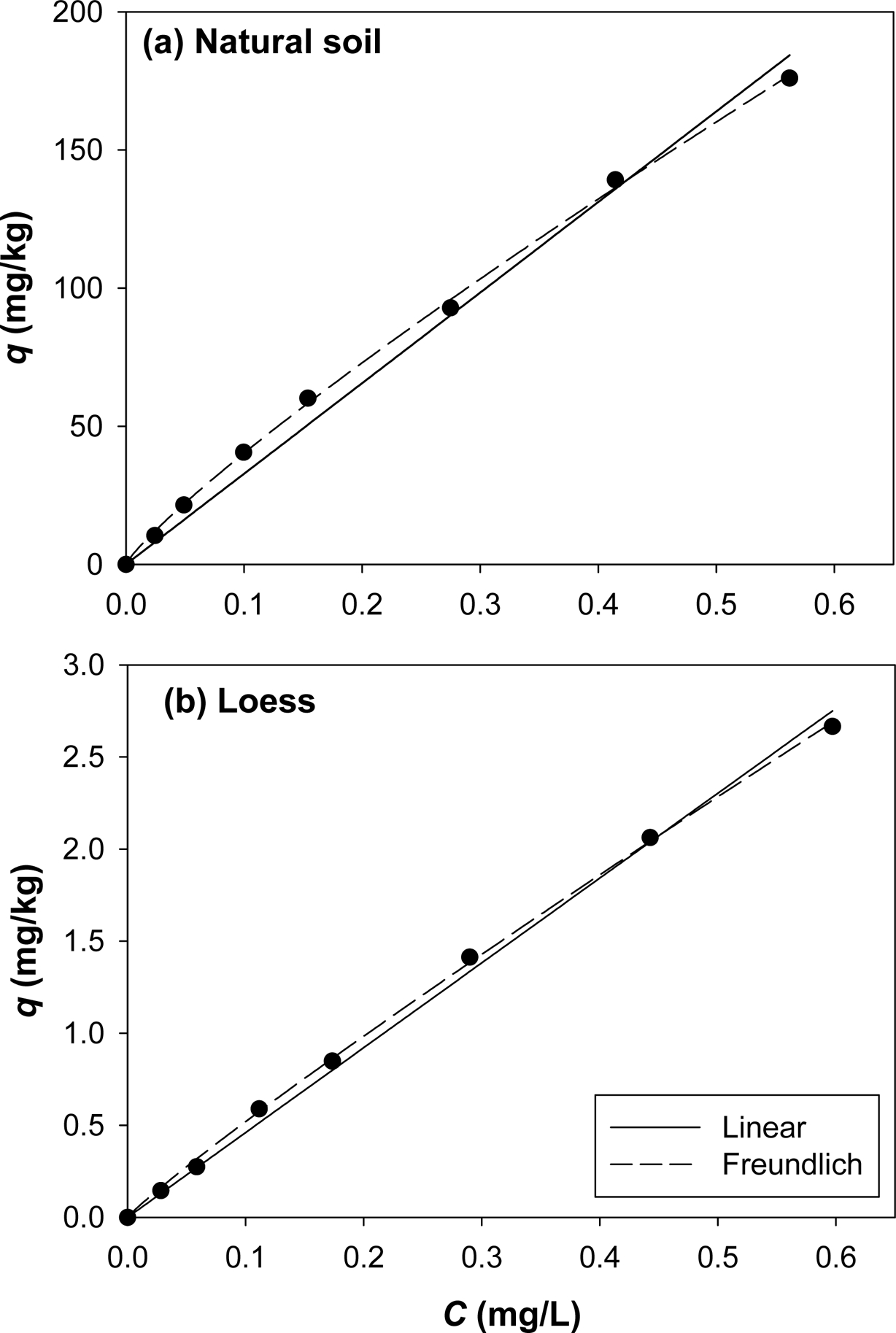
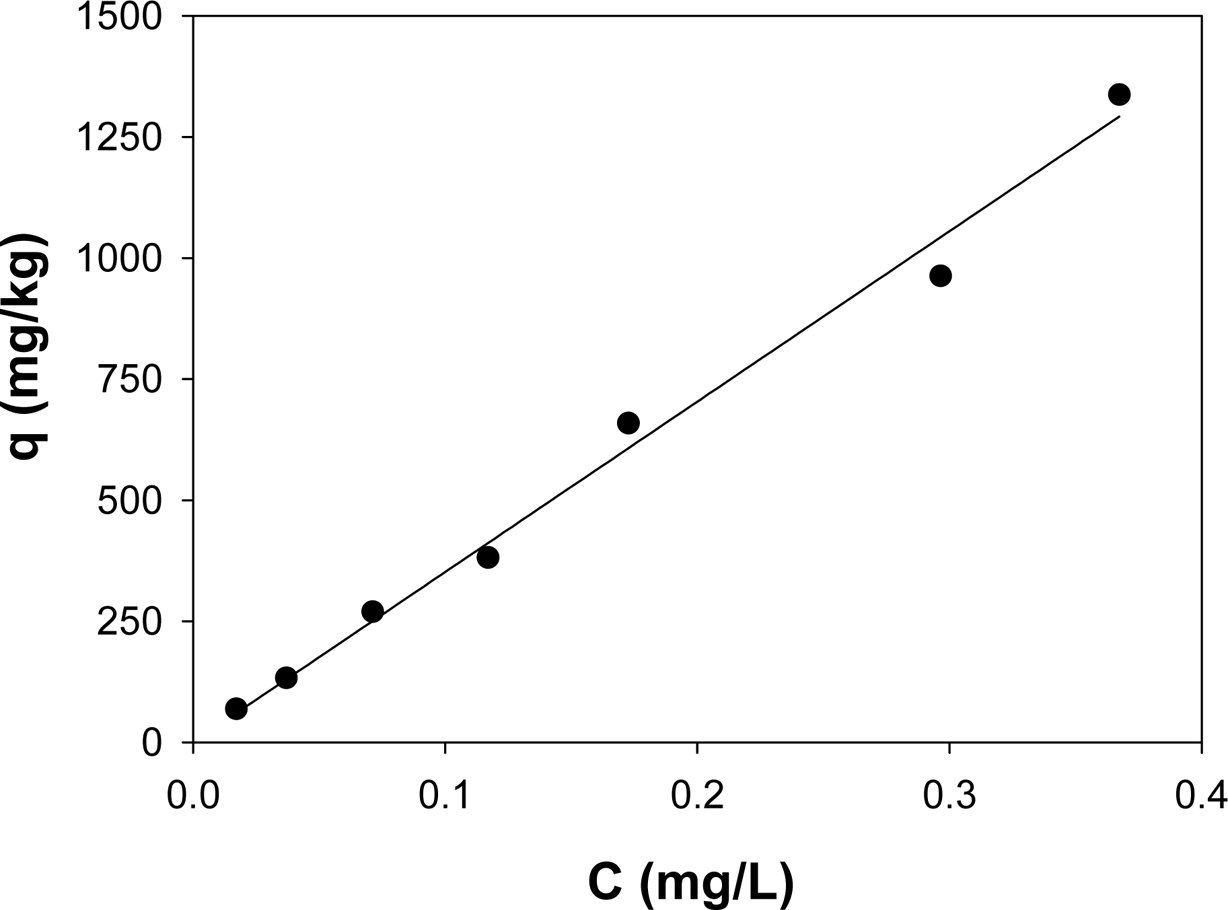
3.1. 흡착 실험 결과
식물과 o-DGT 흡수 실험을 위한 인공 오염토양내 phenanthrene의 농도를 결정하기 위하여 phenanthrene 흡착 실험을
수행하였다. 용해도가 매우 낮은 소수성 유기화합물(hydrophobic organic compounds, HOCs)의 흡착 등온선은 일반적으로
선형으로 나타난다. 본 연구에서도 Fig. 2에 나타낸 바와 같이 용해도가 매우 낮은 phe- nanthrene의 흡착등온선은
선형으로 나타났다.
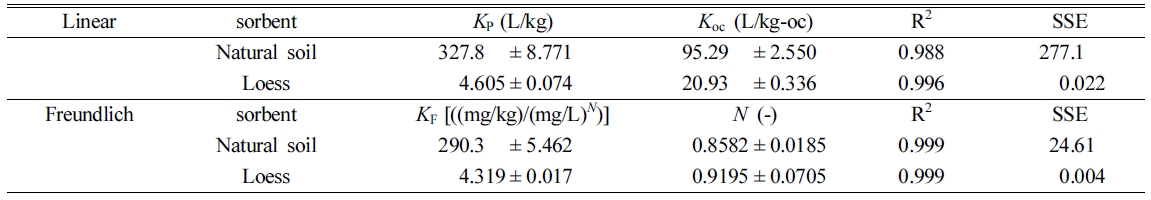
곡선맞춤으로부터 얻은 모델 변수는 Table 4에 나타내었으며, R2 값으로부터 알 수 있듯이 linear(R2 > 0.99)와
Freundlich(R2 > 0.99) 모델 모두 잘
맞았다. 선형모델의 곡선맞춤 결과 KP 값을 보면, 자연토양의 경우 327.8 L/kg, 황토의 경우
4.605 L/kg으로 나타났으며, Freundlich 모델의 KF 값과도
유사한 경향을 나타내는 것으로 나타나 자연토양의 흡착친화도가 황토의 흡착 친화도보다 더 뛰어난 것을 알 수 있다. Freundlich 모델의 N
값은 N ![]() 1로 나타나 선형 수착(linear
sorption)에 가까운 것으로 나타났으며, 용질의 분배 현상이 일어나는 것을 알 수 있다(Sparks, 2003). Koc
값을 비교해보면 자연토양(95.29 L/kg-oc) > 황토(20.93 L/kg-oc) 순으로 나타났으며,
이는 유기탄소 함량이 증가하는 순서와 일치하였다. 유기탄소가 많을수록 흡착량이 증가하는 것은 Wu 등(2014)의 연구결과에서도 볼 수 있으며,
자연토양의 흡착능이 황토보다 더 뛰어난 것을 알 수 있다.
1로 나타나 선형 수착(linear
sorption)에 가까운 것으로 나타났으며, 용질의 분배 현상이 일어나는 것을 알 수 있다(Sparks, 2003). Koc
값을 비교해보면 자연토양(95.29 L/kg-oc) > 황토(20.93 L/kg-oc) 순으로 나타났으며,
이는 유기탄소 함량이 증가하는 순서와 일치하였다. 유기탄소가 많을수록 흡착량이 증가하는 것은 Wu 등(2014)의 연구결과에서도 볼 수 있으며,
자연토양의 흡착능이 황토보다 더 뛰어난 것을 알 수 있다.
식물 뿌리 흡착 실험 결과는 Fig. 3에 나타내었으며, 식물 뿌리 내 phenanthrene의 분배계수, Kr(L/kg)는
뿌리에 흡착된 양(mg/kg)과 평형상태에서의 용액내 phenan- threne 농도(mg/L)의 비로 구할 수 있다. Kr
값은 3,517 L/kg으로 나타났다.
3.2. 식물 흡수 평가 결과
흡착 실험 결과 황토의 phenanthrene 흡착량이 너무 낮아 식물 흡수 실험에 충분하지 않으므로 식물 흡수 평가 실험은 자연토양에
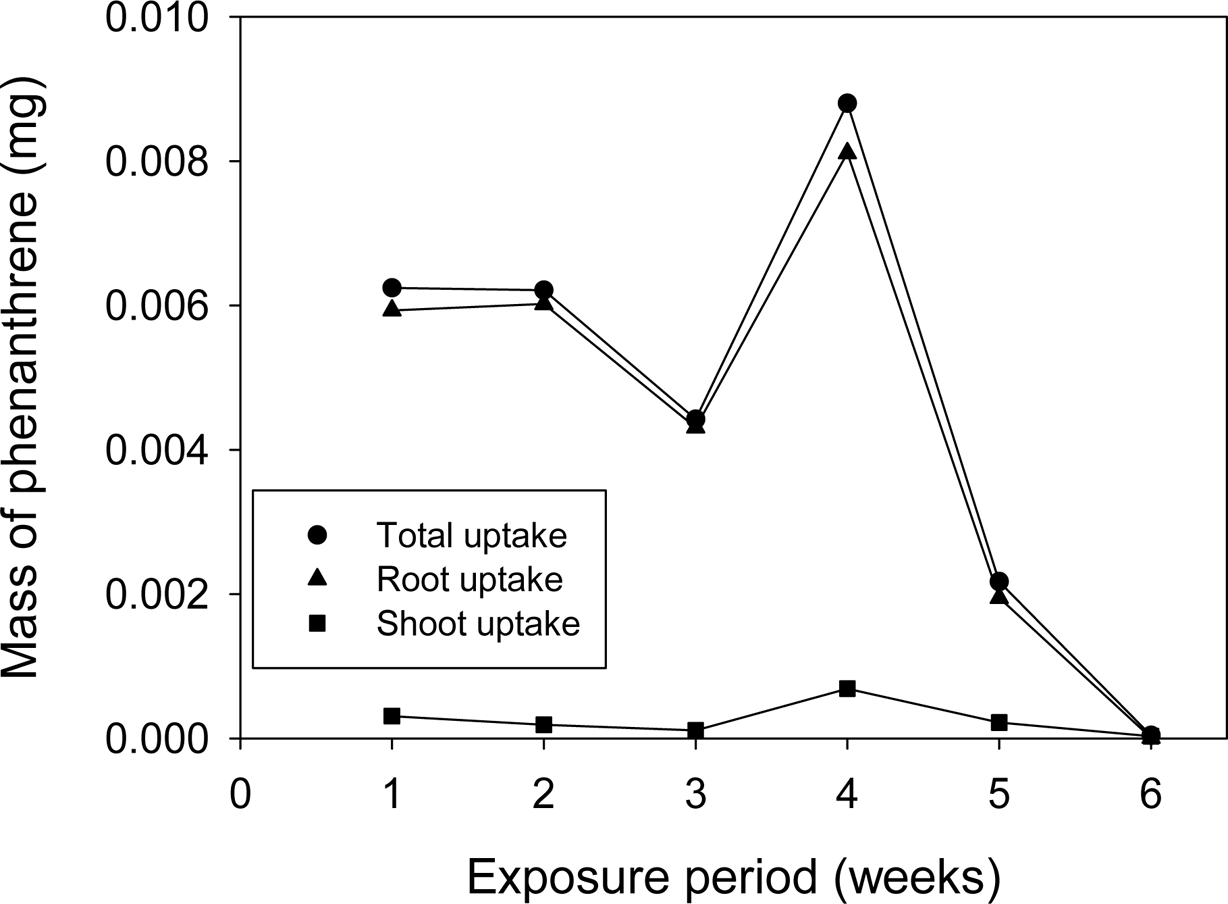
대하여 수행하였다. Phenanthrene 오염농도가 150 mg/kg인 자연토양에서
노출 시간별 식물 부위별(뿌리, 줄기+잎)로 흡수 농도를 비교하였으며, 그 결과를 Fig. 4에 나타내었다. 대부분의 식물 흡수는 뿌리 쪽에서
일어나는 것을 알 수 있으며, 줄기와 잎으로의 이동은 적다는 것을 확인할 수 있었다. 시간이 지남에 따라 식물에 흡수되는
phenanthrene의 양은 감소하였으며, 4주차일 때 식물흡수량이 최대가 되며, 이후 감소하였다. 이러한 실험결과를 반영하여 오염 농도별 식물
흡수 실험은 4주로 고정시켜 수행하였다.
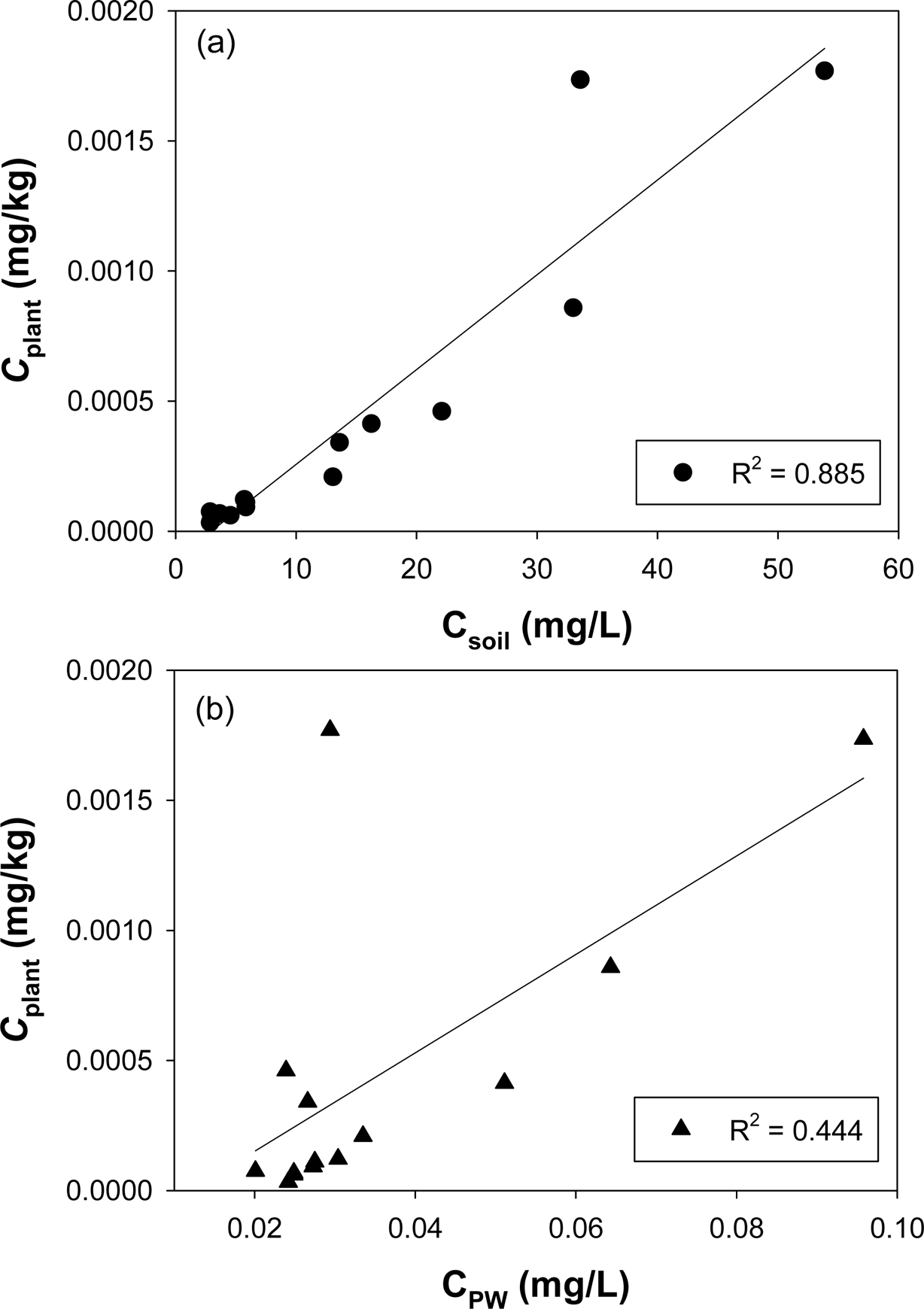
Phenanthrene으로 오염된 자연토양 공극수내 phenan- threne 농도 및 식물 흡수 농도를 측정한 결과를
Fig. 5에 나타내었다. Fig. 5(a)에서 볼 수 있듯이 자연토양의 오염농도가 높은 토양에서 식물 흡수 농도가 더 높게 측정됨을 알 수 있었다.
이는 공극수 내 phenanthrene의 농도는 식물 흡수 농도와도 관련이 있는 것으로 설명할 수 있는데 Fig. 5(b)를 보면 공극수내 농도가
높을수록 식물 흡수 농도가 높게 나타나 이를 뒷받침한다. 식물은 뿌리를 통하여 영양물질을 흡수하는데 토양내에서는 공극수가 뿌리와 직접 접촉하여
식물로 이동한다. 이처럼 공극수내 오염물질의 농도는 식물이 이용가능한 농도와 매우 밀접한 연관이 있다(Su and Zhu, 2008).
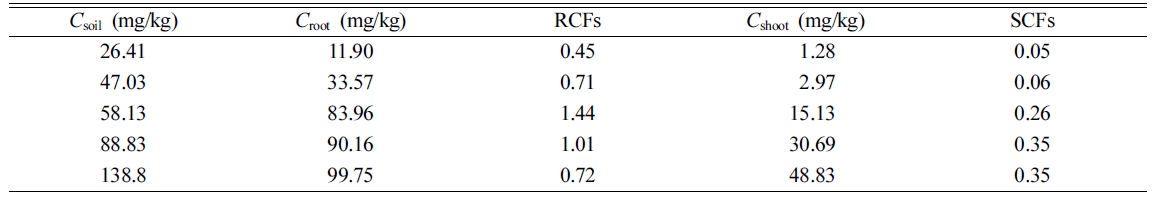
뿌리내 축적은 뿌리 농도 인자(root concentration factor, RCF = Croot/Csoil)로
나타낼 수 있으며, 줄기와 잎의 축적은 shoot 농도 인자(shoot concentration factor, SCF = Cshoot/Csoil)로
나타낼 수 있고, 그 결과를 Table 5에 나타내었다. 뿌리 축적 농도(Croot) 및 shoot 축적 농도(Cshoot)를
보면 오염 토양 농도가 증가할수록 식물 축적 농도도 증가하며, RCF가 SCF보다 높게 나타나 뿌리내 축적 농도가 shoot 축적
농도보다는 높은 것을 알 수 있다.
생물체-토양 축적계수(Biota-to-soil accumulation factor, BSAF)는 정상상태(steady state)에
도달했을 때의 생체(본 연구에서는 식물을 의미) 내 오염물질의 농도와 토양내 오염물질의 농도 비를 의미한다(Markwell et al.,
1989; Connell and Markwell, 1990). 이는 토양내 오염물질이 식물로 축적되는 오염물질의 비율을 나타내는 생태학적 위해성
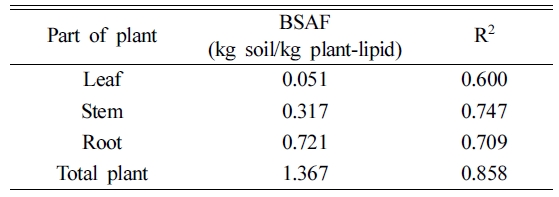
평가를 위한 중요한 변수이다. BSAF(kg soil/kg plant-lipid)는 아래 식 (3)을 이용하여 계산할 수 있다(Bade et al., 2012).
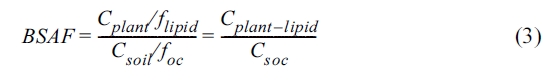
여기서 Cplant는 식물 부위(뿌리, 줄기, 잎)내 오염물질의 농도(mg/kg), Csoil는
토양내 오염물질의 농도(mg/kg), flipid는 식물의 지질 함량, foc는
토양의 유기탄소 함량, Cplant-lipid는 식물의 지질 함량에 기반한 식물내 오염물질의 농도(mg/kg),
Csoc는 유기탄소 함량에 기반한 토양내 오염물질의 농도(mg/kg)을 나타낸다. BSAF는 4주간 식물흡수 실험을
진행한 후 Cplant-lipid와 Csoc 간의 상관관계 기울기 값을 이용하여
계산하였고, 그 결과는 다음 Table 6에 나타내었다. BSAF 값은 뿌리 > 줄기 > 잎의 순으로 나타나 토양에
직접적으로 노출되는 뿌리의 경우 토양으로부터 식물체의 축적 농도가 높으나 토양에서 멀어질수록 생체 축적 농도가 감소하는 것을 확인하였다. 이 결과는
Fig. 4의 시간에 따른 식물 부위별 흡수 평가 결과에서 뿌리에서 가장 많은 phenanthrene 농도가 검출되고, 나머지 부위에서 거의 검출되지
않은 결과와도 일치한다.
3.3. o-DGT 흡수 실험 결과
본 연구에서 제조한 Tenax® TA resin gel을 적용하기에 앞서 phenanthrene의 확산계수(diffusion
coefficient)를 측정하였다. Resin gel에서 추출한 phenanthrene의 질량(Mass, mg)은 아래 식
(4)에 의해 계산하였다.
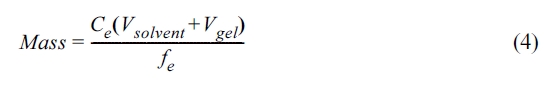
여기서 Ce는 o-DGT로부터 오염물질을 추출하는 용매 내 phenanthrene의 농도(mg/L),
Vsolvent는 추출 용매의 부피(mL), Vgel은 resin gel의 부피(= 표면적 × 두께 = 0.368 mL), fe는
elution factor로서 일반적인 값인 0.8을 사용하였다.
확산계수(D, cm2/s)는 아래 식 (5)를
이용하여 계산하였다(Davison and Zhang, 2012).

여기서 Dg는 확산층의 총 두께로 레진젤(0.075 cm), binding
gel(0.05 cm)과 PTFE filter(0.01 cm)의 두께를 모두 합한
0.135 cm이며, t는 o-DGT와 반응시킨 반응시간(s), CDGT는
DGT 경계면에서의 용액농도(mg/L), A는 DGT 노출 면적(3.14 cm2)을 의미한다. 시간(t)과 레진젤에 흡수된
phenanthrene의 양(mass, mg)간의 상관관계 기울기 값을 이용하여 Mass/t를 구하고, 확산계수(D)를 계산하였으며,
그 값은 2.389 × 10-6 cm2/s으로
나타났다.
Bade et al.(2012)은 BSAF와 같이 지렁이(Eisenia foetida)를 생체(biota)로 이용하여 중금속
오염 토양 내 생이용가능 농도를 평가하는 방법에 착안하여 DGT를 이용하여 생이용가능 농도를 평가하고 DGT-토양 축적계수(DGT-to-soil
accumulation factor, DSAF)를 도출함으로써 biomimic surrogate로서의 DGT의 적용가능성을 평가하였다. 본 연구에서는
중금속에 대한 BSAF와 DSAF를 도출하여 DGT 적용 가능성을 확인한 선행연구결과에 착안하여 PAH의 식물 및 o-DGT uptake 실험에
적용하여 식물을 이용하여 도출한 BSAF와 o-DGT를 이용하여 도출한 DSAF간의 상관관계를 도출하고자 하였다. PAHs 오염 토양에서의 식물에
대한 생체축적과의 상관관계를 도출함으로써 유기오염물질에 적용가능한 o-DGT를 이용한 신속한 간접 평가의 적용가능성을 확인할 수 있다.
DSAF는 DGT-토양 축적계수(kg soil/cm2 resin)는 정상상태(steady-state)에 도달했을 때의
o-DGT내 오염물질의 농도와 토양내 오염물질의 농도 비를 의미하며 식 (6)으로 나타낼 수 있다(Bade et al., 2012).
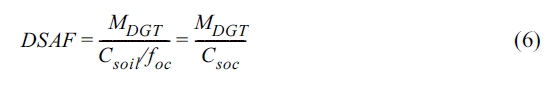
여기서 MDGT는 o-DGT의 레진젤내 phenanthrene 질량(mg/cm2)이다.
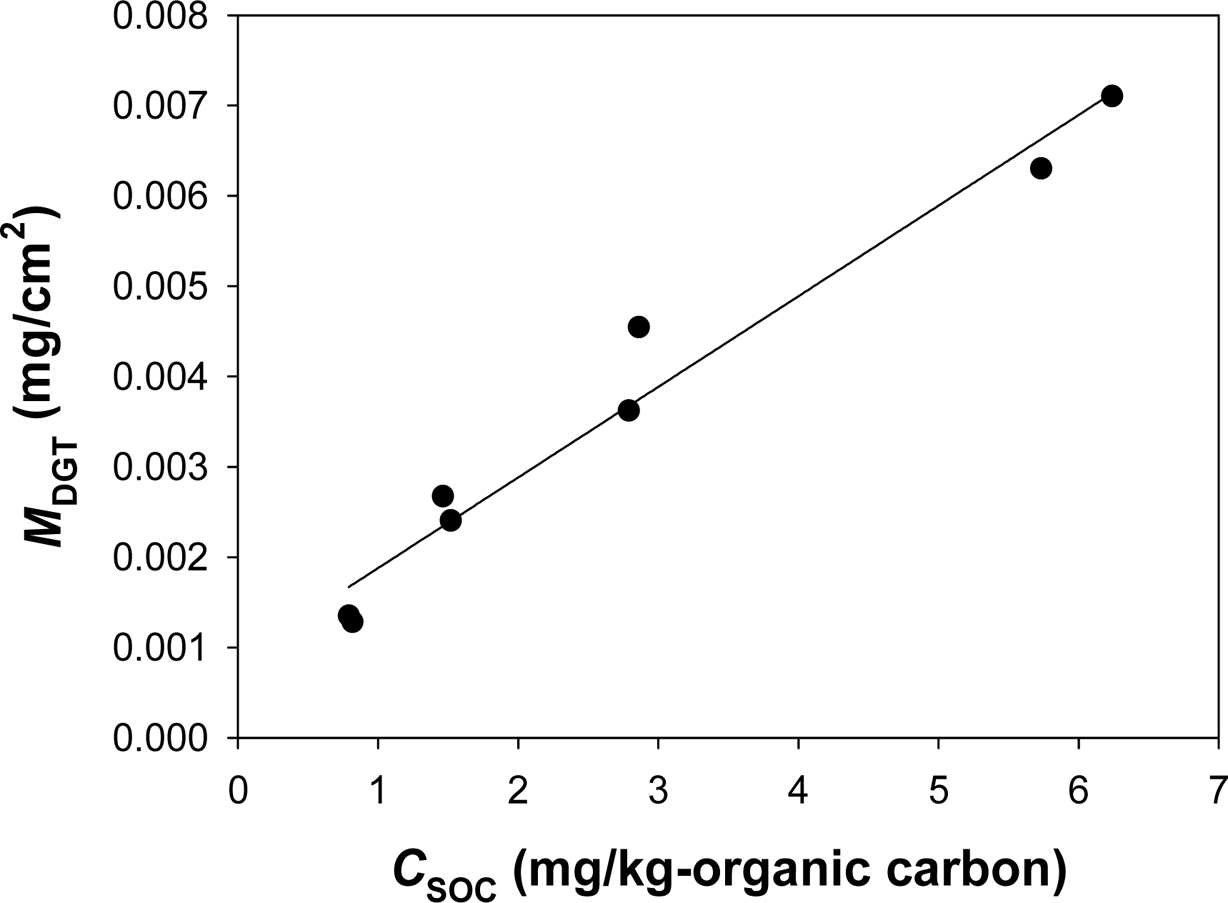
유기오염물질을 흡수할 수 있는 Tenax® TA 기반 레진젤을 적용한 o-DGT로서 phenanthrene의 생이용성 평가하기 위하여 토양내
phenanthrene을 o-DGT 축적 실험을 수행한 결과를 바탕으로 DSAF를 도출하였다. Fig. 6의 기울기로부터 DSAF를 계산하였으며,
DSAF 값은 1.21 × 10-6 kg soil/cm2
resin이었다.
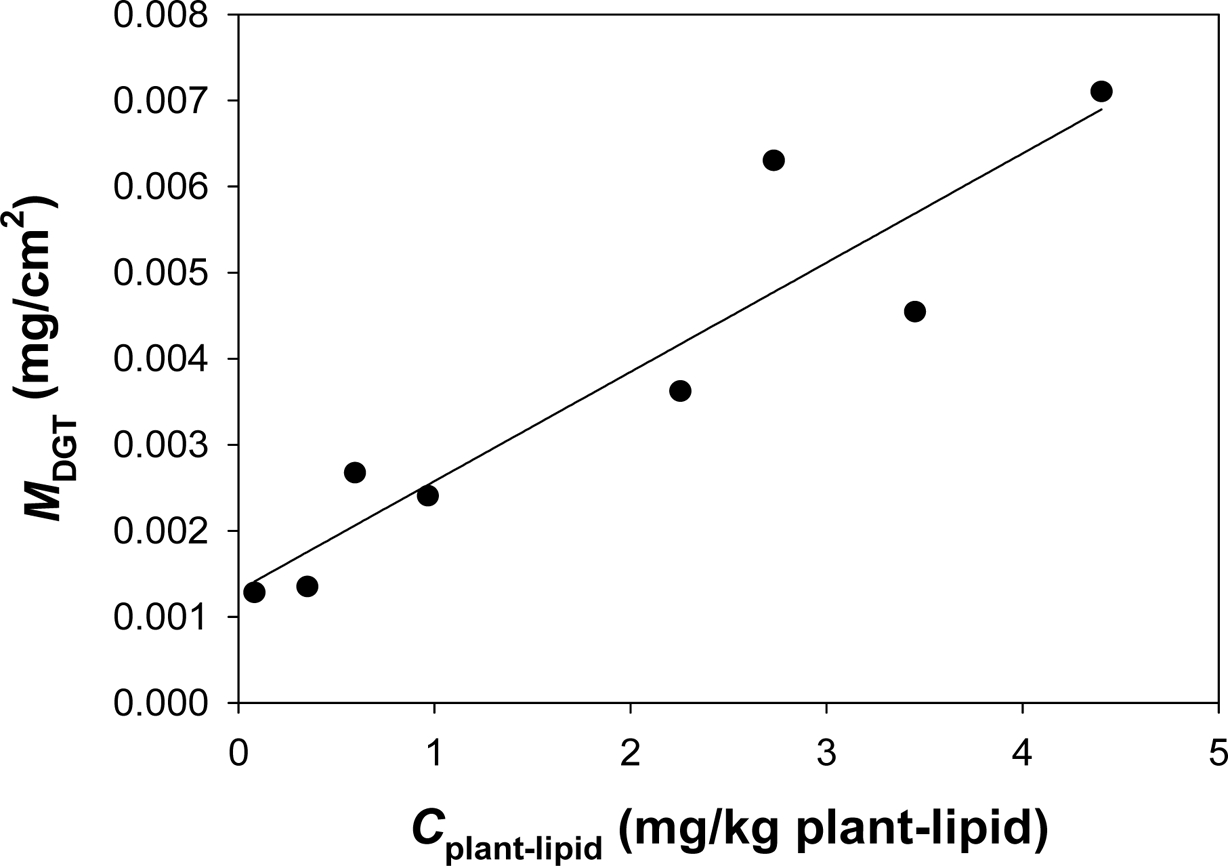
식물체내 phenanthrene의 식물 흡수 농도와 o-DGT 흡수 농도(MDGT)를 비교하였다(Fig. 7).
DGT 추출 농도와 식물흡수 상관관계 결과를 보면, 식물 흡수 농도와 o-DGT 흡수 농도가 선형의 상관관계(R2 = 0.863)를 가지는 것을
알 수 있다. Paulik 등(2016)은 수계 내에서 민물 가재(Crayfish)를 이용한 PAHs 축적 농도와 Low
Density polyethylene (LDPE)를 수동형 샘플러로 이용한 축적 농도를 분석
및 비교하여 상관관계를 연구하여 LDPE에 축적된 농도와 PAHs 농도간에 선형의 상관관계식을 보고한 바 있다. 또한, 수계내 OASIS® HLB를 담지한 레진젤을
활용한 o-DGT로 nitrochlorobenzene의 농도를 측정하여 DGT를 이용한 측정방법이 신속하고 효율적임을 확인한 연구 사례도 있다(Zhang
et al., 2019). 이러한 기존의 레진젤과는 달리 본 연구에서 새롭게 개발한 Tenax® TA 기반 레진젤을 이용한
o-DGT를 biomimic surrogate로 사용하여 phenanthrene으로 오염된 토양의 생이용성 농도를 신속하게 측정하는데 적용가능함을
확인하였다.
|
Fig. 2 Sorption isotherm of phenanthrene onto the (a) natural soil and (b) Loess. |
|
Fig. 3 Root sorption of phenanthrene. |
|
Fig. 4 Pisum Sativum uptake of phenanthrene from contaminated natural soil over time. |
|
Fig. 5 Correlation between (a) plant uptake concentration (Cplant) and soil concentration (Csoil) and (b) plant uptake concentration (Cplant) and pore water concentration (Cpw) in phenanthrene contaminated natural soil. |
|
Fig. 6 Correlation between MDGT and CSOC in phenanthrene contaminated soil. |
|
Fig. 7 Correlation between plant uptake (Cplant-lipid) and MDGT in phenanthrene contaminated soil. |
|
Table 4 Sorption isotherm model parameters for sorption of phenanthrene onto the sorbents |
|
Table 5 Root concentration (Croot), root concentration factor (RCFs), shoot concentration (Cshoot) and shoot concentration factor (SCFs) values of Pisum Sativum uptake of phenanthrene in contaminated natural soil after 4 weeks |
|
Table 6 BSAF of plant parts in phenanthrene contaminated natural soil after 4 weeks of exposure |
본 연구에서는
phenanthrene으로 오염된 토양의 식물(완두콩, Pisum
Sativum)과 Tenax® TA 기반 o-DGT 흡수 실험결과의 상관관계를 비교하여 o-DGT의 생체모사(biomimic
surrogate) 대표물질로서의 적용 가능성을 평가하였다.
1) 자연토양과 황토를 이용한 phenanthrene 흡착 실험 결과를 linear 모델과 Freundlich 모델로 곡선 맞춤한 결과
R2 > 0.98 이상으로 잘 맞는
것으로 나타났다. 토양별 분배계수(KP) 및 흡착능(KF)을 비교해보면 자연토양 > 황토 순으로 증가하는 것으로
나타났으며, 이는 토양의 유기탄소 함량(foc)의 증가 순과 일치하였다.
2) Phenanthrene으로 오염된 자연토양에서의 오염농도가 높을수록 식물 흡수 농도는 높아지는 것으로 나타났다. 공극수내 농도가 높을수록
식물 체내 흡수 농도가 더 높게 나타났으며, 상관관계가 있는 것으로 나타나 식물은 공극수로부터 오염물질을 흡수하는 것을 확인하였다.
3) BSAF와 DSAF 값은 각각 1.367 kg soil/kg
plant와 1.21 × 10-6 kg soil/cm2
resin으로 나타났으며, o-DGT 레진젤내 축적 농도(MDGT)와 식물흡수농도(Cplant-lipid)의
상관관계는 선형의 비례관계(R2 = 0.863)를 보여 본 연구에서
새롭게 개발한 Tenax® TA 기반 레진젤을 적용한
o-DGT의 생체모사(biomimic surrogate) 대표물질로서의 적용가능성을 확인하였다.
본 결과물은 환경부의 재원으로 한국환경산업기술원의 화학사고 대응 환경기술개발사업의 지원을 받아 연구되었습니다(2019001960002).
- 1. Al-Farsi, R.S., Ahmed, M., Al-busaidi, A., and Choudri, B.S., 2017, Translocation of pharmaceuticals and personal care products (PPCPs) into plant tissues: A review, Emerg. Contam., 3, 132-137.
-

- 2. Bade, R., Oh, S., and Shin, W.S., 2012, Diffusive gradients in thin films (DGT) for the prediction of bioavailability of heavy metals in contaminated soils to earthworm (Eisenia foetida) and oral bioavailable concentrations, Sci. Total Environ., 416, 127-136.
-

- 3. Brinch, U.C., Ekelund, F., and Jacobsen, C.S., 2002, Method for spiking soil samples with organic compounds (PAHs), Appl. Environ. Microbiol., 68, 1808-1816.
-

- 4. Cachada, A., Pereira, R., Silva, E.F., and Duarte, A.C., 2014, The prediction of PAHs bioavailability in soils using chemical methods: State of the art and future challenges, Sci. Total Environ., 472, 463-480.
-

- 5. Connell, D.W. and Markwell, R.D., 1990, Bioaccumulation in the soils to earthworm system, Chemosphere, 20, 91-100.
-

- 6. Cui, X., Hunter, W., Yang, Y., Chen, Y., and Gan, J., 2010, Bioavailability of sorbed phenanthrerne and permethrin in sediments to chronomus tentans, Auqt. Toxicol., 98, 83-90.
-

- 7. Davison, W. and Zhang, H., 2012, Progress in understanding the use of diffusive gradients in thin films (DGT) - back to basics, Environ. Chem., 9, 1-13.
-

- 8. Dodgen, L.K., Ueda, A., Wu, X., Parker, D.R., and Gan, J., 2015, Effect of transpiration on plant accumulation and translocation of PPCP/EDCs, Environ. Pollut., 198, 144-153.
-

- 9. Gao, Y. and Zhu, L., 2004, Plant uptake, accumulation and translocation of phenanthrene and pyrene in soils, Chemosphere, 55, 1169-1178.
-

- 10. Gomez-Eyles, J.L., Jonker, M.T.O., Hodson, M.E., and Collins, C.D., 2011, Passive samplers provide a better prediction of PAH bioaccumulation in earthworms and plant roots than exhaustive, mild solvent, and cyclodextrin extractions, Environ. Sci. Technol., 46, 962-969.
-

- 11. Khan, S., Aijun, L., Zhang, S., Hu, Q., and Zhu, Y.-G., 2008, Accumulation of polycylic aromatic hydrocarbons and heavy metals in lettuce grown in the soils contaminated with long-term wastewater irrigation, J. Hazard. Mater., 152, 506-515.
-

- 12. Li, H., Sheng, G., Chiou, C.T., and Xu, O., 2005, Relation of organic contaminant equilibrium sorption and kinetic uptake in plants, Environ. Sci. Technol., 39, 4864-4870.
-

- 13. Lin, C.H., Huang, X.W., Kolbanovskii, A., Hingerty, B.E., Amin, S., Broyde, S., Geacitov, N.E., and Patel, D.J., 2001, Molecular topology of polycyclic aromatic carcinogens determines DNA adduct conformation: A link to tumorigenic activity, J. Mol. Biol., 306, 1059-1080.
-

- 14. Liste, H.-H. and Alexander, M., 2002, Butanol extraction to predict bioavailability of PAHs in soil, Chemosphere, 46, 1011-1017.
-

- 15. Liu, K., Pan, X., Han, Y., Tang, F., and Yu, Y., 2012, Estimating the toxicity of the weak base carbendazim to the earthworm (Eisenia fetida) using in situ pore water concentrations in different soils, Sci. Total Environ., 438, 26-32.
-

- 16. Markwell, R.D., Connell, D.W., and Gabric, A.J., 1989, Bioaccumulation of lipophilic compounds from sediment by oligochaetes, Water Res., 23, 1443-1450.
-

- 17. Mei, X., Lin, D.H., Xu, Y., Wu, Y.Y., and Tu, Y.Y., 2009, Effects of phenanthrene on chemical composition and enzyme activity in fresh tea leaves, Food Chem., 115, 569-573.
-

- 18. Ministry of Environment, 2018, Environmental Health Act, Sejong, Korea.
- 19. Mundus, S., Lombi, E., Holm, P.E., Zhang, H., and husted, S., 2012, Assessing the plant availability of manganese in soils using diffusive gradients in thin films (DGT), Geoderma, 183-184, 92-99.
-

- 20. Ni, H., Zhou, W., and Zhu, L., 2014, Enhancing plant-microbe associated bioremediation of phenanthrene and pyrene contaminated soil by SDBS-Tween 80 mixed surfactants, J. Environ. Sci., 26, 1071-1079.
-

- 21. Nicola, F., Maisto, G., Prati, M.V., and Alfani, A., 2008, Leaf accumulation of trace elements and polycyclic aromatic hydrocarbons (PAHs) in Quercus ilex L., Environ. Pollut., 153, 376-383.
-

- 22. OECD, 2007, OECD Draft guideline for testing chemicals: predatory mite production test in soil (hypoaspis (Geolaelaps) aquifers), OECD Publishing: Paris.
- 23. Oleszczuk, P., Hale, S.E., Lehmann, J., and Cornelissen, G., 2012, Activated carbon and biocahr amendments decrease pore-water concentrations of polycyclic aromatic hydrocarbons (PAHs) in sewage sludge, Bioresour. Technol., 111, 84-91.
-

- 24. Paulik, L.B., Smith, B.W., Bergmann, A.J., Sower, G.L., Forsberg. N.D., Teeguarden, J.G., and Anderson, K.A., 2016, Passive samplers accurately predict PAH levels in resident crayfish, Sci. Total Environ., 544, 782-791.
-

- 25. Shin, W.S., 2007, Scientific feasibility on the risk-based clean-up and management of contaminated sites, J. Soil. Groundw. Environ., 12, 1-35.
- 26. Simonich, S.L. and Hites, R.A., 1994, Vegetation-atmosphere partitioning of polycyclic aromatic hydrocarbons, Environ. Sci. Technol., 28, 297-303.
-

- 27. Su, Y.-H. and Zhu, Y.-G., 2008, Uptake of selected PAHs from contaminated soils by rice seedlings (Oryza sativa) and influence of rhizosphere on PAH distribution, Environ. Pollut., 155, 359-365.
-

- 28. Tang, J., Robertson, B.K., and Alexander, M., 1999, Chemical-extraction methods to estimate bioavailability of DDT, DDE, and DDD in soil, Environ. Sci. Technol., 33, 4346-4351.
-

- 29. Tao, Y., Zhang, S., Wang, Z., and Cristie, P., 2008, Predicting bioavailability of PAHs in soils to wheat roots with triolein-embedded cellulose acetate membranes and comparison with chemical extraction, J. Agric. Food Chem., 56, 10817-10823.
-

- 30. USEPA, 1994, Method 3541: Automated Soxhlet Extraction, Test Methods for the Evaluation of Solid Waste: Laboratory Manual Physical Chemical Methods. SW 846, Washington, DC, USA, Office of Solid Waste.
- 31. USEPA, 2007, Method 3541a: Pressurized Fluid Extraction, Test Methods for the Evaluation of Solid Waste: Laboratory Manual Physical Chemical Methods. SW 846, Washington, DC, USA, Office of Solid Waste.
- 32. Wu, X., Ernst, F., Conkle, J.L., and Gan, J., 2013, Comparative uptake and translocation of pharmaceutical and personal care products (PPCPs) by common vegetables, Environ. Int., 60, 15-22.
-

- 33. Yang, Z. and Zhu, L., 2007, Performance of the partition-limited model on predicting ryegrass uptake of polycyclic aromatic hydrocarbons, Chemosphere, 67, 402-409.
-

- 34. Zhang, H. and Davison, W., 1995, Performance characteristics of diffusion gradients in thin films for the in situ measurement of trace metals in aqueous solution, Anal. Chem., 67, 3391-3400.
-

- 35. Zhang, M. and Zhu, L., 2009, Sorption of polycyclic aromatic hydrocarbons to carbohydrates and lipids of ryegrass root and implications for a sorption prediction model, Environ. Sci. Technol., 43, 2740-2745.
-

- 36. Zhang, D., Zhu, Y., Xie, X., Han, C., Zhang, H., Zhou, L., Li, M., Xu, G., Jiang, L., and Li, A., 2019, Application of diffusive gradients in thin-films for in-situ monitoring of nitrochlorobenzene compounds in aquatic environments, Water Res., 157, 292-300.
-

 This Article
This Article
-
2019; 24(6): 16-25
Published on Dec 31, 2019
- 10.7857/JSGE.2019.24.6.016
- Received on Dec 5, 2019
- Revised on Dec 5, 2019
- Accepted on Dec 17, 2019
 Services
Services
Shared
 Correspondence to
Correspondence to
- Won Sik Shin
-
School of Architecture, Civil, Environmental and Energy Engineering, Kyungpook National University, Daegu 41566, Korea
- E-mail: wshin@knu.ac.kr