- Effect of Iron Activators on the Persulfate Oxidation of Polycyclic Aromatic Hydrocarbons (PAHs) in Contaminated Soils
Jiyeon Choi·Jungdo Park·Won Sik Shin*
School of Architectural, Civil, Environmental and Energy Engineering, Kyungpook National University, Daegu 41566, Korea
- 다환방향족 탄화수소(PAHs) 오염토양의 과황산 산화 시 철 활성화제의 영향
최지연·박정도·신원식*
경북대학교 건설환경에너지공학부
PAHs commonly found in industrial sites such as manufactured gas plants
(MGP) are potentially toxic, mutagenic and carcinogenic, and thus require
immediate remediation. In-situ chemical oxidation (ISCO) is known as a highly
efficient technology for soil and groundwater remediation. Among the several
types of oxidants utilized in ISCO, persulfate has gained significant attention
in recent years. Peroxydisulfate ion (S2O82-) is a strong oxidant with very high redox potential
(E0 = 2.01 V). When mixed
with Fe2+, it is capable of forming the sulfate radical (SO4-∙) that has an even higher redox
potential (E0 = 2.6 V). In this
study, the influence of various iron activators on the persulfate oxidation of
PAHs in contaminated soils was investigated. Several iron sources such as
ferrous sulfate (FeSO4), ferrous sulfide (FeS) and zero-valent iron
(Fe(0)) were tested as a persulfate activator. Acenaphthene (ANE), dibenzofuran
(DBF) and fluorene (FLE) were selected as model compounds because they were the
dominant PAHs found in the field-contaminated soil collected from a MGP site.
Oxidation kinetics of these PAHs in an artificially contaminated soil and the PAH-contaminated field soil were
investigated. For all soils, Fe(0) was the most effective iron activator. The
maximum PAHs removal rate in Fe(0)-mediated reactions was 92.7% for ANE, 83.0%
for FLE, and 59.3% for DBF in the artificially contaminated soil, while the
removal rate of total PAHs was 72.7% in the field-contaminated soil. To promote
the iron activator effect, the effects of hydroxylamine as a reducing agent on
reduction of Fe3+ to Fe2+, and EDTA and
pyrophosphate as chelating agents on iron stabilization in persulfate oxidation
were also investigated. As hydroxylamine and chelating agents (EDTA,
pyrophosphate) dosage increased, the individual PAH removal rate in the
artificially contaminated soil and the total PAHs removal rate in the
field-contaminated soil increased.
Keywords: Persulfate Oxidation, PAHs, Iron-activator, Hydroxylamine, Chelating agents
두 개 이상의 방향족 고리를 가지고 있는 다환방향족탄화수소(polycyclic aromatic hydrocarbons, PAHs)는
소수성 유기 오염물질로 화학연료나 유기물의 불완전 연소시 부산물로 발생하는 물질이다. PAHs는 강한 독성, 생물 농축성, 난분해성, 잔류성이
있어 인체 및 환경에 장기적인 피해를 유발한다. 토양의 주요 PAHs 오염원은 유류저장시설, 폐침목의 크레오소트, 코크스 제조공정 등에서 배출되는 유기화합물이며, 특히
제조 가스 플랜트(manufactured gas plant, MGP) 부지에서의 PAHs 오염 처리가 연구되고 있다(Chen et al.,
2016; Idowu et al., 2020; Stout and Brey, 2019). 미국, 유럽 등 선진국에서는 이미 PAHs에 대한 토양오염기준
또는 정화기준을 설정하여 오염을 관리하고 있다(White and Claxton, 2004). 우리나라의 경우, 2009년에 발표된 토양보전기본계획에
따르면 2019년까지 PAHs에 대한 기준을 확대할 것이라고 밝힌 바 있으며(Ministry of Environment, 2009), 2009년
6월 토양환경보전법 시행규칙 개정에 따라 유독물의 제조 및 저장시설과 폐침목을 사용한 지역에 한하여 벤조(a)피렌을 토양오염물질로 지정하고 있고,
2019년부터 토양오염물질로 1,2-디클로로에탄이 새롭게 추가되었다(Ministry of Environment, 2018). 따라서 토양 내
PAHs 오염처리 기술에 대한 연구가 시급하다.
토양 및 지하수의 오염물질을 처리하는 기술 가운데 지중 화학적 산화기술(in-situ chemical oxidation, ISCO)은
아주 효과적인 방법이다. 특히 지중산화법에서 산화제로 사용되는 과황산 (pesulfate)은 기존에 사용해왔던 산화제들에 비하여 효과적인 산화제로
평가받고 있다. 과황산은 펜톤(Fenton) 및 오존(ozone)과 비교하여 비슷하거나 그 이상의 산화력을 가지며, 용해도가 높아 고농도로 주입이
가능하고, 넓은 pH 범위에 대해서도 적용이 가능하다. 또한 산화 반응 시 열, 증기, 건강유해물질이 발생하지 않아 생태계 및 인체에 위해하지
않다는 장점이 있다. 과황산은 전이금속을 통해 활성화되어 황산 라디칼(sulfate radical, SO4-∙)을 형성하여 높은 산화력을
보인다. 여러 전이금속 중 일반적으로 철을 사용하고 있는데, 철로부터 발생한 Fe2+가 과황산과 반응하여 황산 라디칼을 형성하는
산화 반응을 통하여 오염물질을 처리할 수 있다(식 (1) 참조). 과황산 산화 반응에서 주로 사용되는 철 활성화제로는 FeSO4(Liang
et al., 2004; Kusmierek et al., 2015), FeS(Mackinawite)(Chen et al., 2017; Fan et
al., 2018), Fe(0)(Li et al., 2014; Chen et al., 2015; Kim et al., 2018) 등이 있다.
그러나 철은 과량으로 투입될 경우 황산 라디칼과 반응하여 황산 라디칼을 소모하는 라디칼 스케빈저(radical scavenger) 역할을 하여
오염물질의 처리 효율을 저감시킬 수 있기 때문에(식 (2) 참조)(Tan et al., 2012) 적정량의 철을 주입하거나 철이 안정적으로 반응할
수 있도록 하는 것이 중요하다. 킬레이트제를 주입하여 철 이온의 침전을 막아 안정성을 높이거나(Tan et al., 2004; Zou et
al., 2013) 하이드록실아민과 같은 환원제를 주입하여 Fe3+을 다시 Fe2+로 환원시켜(Wu
et al., 2015) 과황산 산화 활성을 높힐 수 있다.
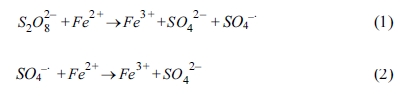
본 연구에서는 철로 활성화된 과황산 산화에서 처리 효율을 높이기 위해 다양한 철 종류(FeSO4, FeS,
Fe(0))에 따른 과황산 산화 처리효율을 평가하고, 처리효율을 증가시킬 수 있는 추가 인자에 대한 연구를 수행하였다.
2.1. 실험 재료
본 실험에서 사용된 PAHs는 아세나프텐(acenaphthene, ANE, Sigma-Aldrich, >99%), 디벤조퓨란(dibenzofuran,
DBF, Sigma-Aldrich, >98%), 플루오렌(fluorene, FLE, AlfaAesar, >98%)이다. 산화제로는 과황산나트륨(sodium
persulfate, PS, Na2S2O8, Duksan Pure Chemicals
Co., Ltd, >95%)을 사용하였으며, 철 활성화제로 황산철(ferrous sulfate heptahydrate, FeSO4,
FeSO4·7H2O, Duksan Pure Chemicals Co., Ltd.,
>98%). 황화제일철(iron(II) sulfide, FeS, Duksan Pure Chemicals Co., Ltd,
>50%). 영가철(zero-valent iron, ZVI, Fe(0), Kanto Chemical Co., Inc., >98%)을
구입하여 사용하였다. 산화반응 첨가제로 하이드록실아민(hydroxylamine hydrochloride, HA, NH2OH· HCl, Duksan Pure Chemicals Co., Ltd, >95%), EDTA (ethylenediaminetetraacetic acid disodium salt dihydrate, C10H14O8N2Na2·2H2O,
Daejung Chemicals & Metals Co., Ltd., >98%), 피로인산나트륨(sodium pyrophosphate
tetrabasic, PP, Na4O7P2,
Sigma-Aldrich, >95.0%)을 사용하였다.
2.2. 토양
본 연구에서는 PAHs로 아세나프텐(ANE), 디벤조퓨란(DBF), 플루오렌(FLE)을 대상으로 하였으며, 물성은 Table 1에 나타내었다.
비오염토양에 인위적으로 PAHs를 오염시킨 인공오염토양을 제조하여 사용하였다, 대상 비오염토양은 경상남도 창녕군에 위치한 한 야산에서 채취하여
3일간 풍건시킨 후 균일하게 혼합하여 2 mm 표준체로 체거름하여
플라스틱 밀폐용기에 담아 보관하여 사용하였다. 인공오염토양은 현장오염토양의 주 오염물질인 ANE, DBF, FLE로 단일 오염시켰으며, 오염방법은
다음과 같다. 적당량의 PAHs를 25 mL 아세톤(Merck,
>99.8%)에 녹여 1 kg의 자연토양에 주입한 후 24시간 동안 10 rpm으로 텀블러에서 잘 혼합한 후 16시간
동안 암실에서 아세톤을 휘발시켜 인공오염토양을 제조하였으며(Brinch et al., 2002), 제조된 토양은 갈색 유리용기에 담아 실험에 사용하였다.
현장오염토양은 ○○공장부지 내 PAHs 오염 토양을 채취하였고, 채취한 토양은 1주일간 풍건시킨 후 2 mm 표준체로 체거름하였다.
사용된 토양은 pH, 유기물 함량(%), 비표면적 분석을 통해 기본적인 물성을 확인하였으며, Table 2에 나타내었다.
2.3. 산화 실험 방법
산화 실험은 40 mL의 암갈색 유리 바이알(Fisher Scientific)에 토양 1 g을 넣은 후 각 실험 조건에
맞게 제조된 산화용액을 10 mL 주입하고, 진탕배양기(Lab Tech, LSI-3016R, Korea)에서 20oC, 200 rpm에서 반응시켰다. 반응이
끝난 시료에 메탄올(Merck, >99.8%) 1 mL를 주입하여 산화 반응을
중지하였으며, 1,500 rpm에서 20분간 원심분리하여 상등액과 토양을 분리하였다.
2.3.1. 철 활성화제 종류에 따른
과황산 산화 영향
주입용액의 비율은 각 토양 내 PAHs의 몰농도를 기준으로 하였으며, 현장토양의 경우에는 각 물질의 몰농도 합(ΣPAHs)을 기준으로
하였다. FeSO4는 용액으로 제조하였고, FeS와 Fe(0)의 경우 파우더 형태로 토양에 주입한 후 과황산 용액을 주입하였다.
PAHs:PS:Fe의 몰 비율은 1:100:10이었으며, 총 8시간 동안 kinetic 실험을 3회 반복 수행하였다.
2.3.2. 하이드록실아민(HA) 주입에 따른 과황산 산화
영향
하이드록실아민의 주입농도는 Fe:HA의 몰 비율 1:5, 1:10, 1:20, 1:50으로 하였다. PAHs:PS:Fe 몰 비율
1: 100:10에서 2시간 동안 반응시킨 시료에 하이드록실아민을 주입한 후 2시간 동안 추가로 반응시켰다.
2.3.3. 킬레이트제(chelating agent, CA) 주입에 따른 과황산 산화 영향
킬레이트제 주입에 따른 과황산 산화 영향 평가를 위하여 킬레이트제로 EDTA와 pyrophosphate(PP)를 사용하였다. 킬레이트제의
주입농도는 Fe:CA의 몰비율 10:1, 10:5, 10:10, 10:20, 10:50으로 하였다. 반응 시간은 총 4시간으로 회분식으로 진행하였다.
2.4. 분석 방법
토양의 PAHs 추출 및 분석은 USEPA method 3545A (USEPA, 2007)에 따라
ASE(accelerated soxhlet extraction, Dionex ASE 350, Thermo
Scientific)를 이용하였으며, 추출 용매는 아세톤(Merck, >99.8%) : 헥산(Merck, >99.8%)을 1:1
(v/v) 비율로 혼합한 혼합용액을 사용하였다. PAHs 분석은 USEPA method 8270D(SW-846, USEPA, 2014)에 따라
분석하였으며, 사용된 GC-MS는 7890A GC와 5975C inert MSD(Agilent, USA)였고, Expanded PAH
Mix(Z-014G-FL, 2,000 μg/mL in 50:50
Dichloromethane:Benzene, AccuStandard, Inc.)로 검량선을 작성하였다. 자세한 GC-MS 운전조건은 다음
Table 3에 나타내었다.
과황산 이온 농도는 분광학적 분석법으로 측정하였다. 반응 후 원심분리한 상등액은 0.45 μm syringe
filter (PTFE, Φ = 25 mm, Whatman)로
여과 후 0.1 mL 분취하여 10 mL의 0.1 M 요오드화 칼륨(KI,
Duksan Pure Chemicals Co., Ltd, 99.8%)에 주입한 후 1 mL 0.1 M 황산(H2SO4,
Duksan Pure Chemicals Co., Ltd, min. 95.0%)을 혼합하여 6시간 동안 발색시켰다. UV-visible
spectrophotometer(Agilent 8453, Agilent, USA)를 이용하여 450 nm에서 측정하였다(Burgess
and Davison, 2012).
2.5. 산화 속도 모델
PAHs 산화 반응 속도는 다음의 유사 1차 속도 모델(pseudo-first-order model, PFOM) 식으로
표현할 수 있다.

여기서 C(t)는 반응시간 t(hr)에서 산화 후 남은 토양 내 오염물질의 농도(mg/kg),
C0는 초기 오염농도(mg/kg), k는 PFOM의 반응속도 상수(hr-1)이다.
2영역 1차 동역학 모델(two compartment first-order kinetic model, TCFOKM,
Cornellison et al., 2000)은 아래의 식으로 표현된다.
이 식은 주로 토양내 오염물질의 흡착 또는 탈착 동력학을 해석하기 위해 사용되었으나(Cornellison et al., 1997b; Oh et
al., 2013), 본 논문에서는 산화 동력학을 해석하기 위해 활용하였다.
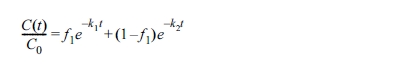
여기서 f1과 f2는 각각 빠른 반응 부분과 느린 반응 부분의 분율을
나타내며, k1과 k2는 각각 빠른 또는 느린 반응 부분에서의 1차속도상수(hr-1)이다. 각 모델의 매개변수는
Table Curve 2D®(Version 5.1,
SPSS, Inc.)를 이용하여 결정하였다.
3.1. 철 활성화제 종류에 따른 과황산 산화 영향
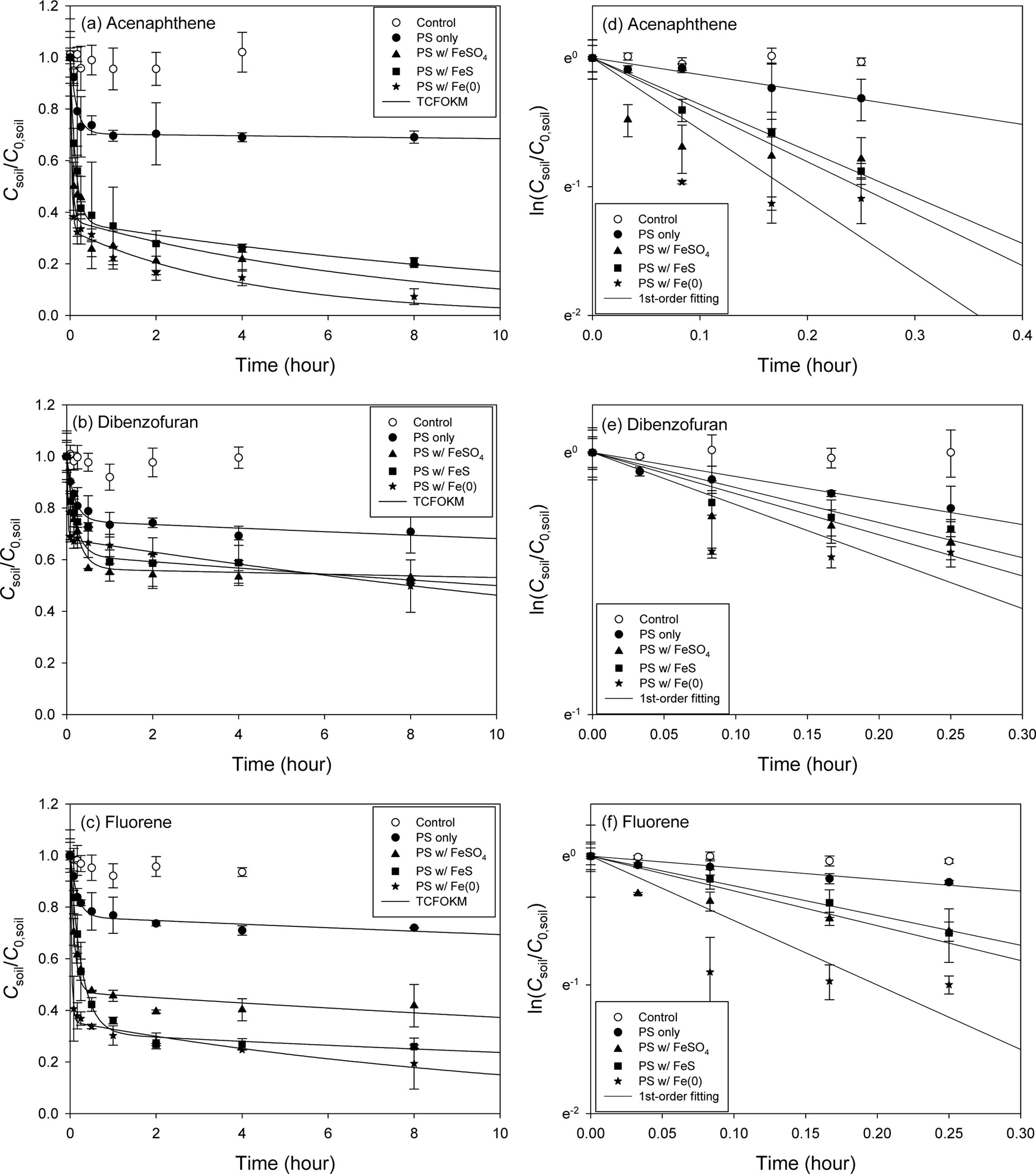
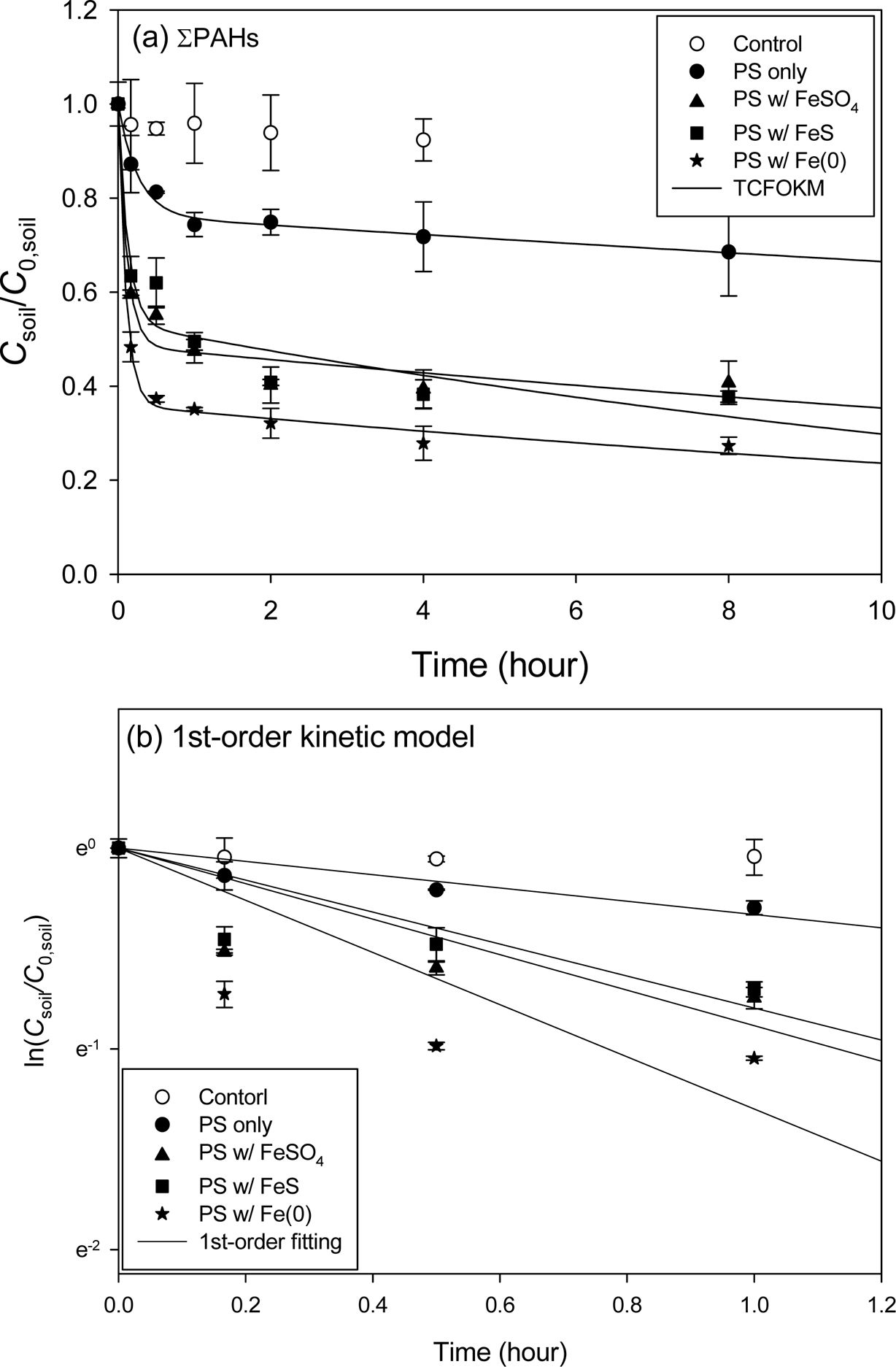
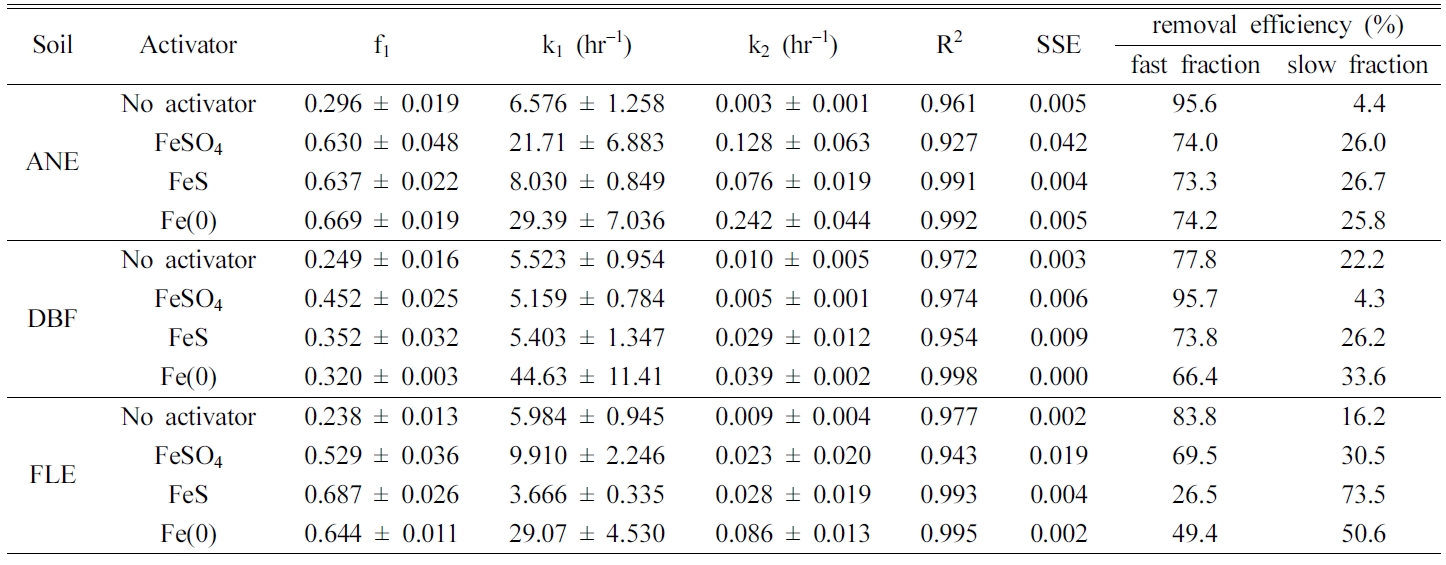
Fig. 1과 Table 4~5에 인공오염토양의 실험 결과를 나타내었다. ANE로 오염시킨 토양(ANE 토양)의 경우 8시간 반응에서
제거율은 Fe(0)(92.7%) > FeSO4
(80.6%) > FeS(78.8%)의 순으로 나타났으며 Fe(0)의 제거율이 가장 높게 나타났다. 빠른
반응영역에서의 1차속도상수(k1) 또한 제거율과 같은 순서로 높게 나타났으며, k1
값 또한 Fe(0)(29.39 hr-1) > FeSO4(21.71 hr-1) > FeS(8.030 hr-1)의 순이였다. 빠른 반응영역의
분율( f1)은 FeSO4(0.630) >
Fe(0)(0.669) > FeS(0.637) 순으로
나타냈다. 과황산 소모율은 Fe(0)(32.4%) > FeSO4(24.0%) > FeS (20.9%) 순으로
Fe(0)이 가장 많은 과황산을 소모하는 것을 알 수 있었다. 최적 조건에서의 PAH 총 분해량 대비 빠른 반응영역에서의 분율은
Fe(0)(74.2%) > FeSO4(74.0%) > FeS (73.3%)로 나타났으며(Table 4 참조), 큰 차이는 없었으며, 빠른 반응영역에서의 제거효율이
큰 것을 알 수 있었다.
DBF로 오염시킨 토양(DBF 토양)의 경우 8시간 반응에서 제거율은 Fe(0)(50.2%) > FeS(48.7%) > FeSO4(46.7%)
순으로 나타났으며 큰 차이가 없었다. 빠른 반응영역에서의 k1 값은 Fe(0)(44.63 hr-1) > FeS(5.403 hr-1) > FeSO4 (5.159 hr-1)로 제거율과 같은 순으로
나타났으며, 특히 Fe(0)의 k1 값이 눈에 띄게 높게 나타났으며 f1은
FeSO4(0.452) > FeS(0.352) > Fe(0)(0.320)의
순으로 나타났다. 과황산의 소모율은 Fe(0)(20.3%) > FeSO4(14.0%) > FeS(9.75%)으로
ANE 토양과 같은 순서로 높게 나타났다. 최적 조건에서의 PAH 총 분해량 대비 빠른 반응영역에서의 분율은 FeSO4(95.7%) > FeS(73.8%) > Fe(0)(66.4%)로
나타나 빠른 반응영역에서 대부분이 제거됨을 알 수 있었다(Table 4 참조).
FLE로 오염시킨 토양(FLE 토양)의 경우 8시간 반응에서 제거율은 Fe(0)(80.6%) > FeS(74.1%) > FeSO4(58.2%)의
순이였다. f1은 FeS(0.687) > Fe(0)(0.644) > FeSO4 (0.529) 순으로, k1은 Fe(0)(29.07 hr-1) > FeSO4(9.910 hr-1) > FeS(3.666 hr-1) 순으로 높게 나타났다.
과황산 소모율은 Fe(0)(27.9%) > FeSO4(17.7%) > FeS(14.0%)의 순으로
나타났다. 최적 조건에서의 PAH 총 분해량 대비 빠른 반응영역에서의 분율은 FeSO4(32.8%) > Fe(0)(24.7%) > FeS (12.9%)로 나타났다(Table 4 참조). 제거효율이 가장 높게 나타난 Fe(0)을 활성화제로 하였을 때 각 인공오염토양의 최대
제거율은 ANE 토양 > FLE 토양 > DBF 토양 순으로 ANE 토양의 제거율이 가장 높게 나타났다. Table 5
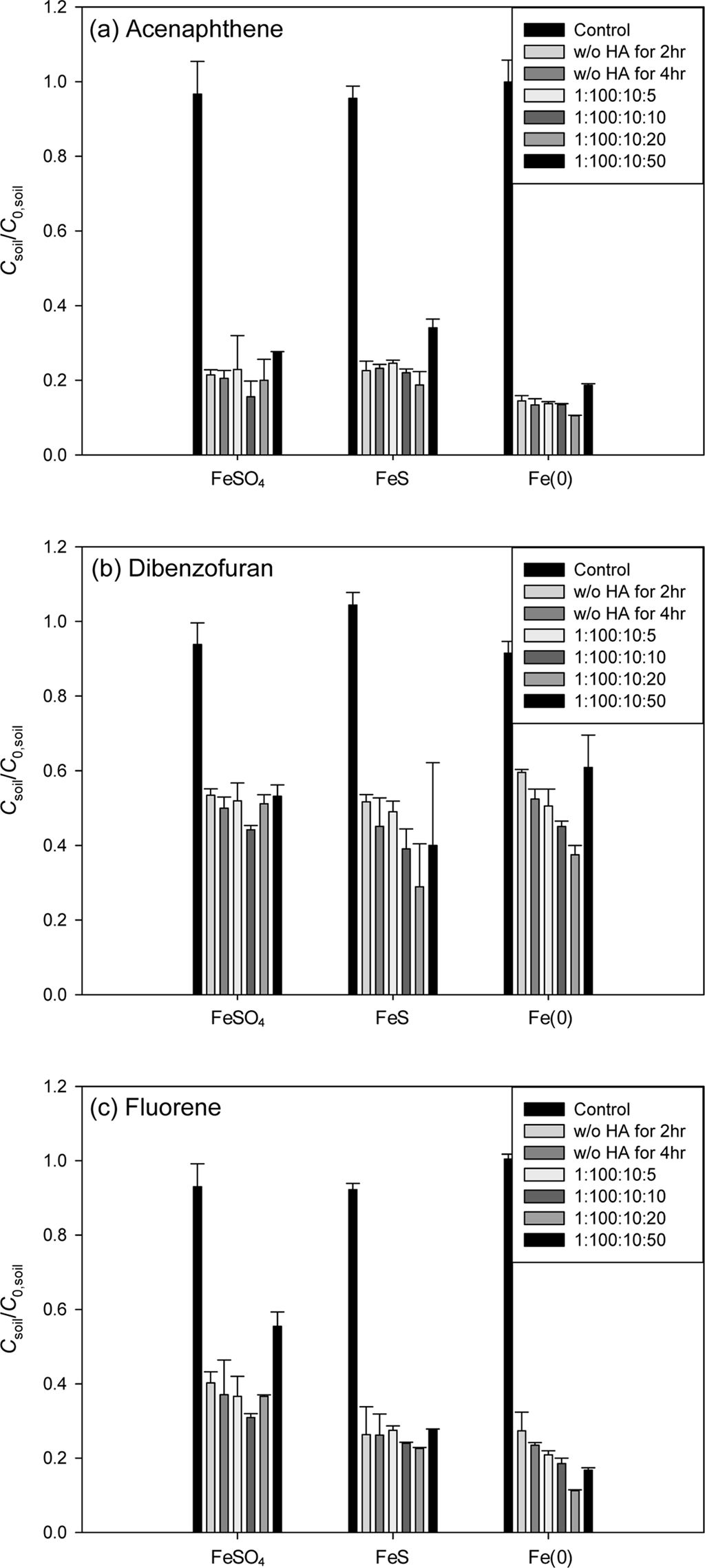
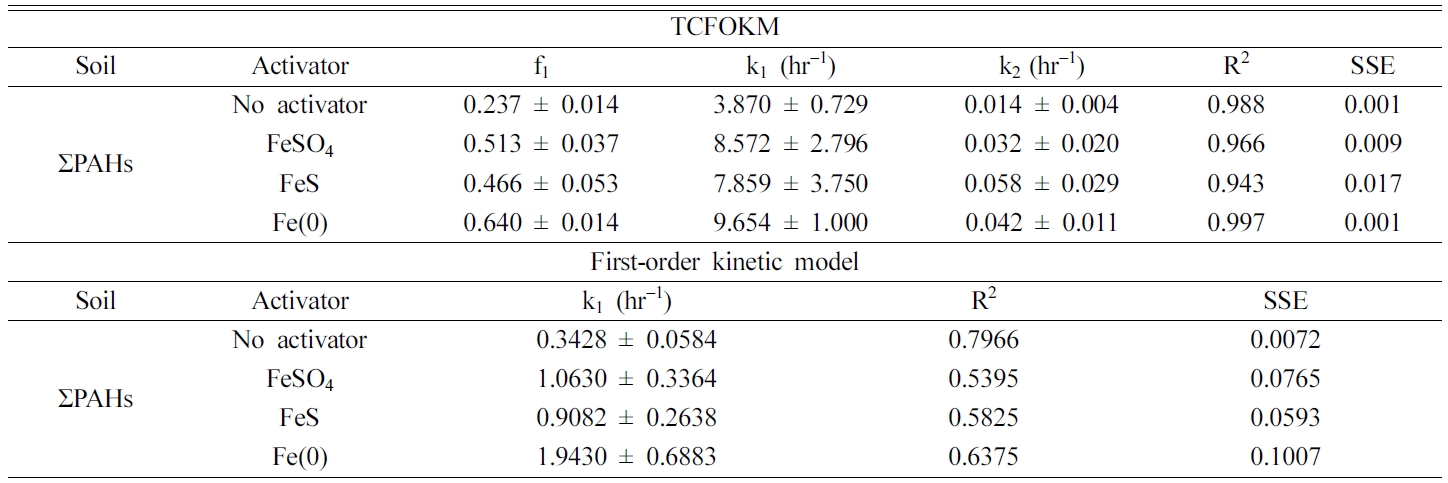
현장오염토양의 실험 결과는 Fig. 2와 Table 6에 나타내었다. 8시간 반응에서 철 활성화제의 종류에 따른 ΣPAHs 제거율 결과는
Fe(0)(73.0%) > FeS(60.7%) ³ FeSO4 (59.2%)로 나타나 각 PAH 물질로 오염시킨 인공오염토양에서의 제거율 순과 같게 나타났다. TCFOKM의 k1
값은 Fe(0)(9.654 hr-1) > FeSO4(8.572 hr-1) > FeS(7.859 hr-1), f1
값은 Fe(0)(0.640) > FeS(0.466) > FeSO4(0.513)
순으로 나타났고, PFOM 모델의 k 값은 Fe(0)(1.943 hr-1) > FeSO4 (1.063 hr-1) > FeS(0.908 hr-1)으로 나타나
TCFOKM의 k1 값과 동일한 순서로 나타났다. 각 활성화제별 PAH의 제거율을 비교해보면 Fe(0) 투입시
ANE(91.9%) > FLE (50.4%) > DBF(43.4%),
FeS 투입시 ANE(90.3%) > FLE (62.3%) > DBF(0.51%),
FeSO4 투입시 ANE(93.2%) > FLE (44.9%) > DBF(0%) 순으로 철
활성화제 종류와 관계없이 동일한 순서를 보였으며, DBF는 현장토양에서 제거효율이 낮은 것을 알 수 있었다. 이로부터 현장오염 토양의
산화시에 Fe(0)이 가장 효율적인 활성화제임을 알 수 있다.
각 철 활성화제 중 Fe(0)이 모든 토양에서 가장 높은 제거율을 보였으며 과황산을 가장 많이 소모하는 것으로 나타났다. Fe2+
이온을 활성화제로 주입할 경우 Fe3+ 이온으로 빠르게 전환됨으로써 빠르게 소비되는 반면, Fe(0)와 FeS를 주입할 경우
Fe2+ 이온이 서서히 방출되므로 지속적인 반응을 유도할 수 있어 산화 효율이 더 높게 나타났다(Liang et al.,
2004; Sun and Zhou, 2012). 또한, 수용액 상에서 p-chloroaniline을 Fe(0)와 FeS로 활성화하여 과황산 산화
처리한 Fan et al.(2018)의 연구를 보면 Fe(0)의 초기 반응 속도가 FeS보다 더 높게 나타난 것을 확인할 수 있으며, 본 연구에서도
Fe(0)의 k1 값이 FeS의 k1 값보다 높게 나타났다.
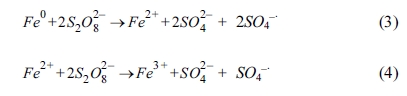
3.2. 하이드록실아민 주입에 따른 과황산 산화 영향
Fe3+을 Fe2+로의 재활성을 위하여 하이드록실아민(hydroxylamine), 티오황산나트륨(sodium
thiosulfate), 아스코르빅산(ascorbic acid), 아스코르빈산 나트륨(sodium ascorbate) 등의 다양한 환원제(reducing
agent)가 이용된다(Lei et al., 2015; Wu et al., 2015). 본 연구에서는 하이드록실아민을 주입하여 재활성(reactivation)
효과를 확인하였다. 과황산 산화 반응에서 하이드록실아민이 Fe3+가 축적되는 것을 막고, Fe2+로 빠르게
회복시키는 역할을 하여 산화 반응을 촉진한다(식 (5) ~ (7))(Han et
al., 2014).
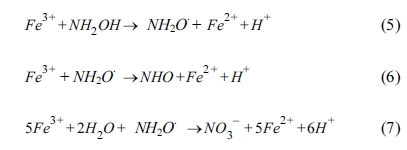
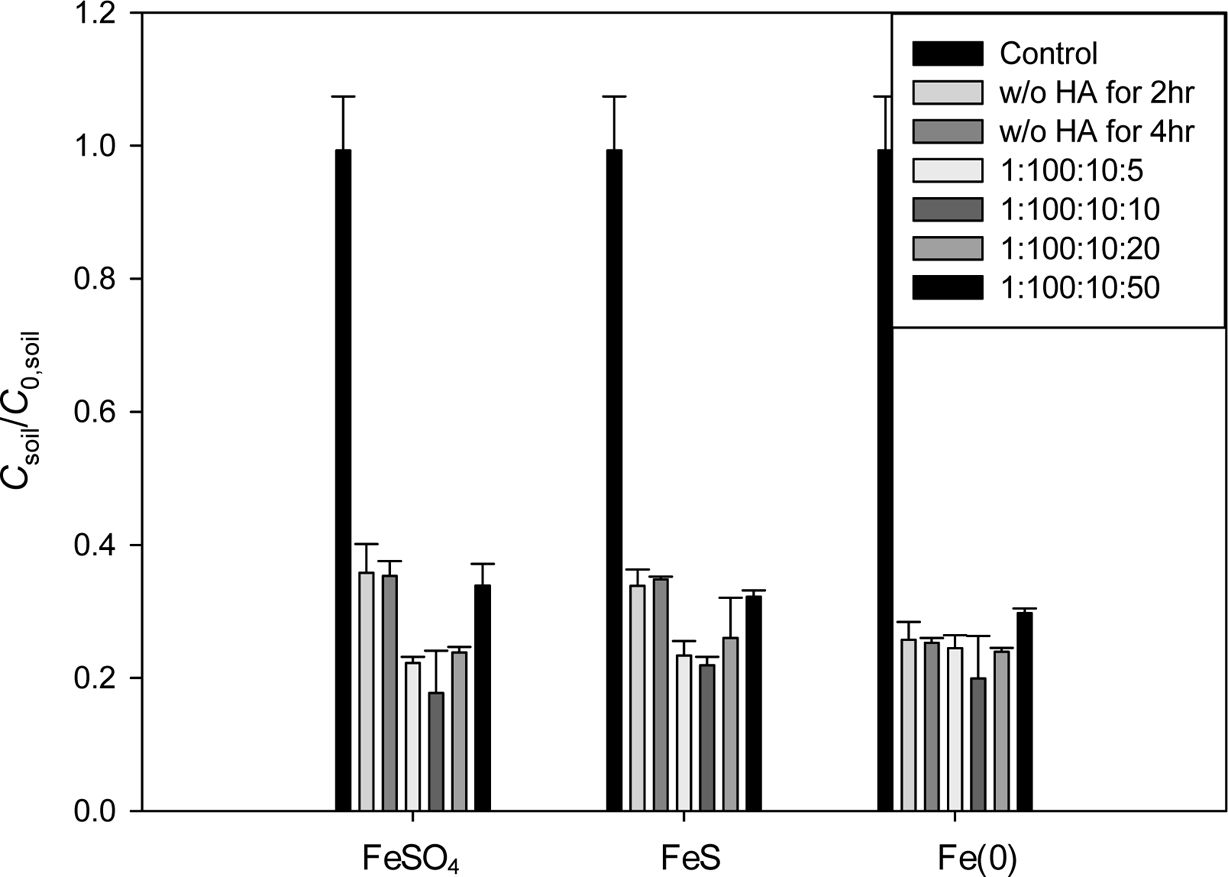
Fig. 3에 인공오염토양의 과황산 산화시 하이드록실아민(HA) 주입의 영향을 나타내었다. FeSO4로 활성화 된
과황산 산화에서는 Fe:HA의 몰 비율이 1:1일 때
각 PAH의 제거효율이 가장 높게 나타났다. 제거율의 증가율은 ANE 토양은 4.92%, DBF 토양은 5.78%, FLE 토양은 6.18%였다.
FeS와 Fe(0)에서는 Fe:HA의 몰비 1:2에서 가장
높은 제거율이 나타났으며, FeS 첨가시 제거율은 ANE 토양은 4.44%, DBF 토양은 16.2, FLE 토양은 3.63% 각각 증가하였으며,
Fe(0) 첨가시 ANE 토양은 2.89%, DBF 토양은 14.9, FLE 토양은 12.2%만큼 증가하였다. PAH의 제거율은 하이드록실아민의
비율이 증가함에 따라 증가하다 일정 비율 이상에서는 감소하였지만 과황산의 소모율은 하이드록실아민 비율이 증가함에 따라 증가하며,
PAH:PS:Fe:HA의 몰 비 1:100:10:50에서는 급격히 증가하였다. 일정 비율 이상에서 과황산의 소모량이 증가함에도 제거율의 증가하지
않는 이유는 과량의 하이드록실아민이 철 뿐만 아니라 과황산을 환원시키고, 황산 라디칼과 반응하여 PAH의 산화를 방해하기 때문이다. 또한 환원반응을
통해 생성된 하이드록실 라디칼이 서로 반응하여 소모되면서 Fe3+의 환원이 효과적으로 이루어지지 않기 때문이다(Han et
al., 2014; Neta and Huie, 1988).
Fig. 4는 과황산 산화시 하이드록실아민 주입 영향에 따른 현장오염토양의 산화실험 결과를 나타낸 것이다. 4시간 반응에서 철 활성화제
종류별 하이드록실아민 주입 농도에 따른 제거율을 비교해보면, 모든 철 활성화제 실험에서 하이드록실아민을 주입하였을 때 제거효율은 증가하는 것으로
나타났으며, PAH:PS:Fe:HA의 몰 비 1:100: 10:10에서 가장 높은
제거효율을 보였다. 인공오염토양 실험 결과에서와 마찬가지로 하이드록실아민 비율이 증가함에 따라 제거율이 증가하나 PAH:PS:Fe:HA의 몰 비
1:100:10:20과 1:100:10:50에서는 제거효율 증가율이 크지 않은 것으로 나타났다. 이는 앞서 설명한 바와 같이 과량의 하이드록실아민이
철 뿐만 아니라 과황산을 환원시키고, 황산 라디칼과 반응하여 PAH 산화를 방해하는 원인으로 설명할 수 있다(Han et al., 2014).
제거효율이 가장 높게 나타난 PAH:PS:Fe:HA의 몰 비 1:100:10:10에서의 각 철 활성화제별 결과를 보면 제거효율 증가율은
FeSO4(17.6%) > FeS(12.9%) > Fe(0)(5.4%) 순으로
나타났다. FeSO4 투여시 하이드록실아민에 의한 제거율 증가 효과가 가장 높은 것으로 나타났다. FeSO4를
철 활성화제로 사용할 경우 Fe2+ 이온 형태로 주입되기 때문에 Fe3+이 가장 빠르게 발생되며, 산화
시작과 동시에 주입된 하이드록실아민의 환원 작용에 의해 Fe3+이 Fe2+로 전환되었기 때문이다.
3.3. 킬레이트제 주입에 따른 과황산 산화 영향
킬레이트제를 주입함으로써 활성화제로 사용된 철 이온의 침전을 방지하여 안정성을 높이고, 산화제 활성을 가속화하는 효과를 기대할 수 있다(Zou
et al., 2013). 주로 사용되는 킬레이트제로는 pyrophosphate(PP), citrate, (S,S)-ethylenediamine-N,N’-disuccinic
acid trisodium salt (EDDS),
ethylenediaminetetraacetic acid(EDTA), nitrileo- triacetic acid(NTA) 등이 있으며(Rastogi
et al., 2009; Zou et al., 2013), 이 가운데 본 연구에서는 유기 킬레이트제인 EDTA와 무기 킬레이트제인
pyrophosphate(PP)의 주입에 따른 과황산 산화 영향을 확인하였다.
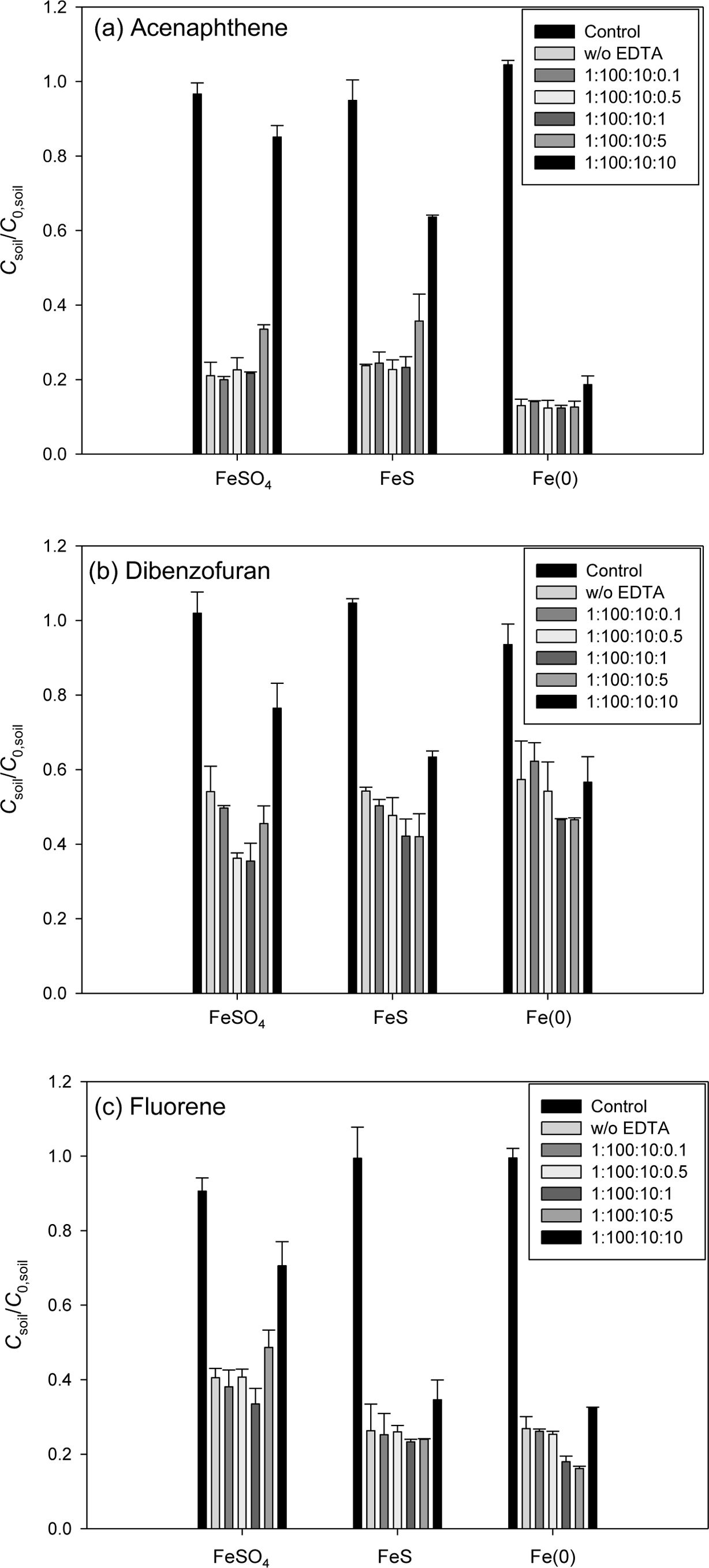
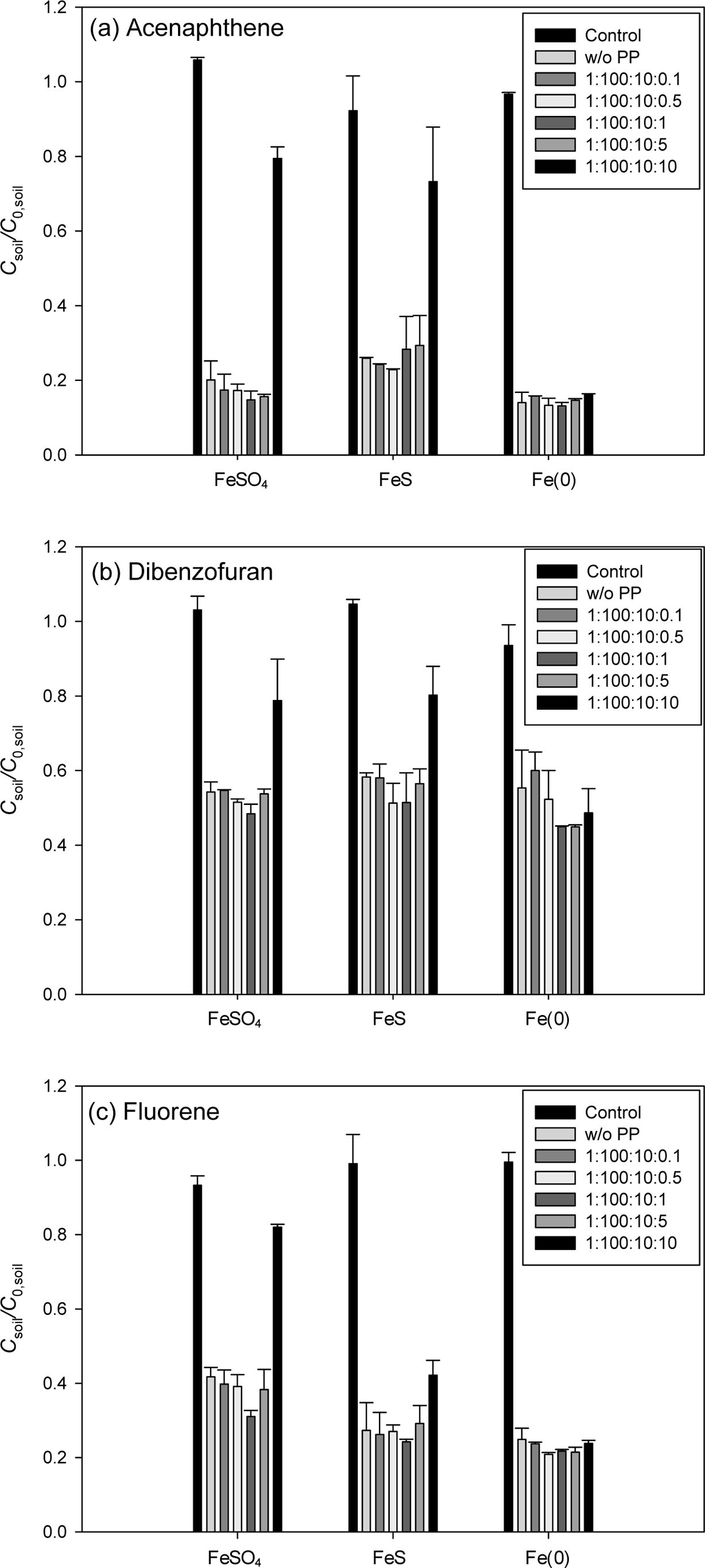
Fig. 5에 EDTA 주입에 따른 인공오염토양의 산화실험 결과를 나타내었다. DBF, FLE 오염토양에서는 EDTA 주입에 의해 제거율이
증가하는 것을 볼 수 있었으나, ANE 오염토양에서는 제거율이 증가하지 않았다. DBF 오염토양에서의 제거율은 FeSO4(18.62%) > FeS (12.2%) >
Fe(0)(10.8%)의 순으로 증가하였으며 FeSO4에서 가장 높게 증가했으며 최대 제거율 또한 64.5%로 가장 높게 나타났다.
FLE의 제거율은 Fe(0)(10.7%) > FeSO4(7.05%)
> FeS(2.96%)의 순으로 증가하여 Fe(0)에서 최대 83.8% 제거되었다. EDTA는 금속
양이온과의 결합력이 뛰어나 Fe2+에서 Fe3+로의 빠른 전환을 막는 효과가 있어 과황산 산화 효과를 증가시킨다(Dong
et al., 2017). 또한, EDTA 주입시 생성되는 부산물(R•, RH)에 의해 다음 식 (8), (9)와 같은 반응이
발생하여 Fe3+가 Fe2+로 전환됨으로써 더 높은 산화효율을 기대할 수 있다(Han et al.,
2014). 모든 실험 결과에서 고농도의 EDTA(PAH:PS:Fe: EDTA = 1:100:10:10)에서
제거율이 감소하였는데 과황산 산화 시 과량의 EDTA가 PAH와 경쟁하여 PAH의 제거를 방해하기 때문이다(Venny et al., 2012;
Dong et al., 2017).

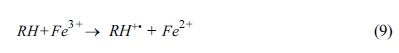
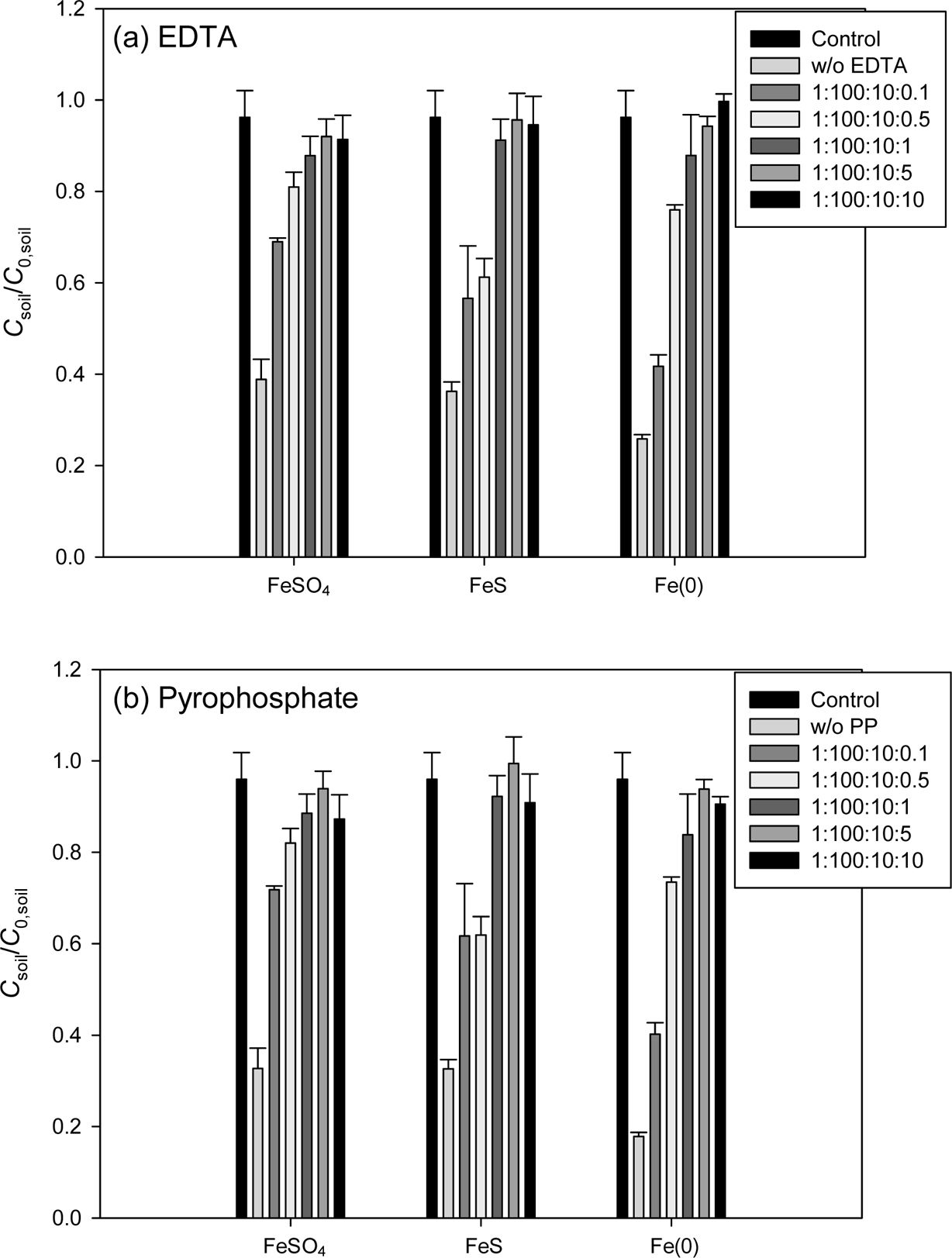
인공오염토양을 대상으로 한 pyrophosphate(PP) 주입에 따른 결과는 Fig. 6에 나타내었다. 각 토양 및 활성화제별 제거율의
증가폭은 ANE 토양은 FeSO4(5.35%) >
FeS(3.07%) > Fe(0)(0.89%)의
순으로, DBF 토양은 Fe(0) (10.4%) > FeS(6.83%) > FeSO4(5.85%)의
순으로, FLE 토양은 FeSO4(10.7%) > Fe(0)(3.11%) > FeS(3.08%)의 순으로
각각 증가하였다. EDTA와 비교하여 각 물질별 최대제거율은 DBF에서는 낮게 나타났지만 ANE와 FLE에서는 높은 제거율을 보였다.
PAH:PS:Fe:PP의 몰비 1:100: 10:10에서 PAH 제거율은 오히려 감소하였으며, 특히
FeSO4와 FeS에서는 급격한 감소가 나타나는데 이는 pyrophosphate(PP)가 첨가됨으로써 높아진 pH의 영향으로
보인다. Akbari et al.(2016)은 철로 활성화 된 과황산 산화에서 pH가 증가하면 iron oxide 및 iron
hydroxide가 생성되어 침전됨으로써 과황산의 활성화를 방해한다고 밝혔다.
현장오염토양에 대한 EDTA 및 pyrophosphate(PP)의 주입 실험 결과를 보면, 현장오염토양에서 킬레이트제 주입은 주입 전과
비교하여 제거율이 오히려 감소하는 것으로 나타났다(Fig. 7 참조). 반응이 끝난 후 상등액의 pH 측정 결과 EDTA의 경우 5.20 – 8.92,
pyrophosphate(PP)의 경우 6.14 – 9.5로 높게 나타났다.
인공오염토양의 결과에서 킬레이트제의 농도가 증가할수록 pH가 증가하는 경향이 나타났는데 인공오염토양의 pH가 4.56인 데 비해 현장토양 pH는
8.64로 높아 킬레이트제의 주입으로 인한 pH의 증가가 더 크게 나타난 것으로 보인다. 따라서 pH가 높아지면서 iron
oxide와 iron hydroxide가 생성되어(Akbari et al., 2016) 과황산의 활성화가 이루어지지 않는 것으로 판단할 수 있다.
|
Fig. 1 Effect of various iron activators on the persulfate oxidation of PAHs in the artificially contaminated soil. PAH:PS:Fe=1:100:10 (mol ratio) TCFOKM: (a) ANE, (b) DBF and (c) FLE, 1st-order fitting model: (d) ANE, (e) DBF and (f) FLE. |
|
Fig. 2 Effect of various iron activators on the persulfate oxidation of ΣPAHs in the field-contaminated soil (ΣPAHs = [ANE] + [DBF] + [FLE]). ΣPAHs:PS:Fe=1:100:10 (mol ratio) (a) TCFOKM and (b) 1st-order kinetic model. |
|
Fig. 3 Effect of hydroxylamine addition on the iron-activated persulfate oxidation of PAHs in the artificially polluted soil. Reaction time = 4 hr, PAH:PS:Fe = 1:100:10 (mol ratio) (a) ANE, (b) DBF and (c) FLE. |
|
Fig. 4 Effect of hydroxylamine addition on the iron-activated persulfate oxidation of ΣPAHs in the field-contaminated soil. Reaction time = 4 hr, ΣPAHs:PS:Fe = 1:100:10 (mol ratio). |
|
Fig. 5 Effect of various EDTA concentration on the ironactivated persulfate oxidation of PAHs in the artificially contaminated soil. Reaction time = 4 hr, PAH:PS:Fe = 1:100:10 (mol ratio). (a) ANE, (b) DBF and (c) FLE. |
|
Fig. 6 Effect of various pyrophosphate concentration on the ironactivated persulfate oxidation in the artificially contaminated soil. Reaction time = 4 hr, PAH:PS:Fe = 1:100:10 (mol ratio). (a) ANE, (b) DBF and (c) FLE. |
|
Fig. 7 Effect of chelating agent addition on the iron-activated persulfate oxidation of PAHs in the field-contaminated soil. Reaction time = 4 hr, ΣPAHs:PS:Fe = 1:100:10 (mol ratio). Effects of (a) EDTA and (b) PP concentration. |
|
Table 4 TCFOKM parameters for the iron-activated persulfate oxidation of PAHs in the artificially contaminated soil |
|
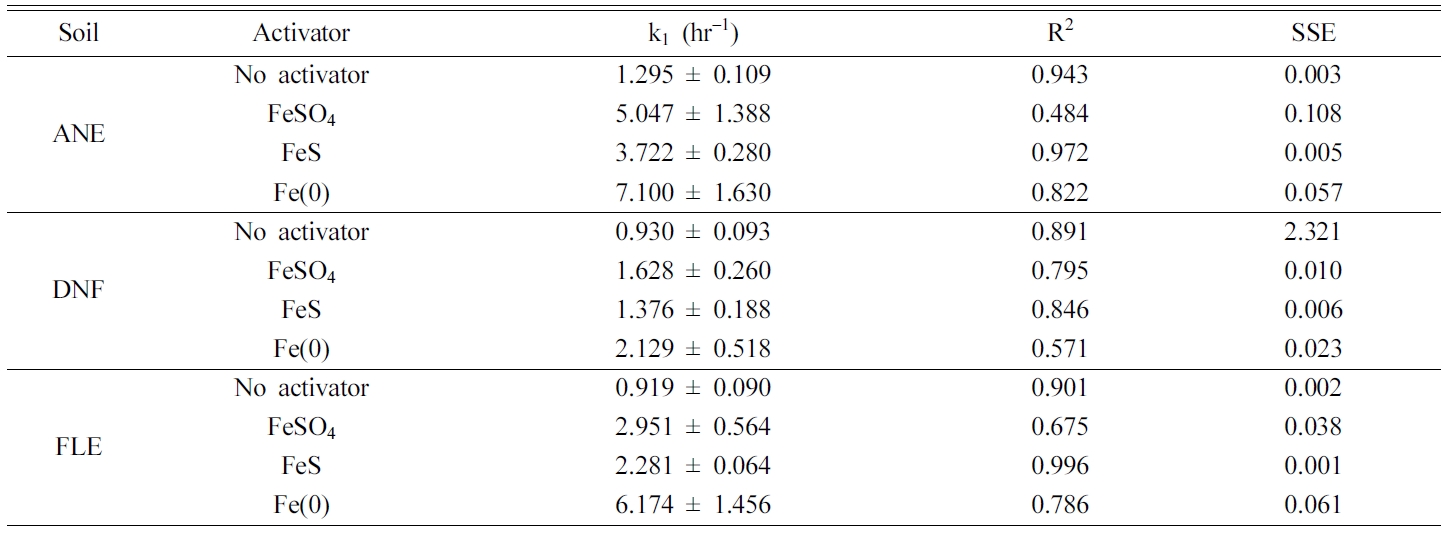
Table 5 First-order kinetic model parameters for the iron-activated persulfate oxidation of PAH in the artificially contaminated soil |
|
Table 6 TCFOKM and first-order kinetic model parameters for the iron-activated persulfate oxidation of ΣPAHs in the field-contaminated soil |
본 연구에서는 PAHs(ANE, DBF, FLE)로 각각 오염시킨 인공오염토양과 PAHs로 오염된 현장오염토양의 과황산 산화 시 세종류의
철 활성화제(FeSO4, FeS, Fe(0))에 대한 산화 속도와 효율을 평가하였으며, 철의 이용성을 증가시키기 위해 주입한
환원제, 하이드록실아민과 킬레이트제 첨가의 영향을 살펴보았다.
인공오염토양 및 현장오염 토양 모두에서 Fe(0)를 주입하였을 때 가장 제거효율이 높게 나타났으며 과황산의 소모 또한 가장 높았다.
각각의 제거효율은 ANE 인공오염토양의 경우 Fe(0)92.7%) > FeSO4(80.6%) > FeS(78.8%),
DBF 인공오염토양의 경우 Fe(0)50.2%) > FeS(48.7%) >
FeSO4(46.7%), FLE 인공오염토양의 경우 Fe(0)(80.6%) > FeS(74.1%) > FeSO4(58.2%)로
나타났다. 현장오염토양의 경우 ΣPAHs 농도를 기준으로 Fe(0)(73.0%) > FeS (60.7%) > FeSO4(59.2%)의
순으로 나타났다. Fe2+ 용액 형태로 주입될 경우 Fe3+로의 산화가 빨라 소비가 빠르고, Fe(0)와 FeS와
같이 파우더 형태로 주입될 경우 Fe2+의 방출이 느리게 진행되므로 지속적인 반응을 유도할 수 있어 제거효율이 더 높게 나타난다.
철의 이용성을 증가시키기 위한 추가 인자들 중 환원제인 하이드록실아민의 경우 모든 대상 토양에서 제거효율이 증가하는 결과를 보였으며,
인공오염토양의 경우 제거효율 증가율이 4.4~16.2%로 나타났으며, 현장오염토양에서 제거효율 증가율은 5.4~17.6%로 나타났다. 킬레이트제로는
유기 킬레이트제로 EDTA, 무기 킬레이트제로 pyrophosphate(PP)를 주입하였다. 킬레이트제 주입시 Fe2+에서
Fe3+로의 빠른 전환을 막는 효과가 있어 주입 결과 인공오염토양에서는 제거효율이 상승하였으나 PAH:PS: Fe:EDTA(or pyrophosphate) 몰비 1:100:10:10으로 고농도로 주입될 경우 과량의 EDTA가 PAH와 경쟁하거나
pyrophosphate(PP)가 주입되어 토양의 pH가 상승함으로써 산화효율을 감소시키는 결과가 나타났다. 현장오염토양의 경우 킬레이트 주입시
제거효율이 감소하는 것으로 나타났으며 이는 pH의 상승으로 인해 iron oxide와 iron hydroixde가 생성되어 과황산 활성화가 저해됨에
따라 제거효율이 감소하는 것을 알 수 있었다.
본 결과물은 환경부의 재원으로 한국환경산업기술원의 지중환경오염위해관리기술개발사업의 지원을 받아 연구되었습니다(2019002480005).
- 1. Akbari, S., Ghanbari, F., and Moradi, M., 2016, Bisphenol A degradation in aqueous solutions by electrogenerated ferrous ion acti-vated ozone, hydrogen peroxide and persulfate: Applying low current density for oxidation mechanism, Chem. Eng. J., 294, 298-307.
-

- 2. Brinch, U.C., Ekelund, F., and Jacobsen, C.S., 2002, Method for spiking soil samples with organic compounds (PAHs). Appl. Evi-ronm. Mcrobiol., 68(4), 1808-1816.
-

- 3. Burgress, A.E. and Davidson, J.C., 2012, A kinetic-equilibrium study of a triiodide concentration maximum formed by the persul-fate-iodide reaction, J. Chem. Educ., 89(6), 814-816.
-

- 4. Chen, C.-F., Binh, N.T., Chen, C.-W., and Dong, C.-D., 2015, Removal of polycyclic aromatic hydrocarbons from sediments using sodium persulfate activated by temperature and nanoscale zero-valent iron, J. Air Waste Manag., 65(4), 375-383.
-

- 5. Chen, F., Tan, M., Ma. J., Li, G., and Qu, J., 2016, Restoration of manufactured gas plant site soil through combined ultra-sound-assisted soil washing and bioaugmentation, Chemosphere, 146, 289-299.
-

- 6. Chen, H., Zhang, Z., Feng, M., Liu, W., Wang, W., Yang, Q., and Hu, Y., 2017, Degradation of 2,4-dichlorophenoxyacetic acid in water by persulfate activated with FeS (mackinawite), Chem. Eng. J., 313, 498-507.
-

- 7. Cornellison, G., Hassell, K.A., van Noorst, P.C. M., Kraaij, R., van Erkeren, P.J., Dijkema, C., Dejager, P.A., and Govers, H.A.J., 2000, Slow desorption of PCBs and chlorobenzenes from soils and sediments: Relations with sorbent and sorbate characteristics, Environ. Pollut., 108(1), 69-80.
-

- 8. Cornellison, G., Rigterink, H., Vrind, B.A., Tenhulscher, D.Th.E. M., Ferdinary, M.M.A., and Vannoorst, P.C.M., 1997, Two-stage desorption kinetics and in situ partitioning of hexachlorobenzene and dichlorobenzenes in a contaminant sediment, Chemosphere, 35(10), 2405-2416.
-

- 9. Dong, H., He, Q., Zeng, G., Tang, L., Zhang, L., Xie, Y., Zeng, Y., and Zhao, F., 2017, Degradation of trichloroethene by nanoscale zero-valent iron (nZVI) and nZVI activated persulfate in the absence and presence of EDTA, Chem. Eng. J., 316, 410-418.
-

- 10. Fan, J., Gu, L., Wu, D., and Liu, Z., 2018, Mackinawite (FeS) activation of persulfate for the degradation of p-chloroaniline: Surface reaction mechanism and sulfur-mediated cycling of iron species, Chem. Eng. J., 333, 657-664.
-

- 11. Han, D., Wan, J., Ma, Y., Wang, Y., Huang, M., Chen, Y., Li, D., Guan, Z., and Li, Y., 2014, Enhanced decolorization of orange G in a Fe(II)-EDDS activated persulfate process by accelerating the regeneration of ferrous iron with hydroxylamine, Chem. Eng. J., 256, 316-323.
-

- 12. Idowu, O., Semple, K.T., Ramadass, K., O¡¯Connor, W., Hansbro, P., and Thanvamani, P., 2020, Analysis of polycyclic aromatic hydrocarbons (PAHs) and their polar derivatives in soils of an industrial heritage city of Australia, Sci. Total Environ., 699, 134303.
-

- 13. Kim, C., Ahn, J.-Y., Kim, T.Y., Shin, W.S., and Hwang, I., 2018, Activation of persulfate by nanosized zero-valent iron(NZVI): Mechanisms and transformation products of NZVI, Environ. Sci. Technol., 52(6), 3625-3633.
-

- 14. Kusmierek, K., Swiatkowski, A., and Dabek, L., 2015, Oxidative degradation of 2-chlorophenol by persulfate, J. Ecol. Eng., 16, 115-123.
-

- 15. Lei, Y., Zhang, H., Wang, J., and Ai, J., 2015, Rapid and continuous oxidation of organic contaminants with ascorbic acid and a mod-ified ferric/persulfate system, Chem. Eng. J., 270, 73-79.
-

- 16. Li, H., Wan, J., Ma, Y., Huang, M., Wang, Y., and Chen, Y., 2014, New insights into the role of zero-valent iron surface oxidation layers in persulfate oxidation of dibutyl phthalate solutions, Chem. Eng. J., 250, 137-147.
-

- 17. Liang, C., Bruell, C.J., Marley, M.C., and Sperry, K.L., 2004, Persulfate oxidation for in situ remediation of TCE. I. Activated by ferrous ion with and without a persulfate–thiosulfate redox couple, Chemosphere, 55(9), 1213-1223.
-

- 18. Ministry of Environment, 2009, A basic plant for soil conservation, Sejong, Korea.
- 19. Ministry of Environment, 2018, Soil environment conservation act, Sejong, Korea
- 20. Neta, P. and Huie, R.E., 1998, Rate constants for reactions of inorganic radicals in aqueous solution, J. Phys. Chem. Ref. Data, 17, 1027-1284.
-

- 21. Oh, S., Wang, Q., Shin, W.S., and Song, D.-I., 2013, Sorption and desorption kinetics of PAHs in coastal sediment, Korean J. Chem. Eng., 30, 145-153.
-

- 22. Rastogi, A., Al-Abed, S.R., and Dionysiou, D.D., 2009, Effect of inorganic, synthetic and naturally occurring chelating agents on Fe(II) mediated advanced oxidation of chlorophenols, Water Res., 43(3), 684-694.
-

- 23. Stout, S.A. and Brey, A.P., 2019, Appraisal of coal- and coke-derived wastes in soils near a former manufactured gas plant, Jackson-ville, Florida, Int. J. Coal Geol., 213, 103265.
-

- 24. Sun, H., Zhou, G., Liu, S., Ang, H.M., Tadé, M.O., and Wang, S., 2012, Nano-Fe0 encapsulated in microcarbon spheres: synthesis, characterization, and environmental applications, ACS Appl. Mater. Interf., 4(11), 6235-6241.
-

- 25. Tan, C., Gao, N., Chu, W., Li, C., and Templeton, M.R., 2012, Degradation of diuron by persulfate activated with ferrous ion, Sep. Purif. Technol., 95, 44-48.
-

- 26. USEPA, 2007, Method 3545A: Pressurized Fluid Extraction (PFE), Test Methods for the Evaluation of Solid Waste: Laboratory Manual Physical Chemical Methods. SW 846, Washington, DC, USA, Office of Solid Waste.
- 27. USEPA, 2014, Method 8270D: Semivolatile Organic Compounds by Gas Chromatography/Mass Spectrometry, Test Methods for the Evaluation of Solid Waste: Laboratory Manual Physical Chemical Methods. SW 846, Washington, DC, USA, Office of Solid Waste.
- 28. Venny, Gan, S., and Ng, H.K., 2012, Inorganic chelated modified-Fenton treatment of polycyclic aromatic hydrocar-bon(PAH)-contaminated soils. Chem. Eng. J., 180(1), 1-8
-

- 29. White, P.A. and Claxton, L.D., 2004, Mutagens in contaminated soil: a review. Mutat. Res., 567(2-3), 227-345.
-

- 30. Wu, X., Gu, X., Lu, S., Qiu, Z., Sui, Q., Zhang, X., Miao, Z., and Xu, M., 2015, Strong enhancement of trichloroethylene degrada-tion in ferrous ion activated persulfate system by promoting ferric and ferrous ion cycles with hydroxylamine, Sep. Purif. Technol., 147, 186-193.
-

- 31. Zou, J., Ma, J., Chen, L., Li, X., Guan, Y., Xie, P., and Pan, C., 2013, Rapid acceleration of ferrous iron/peroxymonosulfate oxidation of organic pollutants by promoting Fe(III)/Fe(II) cycle with hydroxylamine, Environ. Sci. Technol., 47(20), 11685-11692.
-

 This Article
This Article
-
2020; 25(1): 62-73
Published on Mar 31, 2020
- 10.7857/JSGE.2020.25.1.062
- Received on Jan 17, 2020
- Revised on Feb 12, 2020
- Accepted on Mar 17, 2020
 Services
Services
Shared
 Correspondence to
Correspondence to
- Park·Won Sik Shin
-
School of Architectural, Civil, Environmental and Energy Engineering, Kyungpook National University, Daegu 41566, Korea
- E-mail: wshin@knu.ac.kr