- Feasibility Study of Activation of Persulfate by Fe(II) for Phenol Contaminated Sediment
Jae Hyun Jo·Seong-Eun Yoon·Jae-Moon Kim·Inseong Hwang*
Department of Civil and Environmental Engineering, Pusan National University, Pusan, Korea
- Fe(II)에 의해 활성화된 과황산을 이용한 페놀 오염 퇴적물 처리 타당성 평가
조재현·윤성은·김재문·황인성*
부산대학교 사회환경시스템공학과
Persulfate-based advanced oxidation processes (AOPs) can oxidize various
organic pollutants. In this study, persulfate/Fe(II) system was utilized in
phenol removal, and the effect of various organic and inorganic chelators on
Fe(II)-medicated persulfate activation was investigated. The feasibility of
persulfate/Fe(II)/chelator in cleanup of phenol-contaminated sediment was
confirmed through toxicity assessment. In persulfate/Fe(II) conditions,
the rate and extent of phenol removal increased in proportion to persulfate
concentration. In chelator injection condition, the rate of phenol removal was
inversely proportional to chelator concentration when it was injected above
optimum ratio. Thiosulfate showed greater chelation tendency with persulfate
than citrate and interfered with persulfate access to Fe(II), making the latter
a more suitable chelator for enhancing persulfate activation. In contaminated
clay sediment condition, 100% phenol removal was obtained within an hour
without chelator, with the removal rate increased up to four times as compared
to the rate with chelator addition. A clay sediment toxicity assessment at
persulfate:Fe(II):phenol 20:10:1 ratio indicated 71.3% toxicity reduction with
100% phenol removal efficiency. Therefore, persulfate/Fe(II) system
demonstrated its potential utility in toxicity reduction and cleanup of organic
contaminants in sediments.
Keywords: Activation, Chelator, Persulfate, Phenol, Sediment
산업시설에서 하천으로 배출되는 각종 유기오염물질은 강의 흐름에 따라 이동, 확산을 거쳐 최종적으로 퇴적물 내 침적이 이루어지면서 퇴적물을
오염시킨다. 오염된 퇴적물은 수중으로 재용출 되면서 하천 생태계를 오염시키고, 생물농축과정을 거쳐 최종적으로 인간에게 악영향을 미칠 수 있기 때문에(Kim
et al., 2009) 오염된 퇴적물의 처리가 필요하다. 국내에서 오염된 퇴적물을 처리하는 방법으로 오염물질의 용출을 억제하는 현장처리방법과
오염된 퇴적물을 제거하는 준설 방법 등이 존재한다(환경부, 2006). 현장처리방법인 현장피복은 오염물질이 퇴적물 내 여전히 존재하기 때문에 사고
또는 재해 발생 시 오염물질이 재부유하는 한계점을 가지므로 오염된 퇴적물을 직접적으로 제거하는 준설 방법이 주로 사용되지만, 고농도의 오염물질이
포함된 퇴적물은 매립 또는 재활용이 어려워 전처리 공정이 필요하다(한국건설기술연구원, 2003). 따라서, 오염된 퇴적물을 대상으로 고도산화처리기술을
적용하여 오염물질을 무해화하기 위한 연구가 진행 중이다.
과황산 공정은 넓은 pH 범위에서 적용이 가능하고 열, 전기, 전이 금속 등에 의해 다른 산화제에 비해 오염물질에 대하여 선택성이 낮은
황산라디칼을 생성하면서 대상오염물질을 포함한 중간생성물을 완전 분해시킬 수 있는 장점을 가진 고도산화처리기술이다. 일반적으로 과황산 활성화제는
잠재 독성이 없는 Fe(II)를 주로 사용한다(Siegrist et al., 2011).
Fe(II)을 이용한 과황산 공정은 주로 초기 빠른 반응속도의 1단계, 이후 느린 반응 속도의 2단계 구간이 생성된다. 이 구간의
1단계는 초기 Fe(II)에 의해 과황산이 빠르게 활성화되는 구간(식 1), 이후 2단계는 과황산과 유기물에 의한 Fe(III) 환원(식
2-3) 또는 유기물에 의한 과황산이 활성화되는 구간으로 구분된다(식 4-6)(Chen et al., 2003; Kim et al.,
2018; Fang et al., 2018; Li et al., 2019).

Citrate, Thiosulfate 같은 킬레이터는 Fe(II)과 착물을 형성하여 액상 내 Fe(II)의 안정성을 높인다. 따라서
과황산과 Chelator ≡ Fe(II) 착물에 의해
생성된 황산라디칼으로 오염물질 제거 효율을 향상시킬 수 있다(식 7-8). 또한 반응 후 생성된 Fe(III)은 킬레이터와 재결합되어 산화철 생성을
억제하고 과황산과 반응하여 Fe(II)로 환원되면서 대상물질을 제거시킬 수 있다(식9-10)(Han et al,. 2015; Kim et
al., 2018). 특히, pH가 높은 경우 킬레이터의 영향을 증대시킬 수 있다

Citrate: 같은 폴리카르복실산류의 유기 킬레이터와 과황산을 활성화시키면서 생성된 ∙CO2-, O2∙는 Fe(III)를 Fe(II)로 환원시켜 과황산과
Fe(II)의 반응을 촉진시킬 것으로 예상되어(식 11-14)(Wang et al., 2019), Fe(II)에 의한 과황산의 지속적인 활성화를
기대할 수 있다.

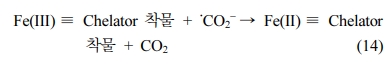
퇴적물 내의 유기물 또는 천연 금속 등은 과황산을 활성화 시킬 수 있다. 그러나 퇴적물 유기물의 함량에 따라 고농도의 퇴적물 유기물은
과황산 활성화를 저해할 가능성이 존재하며, 중·저농도의 퇴적물 유기물은 과황산 활성화를 촉진시킬 수 있기 때문에(Fang et al.
2018) 퇴적물 내 유기물 함량에 따라 과황산 활성화는 상이한 결과가 나타날 가능성이 있다. 또한 퇴적물 내 존재하는 탄산염과 유기산은 완충
특성으로 인하여 중성의 pH을 유지하면서(Kim et al. 2000), 퇴적물 내에서 Fe(II)는 용존 상태를 유지하기 어렵고(Li et
al., 2016) 퇴적물에 흡착되어 과황산과 Fe(II)의 반응성이 떨어질 것으로 판단된다(Piasecki et al., 2019). 따라서
퇴적물 존재하에 Fe(II)의 용존 상태를 유지하기 위해 킬레이터를 사용하여 과황산을 활성화 시키는 연구가 진행되었고(Liang et al.,
2004), 뿐만 아니라 킬레이터를 이용하여 퇴적물 내의 천연 금속을 추출하여 과황산 공정에 적용할 수 있을 것으로 보고되었다(Liang et
al., 2008).
앞서 서술한 바와 같이, 퇴적물 내의 대상오염물질을 제거하기 위해 Fe(II), 과황산 공정을 적용할 경우 퇴적물의 완충능과 유기물,
천연 금속 등의 복합적인 요소들로 인하여 과황산 공정을 이용한 오염물질 제거효율에 대해 상이한 결과가 도출될 수 있다.
본 연구는 최종적으로 오염된 퇴적물 내 Fe(II)에 의해 활성화된 과황산 주입을 이용한 처리 타당성 평가를 목적으로 한다. 목적을
달성하기 위해 킬레이터와 퇴적물 내의 복합적인 요소들을 이용하여 과황산과 Fe(II)의 반응을 용이하게 만듦으로써 오염물질 제거효율의 증대를 기대할
수 있기 때문에, 페놀을 대상 오염물질로 지정하여 액상에서 과황산과 Fe(II)의 몰 농도 비율을 조절하여 제거 효율을 확인하고 킬레이터를 주입하여
Fe(II)과 킬레이터의 주입 몰 농도 비율을 조절하여 최적 비율을 도출하였다. 또한 킬레이터의 종류를 변경하여 과황산 공정의 최적 킬레이터를
선정 후, 퇴적물 내에 과황산, Fe(II), 킬레이터를 주입하여 퇴적물 내 킬레이터 주입의 적합성을 판단하였다.
2.1. 시약 및 재료
대상 오염물질로는 페놀(99%, Sigma-Aldrich, USA)을 사용하였으며 과황산염으로 과황산나트륨(98%, Sigma-Aldrich, USA)을
사용하였다. 활성화제인 Fe(II)은 Iron(II) Sulfate Heptahydrate(99%, FUJIFILM, Japan)을 사용하였다.
킬레이터로는 Sodium Oxalate(99.5%, KANTO Chemical, Japan), Sodium
Thiosulfate(98%, Sigma-Aldrich, USA), Sodium citrate dihydrate(99%,
Sigma-Aldrich, USA)을 사용하였다. 퇴적물은 포항 형산강 연일대교 부근 수심 1 m의 퇴적물을 입경별로 균질 분리하여 시료로 사용하여,
해당 퇴적물의 성상은 Tabla 1에 표시하였다.
퇴적물을 입도 분류한 모래와 점토질 퇴적물의 유기물 함량은 각 2.73%와 5.37%로 국내 토양 유기물 함량이 평균 1.90% 임을
고려해보았을 때(Lee et al., 2016), 높은 유기물 함량이 확인되었다.
2.2. 실험 방법
2.2.1. 액상실험
모든 실험 반응조는 과황산염의 광분해를 최소화하기 위해 40 mL 보로실리케이트 엠버 유리병을 사용하여 각 용액의 stock solution을 10 ml씩 주입하여 실험을 진행하였다. 킬레이터 실험의 경우,
Fe(II)과 착물 형성이 뛰어난 유기 킬레이터 Citrate와 무기 킬레이터 Thiosulfate를 선정하여(Zhou et al.,
2013; Wang et al., 2019) 페놀, 킬레이터와 Fe(II)를 주입하여 20 rpm으로 15분 동안 교반하여 킬레이터와 Fe(II)를
충분히 반응시켜 킬레이터 ≡ Fe(II) 착물을 형성시킨
후 과황산을 주입하여 반응을 시작시켰다.
시료 채취는 0, 5, 15, 30, 60, 120, 240분마다 샘플을 채취하여 40% 에탄올과 인산 칼륨 완충액으로 혼합시킨 용액을
이용하여 1:1의 부피비로 주입하여 반응 종결(Quenching) 후 분석하였으며 과황산 농도와 Fe(II) 농도 비율 실험을 통해 주입 농도를
설정 후 킬레이터와 Fe(II)의 최적 주입 농도 비율을 결정하였다. 모든 실험에서 반응 시작부터 종결까지 pH는 2-3으로 유지되었다.
2.2.2. 퇴적물 실험
퇴적물을 이용한 실험의 경우 고액비 1/5로 하여 40 mL 보로실리케이트 갈색병 내 퇴적물 주입 후 액상과 동일한 실험 방법으로 페놀,
Citrate와 Fe(II)를 주입하여 20 rpm으로 15분 동안 교반하여 Citrate와 Fe(II)를 충분히 반응시켜 Citrate ≡ Fe(II) 착물을 형성시킨
후 과황산을 주입하여 반응을 시작시켰다. 각 용액의 stock solution을 주입 후 실험을 진행하고, 시료 채취하여 0.22 μm PVDF 실린지 필터를 이용해 퇴적물 여과 후 분석하였다.
처리 전 후 페놀 오염 퇴적물는 DCM을 이용하여 페놀을 추출하여 증류수에 희석하여 독성평가 액상 표준 생물 ‘물벼룩(D.
magna)’을 이용하여 10일간 퇴적물에 노출시켜 독성을 평가하였다(Ingersoll et al., 1995).
2.3. 분석 방법
페놀 농도는 UV검출기(SPD-20A, Shimadzu)과 C18 컬럼(Poroshell 120, 2.1* 100 mm, Agilent)이 장착된 고성능 액체크로마토그래피(LC-20AT,
Shimadzu)를 사용하여 측정하였다. 이동상은 0.2% Acetic acid(J.T. Baker, 99.7%)과 Methanol을
80:20으로 유량 0.15 ml/min으로 운전하여
275 nm의 파장에서 페놀을 검출하였다.
과황산염 농도는 5%의 NaHCO3(99%, Junsei, Japan)으로 완충된 요오드화칼륨(99.5%, Junsei,
Japan) 수용액을 발색시약으로 사용하여 발색시약 10 ml과 시료 0.25 ml를 첨가 후 교반하여 20분간 발색시켜 자외선-가시광선 분광광도계(Optizen POP,
Mecasys.Co)를 사용하여 400 nm에서 흡광도를 측정하였다.
2.4. 페놀 분해 모델링
선행 연구의 2구간 모델링 식을 이용하여 초기 Fe(II)의 과황산 활성화에 의한 빠른 반응을 1단계, 초기 이후 Fe(III) 환원에
의한 철의 촉매 반응과 퇴적물 내 유기물에 의한 느린 과황산 활성화 반응을 2단계 구간으로 선정하여 해석하였다(식 15)(Kim et al.,
2018).

식 (15)에서 f∙e-k1t는 1단계 반응 속도 항,
(1 - f)∙e-k2t는 2단계
반응 속도 항, [C]t는 시간에 따른 페놀의 농도, f는 제거된 페놀 농도비이며 k1과 k2는
각 항의 1단계, 2단계 반응 속도 상수이다.
3.1. 과황산과 Fe(II)
농도 비율에 따른 페놀 제거 평가
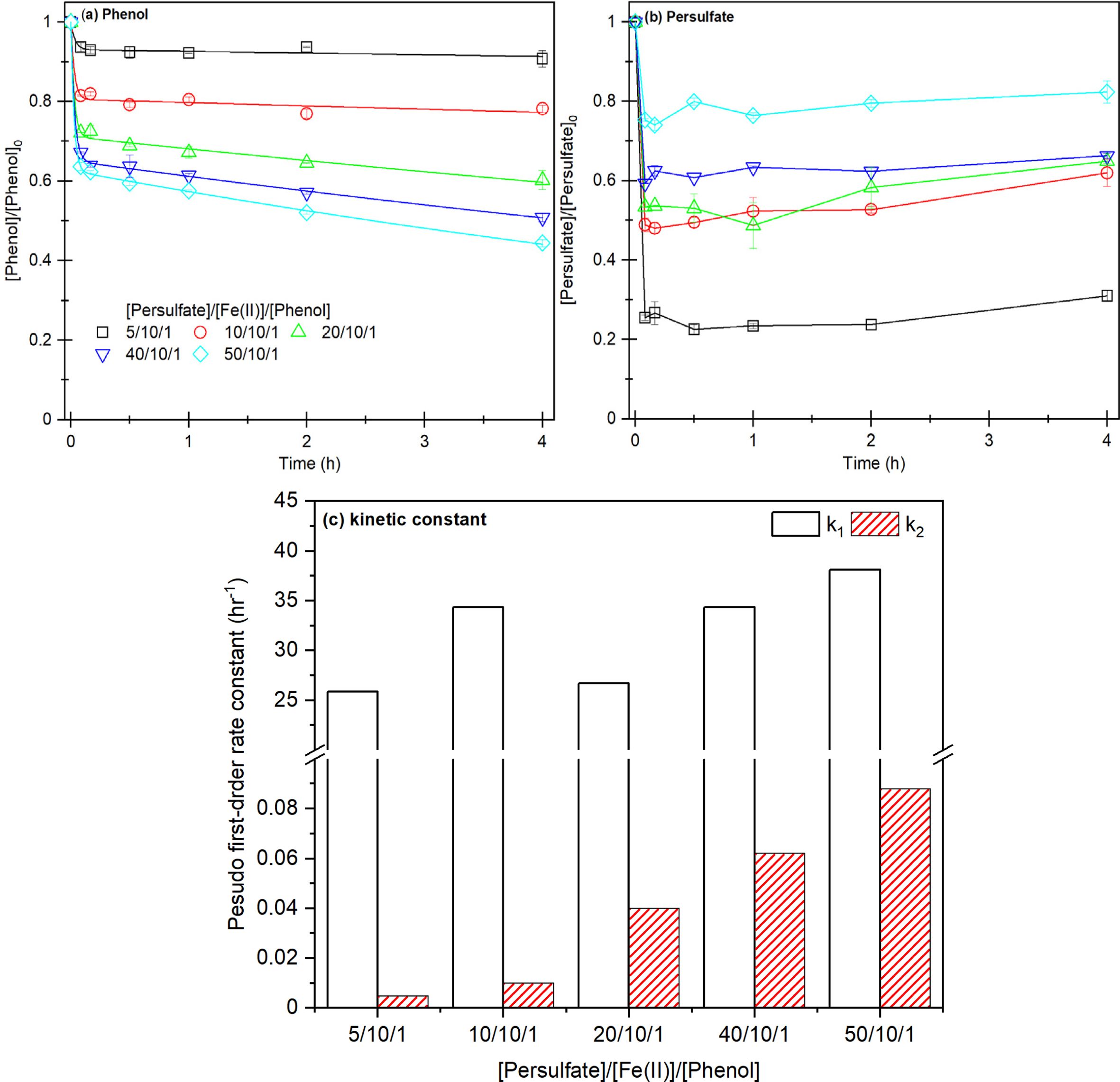
Fe(II) 농도를 10.6 mM으로 고정한 후 과황산 주입 농도를 변화시키면서 페놀 제거 효율과
과황산 소모율을 비교하였으며(Fig. 1), 모든 실험 조건에서
Fe(II)에 의한 빠른 과황산 활성화에 의한 1단계과 철 촉매 작용에 의한 2단계 구간이 확인되었으며, 2구간 모델링과 제거 효율은 높은 연관성이
확인되었다(Table 2).
실험 1의 1단계에서 약 10% 이하의 낮은 페놀 제거 효율을 보였고, 이후 반응성이 제한되는 경향이 확인되었고, 실험 2~5의 1단계에서
최대 40% 이상 제거된 후 최종적으로 2단계에서 최대 50% 이상의 페놀이 제거되는 것을 확인하였다(실험 5).
과황산 농도는 페놀 제거 경향과 비슷하게 모든 조건에서 초기에 빠르게 감소한 이후 반응성이 감소하였다(그림 1-b). 그러나 과황산
주입 농도가 높을수록 과황산 소모가적어지는 경향이 확인되었는데, 이러한 과황산 소모 경향은 주입되는 Fe(II)의 양은 동일하지만 반응 가능한
과황산의 양은 증가하기 때문에 과황산의 주입 농도가 증가할수록 과황산 소모율은 작아지는 것으로 판단된다.
1단계과 2단계 페놀 제거 속도를 모델링한 결과(Fig. 1-c, Table
2), 1단계에서 약 25~38 h-1의 높은 값을 확인되었으며,
과황산 농도 주입량이 높아질수록 1단계 제거 속도 상수 k1도 높아지고, 동일하게 2단계에서 0.0047 hr-1에서 0.088 hr-1까지 증가하면서 과황산 농도
주입량에 비례한다. 특히 실험 1에 비해 실험 5에서 약 19배까지 증가하는 결과를 확인하였다.
그러나, 실험1에서 초기에 Fe(II)에 의해 생성된 황산라디칼이 페놀을 제거하는 1단계 이후 고농도의 Fe(II)에 의해 과황산이
![]() 칭되면서 페놀과 반응성이 감소(식 16-17)하는 반면에, 실험2~5에서 1단계 이후(식
16), 2단계에서 철 촉매 반응이 일어나면서 페놀을 지속적으로 제거되는 것으로 판단된다(식18-19).
칭되면서 페놀과 반응성이 감소(식 16-17)하는 반면에, 실험2~5에서 1단계 이후(식
16), 2단계에서 철 촉매 반응이 일어나면서 페놀을 지속적으로 제거되는 것으로 판단된다(식18-19).
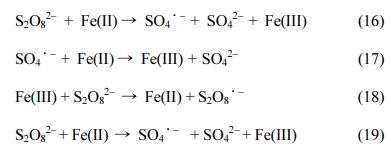
3.2. 킬레이터 첨가에 의한 페놀
제거능 향상 평가
3.2.1. Citrate 첨가
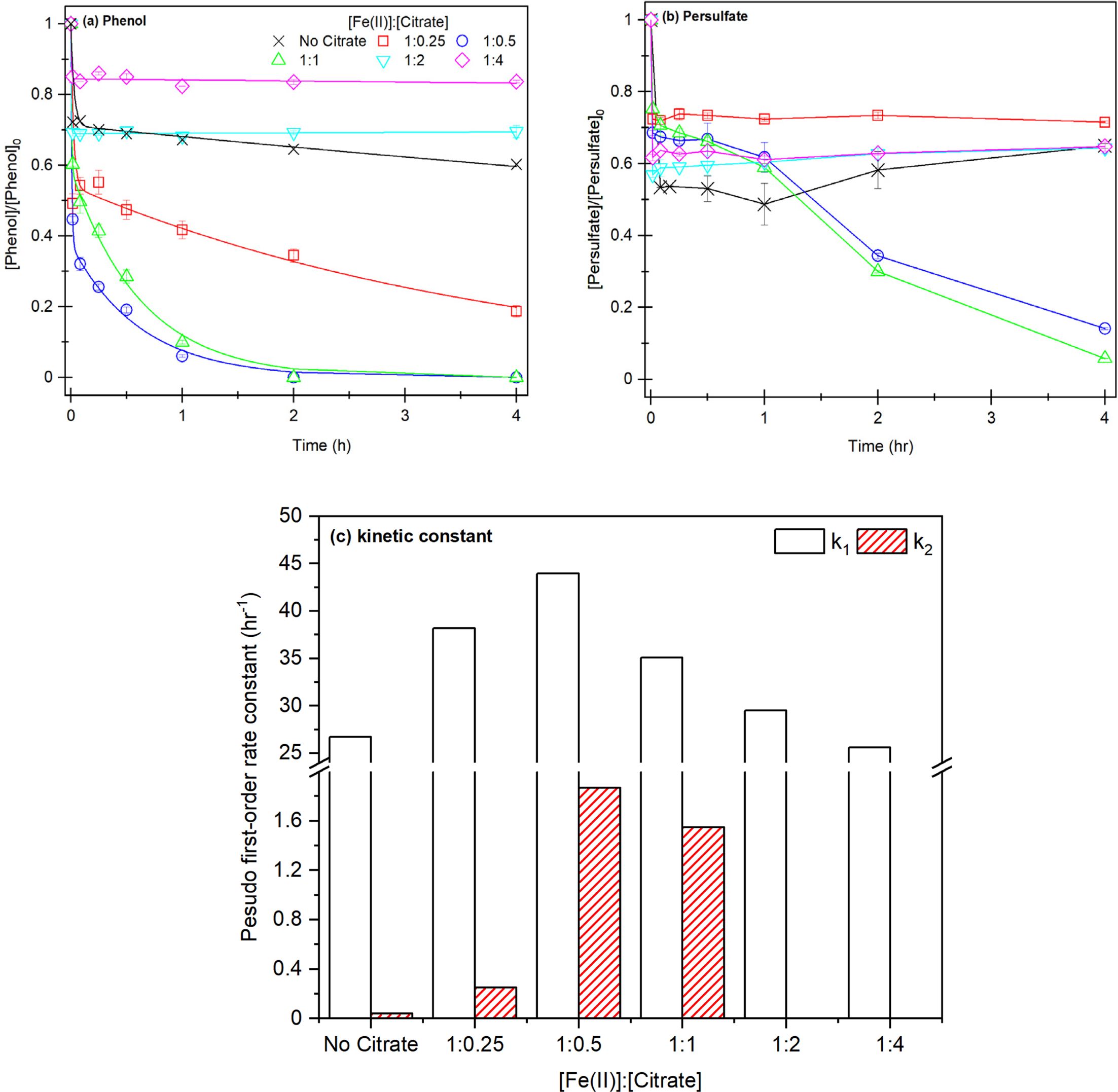
실험 3~5의 반응성은 크게 차이가 나지 않으므로 과황산이 비교적 적게 주입된 실험 3의 농도 조건 Persulfate: Fe(II):Phenol 20:10:1으로 Citrate 첨가 실험을 진행하였다(Fig. 2). 실험 7, 8에서 Citrate ≡ Fe(II) 착물과 과황산과
반응하면서 제거 효율이 최대 100%까지 크게 향상되지만, 실험 4,5에서 Citrate ≡ Fe(II) 착물과 과황산의
반응성은 크게 감소하면서 제거 효율이 약 20%까지 감소했다(실험 10).
Citrate 농도가 Fe(II)보다 높을 때, Citrate ≡ Fe(II)의 안정적인 착물
형성으로 인해 과황산의 Fe(II)에 대한 접근을 차단하여 Fe(II) ≡ Citrate 착물과 과황산
사이에 교환 반발력이 생기는 ‘입체 방해(Steric hindrance)’가 발생하기 때문에 과황산 활성화가 저하되고, 착물을 형성하지 못한
Fe(II)에 의해 1단계가 발생한 후 Fe(III) 생성이 저하되면서 2단계에서 철 촉매 반응이 발생하지 않아 반응이 제한되는 것으로 판단된다(Han,
et al., 2014; Han et al., 2015; Dong et al., 2017).
실험 6~10을 1단계, 2단계 제거 속도 모델링한 결과(Fig. 2-c, Table 2) 실험 6~8의 1단계에서 k1은 35~43 h-1으로 실험 3에 비해 높은
속도 상수가 확인되었으며, 특히 실험 7에서 1.5배 이상 높은 k1을 확인할 수 있었다.
2단계에서 0.25~1.87 h-1 실험 3에 비해 높은 속도
상수 범위가 확인되었고, 특히 실험 7의 1단계는 최대 47배 이상의 높은 속도 상수가 확인되었다. 1단계에서 킬레이터 ≡ Fe(II) 착물에 의해
Fe(II) 용존성이 높아지면서 과황산의 반응성이 증가하고, 2단계에서 Citrate에 의해 철 촉매 반응이 촉진되면서 지속적으로 과황산과 반응이
이루어지는 것으로 판단된다(식 20-23)((Wu et al., 2014; Dong et al., 2017; Wang et al.,
2019).
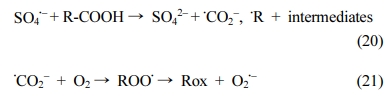

실험 9,10의 2단계에서 0.002-0.0025 hr-1으로 Citrate ≡ Fe(II) 착물과 과황산 사이에 ‘입체 방해(Steric Hindrance)’가 발생되면서 철 촉매 반응의 제한으로 반응이 크게 떨어지는
것으로 판단된다.
따라서, 본 연구의 20:10:1(과황산:Fe(II):페놀) 농도비에서 Fe(II)과 Citrate의 최적 농도비는 1:1 또는
1:0.5로 판단된다. 따라서, Citrate ≡ Fe(II) 착물을 이용하여
과황산 활성화는 과황산과 Fe(II)의 최적 농도비와 Citrate와 Fe(II)의 최적의 주입 농도를 도출해야할 필요가 있다.
3.2.2. Thiosulfate 첨가
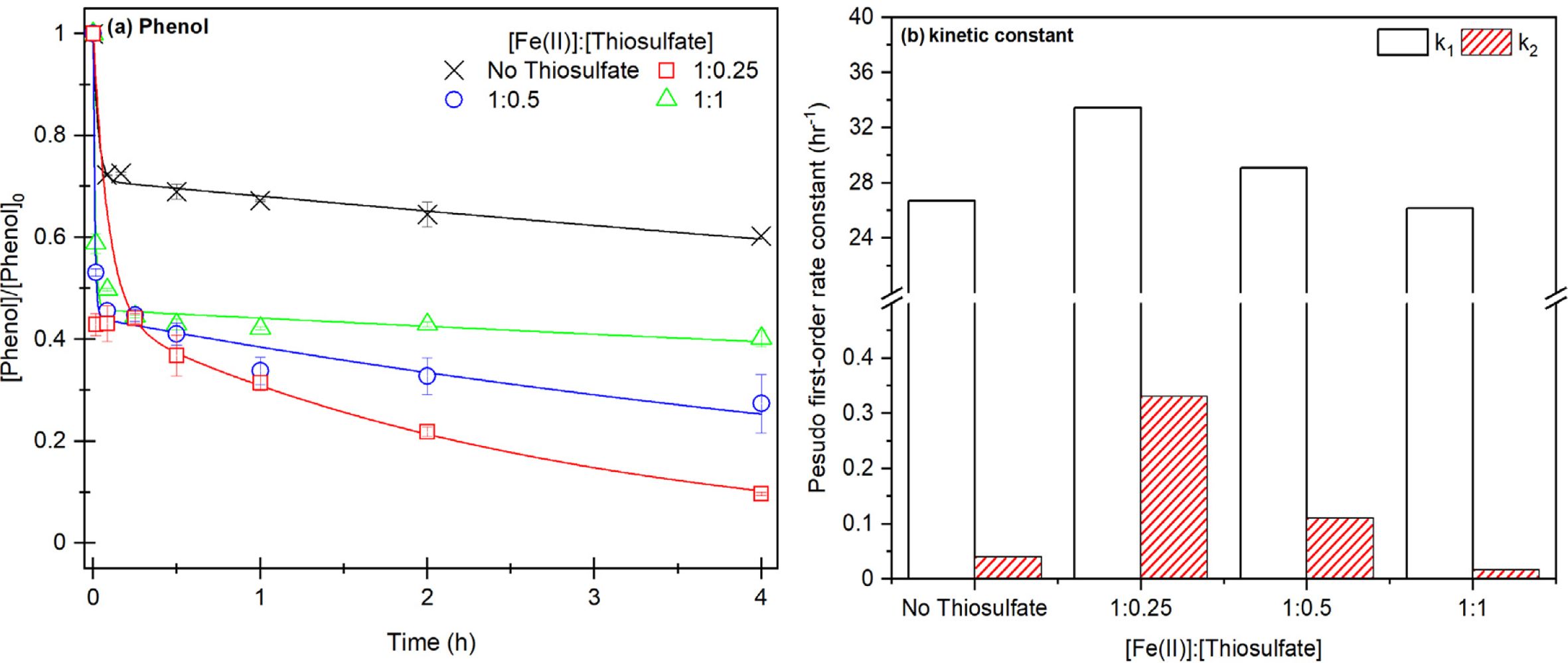
Fe(II)과 착물을 생성하면서 1단계 반응성을 높여주고, Fe(III)를 빠르게 환원시켜 2단계의 반응성을 높이기 위해 킬레이터와
환원제로 주로 사용되는 Thiosufate를 무기 킬레이터로 선정하여 실험을 진행하였다(Zhou et al., 2013) (Fig. 3).
Thiosulfate ≡ Fe(II) 주입 농도비는
Fe(II)과 Citrate 최적 주입 농도비(1:1, 1:0.5)와 동일한 농도비 실험 12,13에서 페놀 제거 효율이 감소한 반면에
Thiosulfate를 Fe(II)보다 적게 주입한 실험 11에서 최대 페놀 제거 효율을 확인할 수 있었다. 그러나 실험 11의 최종 제거 효율은
실험 7-8에 비해 낮은 제거 효율이 확인되었다. 최종 제거 효율에 대한 차이는 반응이 지속되어 Thiosulfate가 과황산 또는 황산 라디칼과
반응하면서 Thiosulfate 소모되고, 라디칼 ![]() 칭이 발생하면서 페놀 제거가 제한되는 것으로 판단된다.(식 23-24)(Riggs
et al., 1967; Idnelli et al., 1966).
칭이 발생하면서 페놀 제거가 제한되는 것으로 판단된다.(식 23-24)(Riggs
et al., 1967; Idnelli et al., 1966).
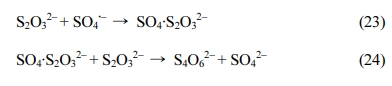
또한 이를 1단계, 2단계 제거 속도로 모델링한 결과(실험 3-b, Table 2), 실험 12,13의 1단계에서 실험 9, 10과 비슷한 속도가 도출되었으며 Citrate와 동일하게 Thiosulfate가 Fe(II)과 안정적인 착물을 형성되어,
Citrate보다 Thiosulfate가 Fe(II)과 착물 형성이 더 쉽게 일어나 동일한 농도의 Thiosulfate로 Citrate에 비해
Fe(II)과 착물을 쉽게 형성할 수 있는 것으로 판단된다. 그에 비해 2단계에서 실험 9, 10과 다르게 비교적 높은 k2가 확인되었는데, Thiosulfate가 Fe(III)를 환원시키면서 황산라디칼 반응이
지속되는 것으로 판단된다(Wu et al., 2015)
Fe(II)과 과황산 공정에서 Thiosulfate를 킬레이터로 사용할 경우, 1단계와 2단계 기작은 Citrate와 동일하게 발생하지만
Thiosulfate는 Citrate에 비해 더 적은 농도로 Fe(II)와 안정적인 착물이 생성되어 과황산 활성화를 저해하고 저농도의
Thiosulfate는 Fe(III)를 환원시켜 Fe(II) 생성이 촉진되지만, 과황산과 Thiosulfate가 과황산과 반응하여
Thiosulfate가 소모되면서 2단계가 제한되지만, Thiosulfate ≡ Fe(II)은 과황산 반응을
크게 향상시킬 수 있으므로 Thiosulfate와 Fe(II)의 적절한 주입 농도비에 대한 추가적인 연구가 필요하다.
3.3. 페놀 오염 퇴적물 처리
퇴적물 내 탄산염과 유기산 등에 의한 성분으로 중성의 pH를 유지하며 퇴적물 완충능에 의해 크게 변하지 않는다(Kim et al.,
2000). 중성의 pH에서 Fe(II)은 비교적 빠르게 산화되면서 과황산 활성화능을 저하시킬 수 있다. 그러나 본 실험에서 액상과
동일하게 Citrate ≡ Fe(II) 착물은 pH를
크게 감소시켜 초기 pH가 2~3으로 설정이 되었으므로 중성 pH에서의 Fe(II) 산화의 영향은 적을 것으로 예상되었다.
액상 실험에서 Citrate를 주입하지 않는 조건에 비해 Citrate ≡ Fe(II) 착물은 과황산을
활성화를 증가시키면서 2시간이내 페놀은 100% 제거됨을 확인하였다. 따라서, 액상 실험 결과를 바탕으로 퇴적물 내 Citrate를 주입하여 생성된
Citrate ≡ Fe(II) 착물을 이용하여
과황산 활성화를 증가시켜 오염된 퇴적물을 처리하고자 하였다.
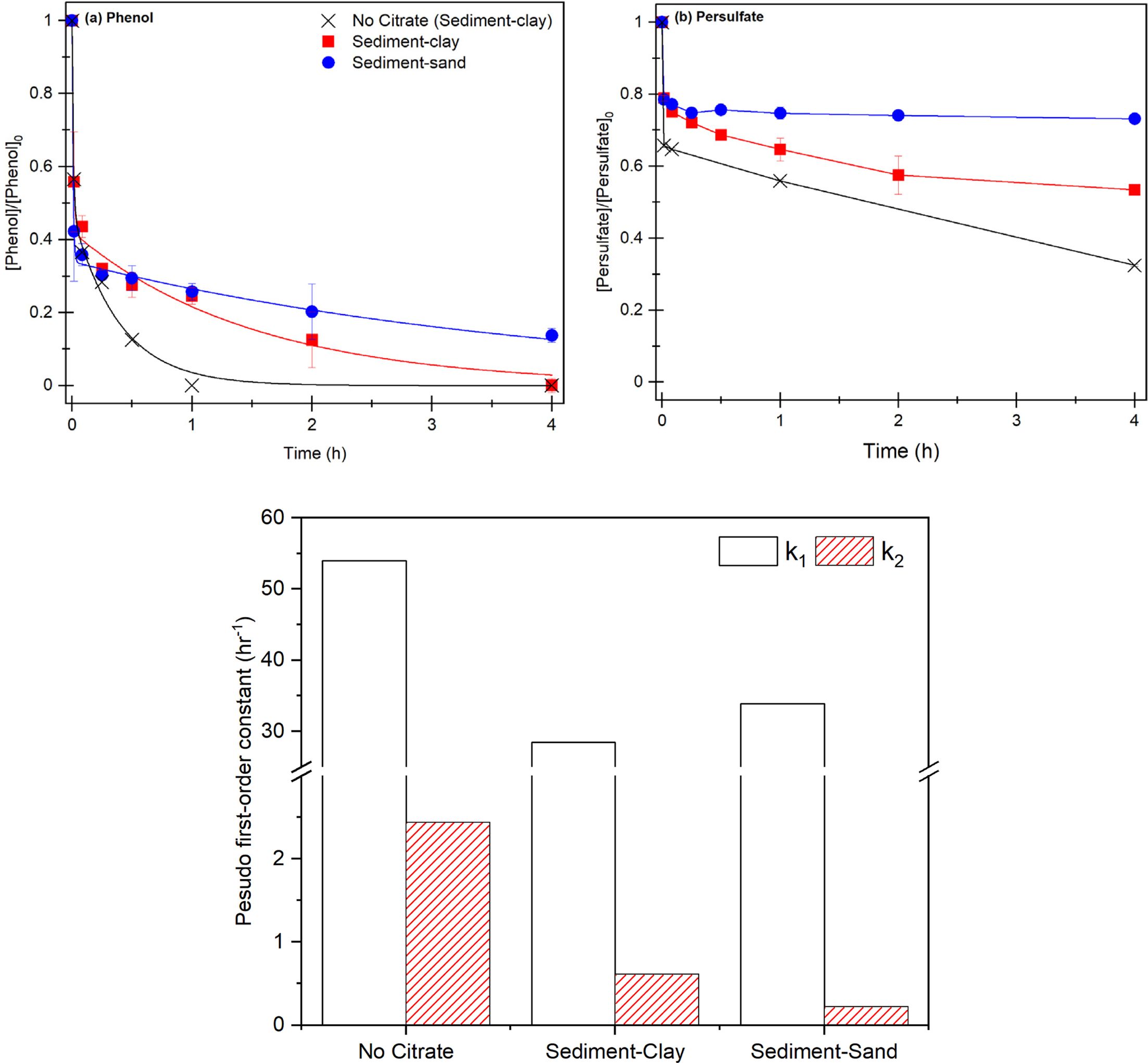
그 결과, 액상실험과 다르게 Citrate를 주입하지 않은 실험 15에서 1시간 이내 페놀은 100% 제거되고, Citrate 주입한
실험 15에서 1시간 이내에 페놀은 약 70% 제거되고, 4시간 이후에 100% 제거되었지만 큰 입자의 모래 퇴적물의 실험 16에서 4시간 이후에도
페놀은 완전히 제거되지 않았다(Fig. 4). 점토질의 오염된
퇴적물 내 Citrate ≡ Fe(II) 착물 주입은
오염 물질 처리 속도를 감소시키지만, 최종적으로 오염 퇴적물을 완전히 처리할 수 있음을 확인하였다. 모래 퇴적물과 점토질 퇴적물의 제거 효율 차이는
1단계에서 입자 크기와 관계없이 Citrate ≡ Fe(II) 착물에 의해 과황산이 활성화되지만 2단계에서 모래 퇴적물에 비해 입자 크기가 작아 표면적이 넓은 퇴적물 내 유기물질이 다량
분포해있어(Table 1) 유기물에 의해 과황산이 지속적으로 활성화 되어 오염물질을 제거하는 것으로 판단된다.
실험 15, 16의 각 1단계에서 33.88 h-1, 28.43 h-1으로 실험 16의 1단계
제거 속도가 더 높았지만 실험 15의 1단계와 큰 차이를 보이지 않았다. 그러나 이후 실험 15에서 2단계 제거 속도가 0.61 h-1으로 실험 16에 비해(0.22 h-1) 약 3배 증가하면서 제거
속도가 더 빨라진다. 또한 소모된 과황산의 제거 경향과 동일하게 1단계에서 실험 16의 과황산 소모가 더 크지만 2단계에서 실험 15에서 더 많은
과황산 소모가 일어났다(Fig. 4-b).
따라서, 퇴적물에 주입된 Fe(II)와 Citrate는 착물을 형성함과 동시에 유기물과 추가적으로 착물을 형성하면서 입체 방해로 인해
과황산 반응을 저해하지만, 퇴적물 유기물은 과황산과 반응하면서 황산라디칼을 생성함과 동시에 분해되고 추가적으로 입체 방해 가 저하되어 과황산과
Fe(II) 반응이 지속한다(식 25-30)(Yang et al., 2006; Chien et al., 2016).


그러나 실험 14의 각 단계에서 53.95 h-1, 2.34 h-1으로 실험 15, 16에 비해 높은 속도 상수와 과황산의 소모가 확인되었다. 1단계에서 퇴적물 유기물이 Fe(II)와 착물을 형성하여 킬레이터 역할을
수행하면서 페놀 제거 효율이 크게 증가하고, 이후 2단계에서 Fe(III) 환원을 동시에 유기물의 과황산 활성화에 의해 페놀 제거가 지속적으로
발생하는 것으로 판단된다(Himes et al., 1957; Karlsson et al., 2006, Liu et al., 2016).
오염된 퇴적물 처리 결과를 바탕으로 처리 효율이 가장 높은 실험 14를 기준으로 물벼룩(D.magna)를 이용하여 킬레이터 주입 없이
최적 농도의 Fe(II)와 과황산을 이용하여 페놀 오염 퇴적물을 처리하여 무해화 효율을 평가하였다(식 31).

그 결과, 처리 전 퇴적물의 TU 59244에서 과황산 처리 후 퇴적물의 TU는 17013으로 71.3%의 독성저감 효율을 확인하였다.
따라서 Fe(II)를 이용하여 과황산 활성화를 통하여 오염된 퇴적물 처리는 대상오염물질을 완전 분해함으로써 최종적으로 무해화가 이루어지면서 퇴적물
내 Fe(II)과 과황산 주입의 적용성이 확인되었다. 그러나, 퇴적물 또는 토양의 특성 상 지역마다 성상이 크게 달라지므로 대상 퇴적물의
Fe(II)과 과황산 적용성 평가를 할 필요가 있다.
|
Fig. 1 Result of phenol decompostion according to persulfate and Fe(II) ratio. (a) phenol removal efficiency, (b) persulfate consumption
rate, (c) two-compartment kinetic constant k1, k2, [PS]0 = 5.31~53.1 mM [Fe(II)]0 = 10.6 mM, [Phenol]0 = 1.06 mM. |
|
Fig. 2 Result of phenol decomposition according to Fe(II) and citrate injection concentration ratio. (a) phenol removal efficiency, (b)
persulfate consumption rate, (c) two-compartment kinetic constant k1, k2, [PS]0 = 21.24 mM, [Fe(II)]0 = 10.62 mM, [Citrate]0 = 2.65~42.4
mM, [Phenol]0 = 1.06 mM, Fe(II):Citrate = 1:0.25-1:4. |
|
Fig. 3 Result of phenol decomposition according to Fe(II) and thiosulfate injection concentration ratio (a) phenol removal efficiency, (b)
two-compartment kinetic constant k1, k2, ([PS]0 = 21.2 mM, [Fe(II)]0 = 10.6 mM, [Thiosulfate]0 = 2.65~10.6 mM, [Phenol]0 = 1.06 mM,
Fe(II):Thiosulfate = 1:0.25-1:1. |
|
Fig. 4 Result of contaminated sediment treatment. (a) phenol removal efficiency, (b) persulfate consumption rate, (c) two-compartment
kinetic constant k1, k2, [PS]0= 21.24 mM, [Fe(II)]0= 10.62 mM, [Citrate]0= 5.31 mM, [Phenol]0= 1.062 mM, S/L = 1/5, Fe(II): Chelators =
1:0.5. |
페놀로 오염된 퇴적물을 처리하기 위해 액상 내 Fe(II)과 과황산을 주입하여 최적 주입 농도 비율을 결정하고, 과황산과
Fe(II)의 반응성 향상을 위해 Citrate 또는 Thiosulfate을 주입하여 최적 주입 농도 비율 결정 후 과황산과 Fe(II)을 이용한
퇴적물 처리 타당성을 평가하였다.
모든 조건에서 Fe(II)에 의한 과황산의 빠른 활성화 구간을 1단계, 철 촉매 작용과 유기물에 의한 과황산의 느린 활성화 구간을
2단계로 선정하여 구분하였다. 1차 반응식을 이용하여 각각의 단계를 2구간 모델식으로 해석하였고, 모델링 결과는 페놀 제거 효율을 잘 표현한 것으로
확인되었다. Fe(II)/과황산의 1단계와 2단계의 속도 상수는 전반적으로 과황산 주입 농도에 비례하였다. 특히 가장 높은 제거 효율이 확인된
과황산:Fe(II):페놀 50:10:1 농도비의 1단계 제거속도는 가장 낮은 제거 효율이 확인된 5:10:1 농도비의 1단계 제거속도에 비해 약
1.5배 증가했지만, 50:10:1농도비의 2단계 제거속도는 5:10:1 농도비의 2단계 제거속도에 비해 18배 이상 증가했다.
Citrate와 Thiosulfate를 각각의 최적 Fe(II):킬레이터 주입 농도비 1:0.5, 1:0.25보다 고농도로 주입 시
제거 속도는 킬레이터 주입 농도에 반비례하는 결과가 확인되었다. Thiosulfate는 Citrate보다 킬레이팅능이 뛰어나
Citrate보다 낮은 농도로 과황산과 Fe(II)의 초기 반응을 제한할 수 있다. 저농도의 Thiosulfate는 Fe(II)과 반응이 제한되면서
과황산 활성화가 저하되므로 페놀 제거에 한계를 가지므로, Fe(II)보다 저농도로 주입되지만 100% 페놀 제거 효율이 확인된 Citrate를
과황산 활성화의 최적 킬레이터로 선정하였다.
오염된 점토질 퇴적물에서 Fe(II)/과황산은 1시간 이내 페놀을 100% 분해하였고 1단계와 2단계 페놀 제거 속도상수는 킬레이터
주입 조건보다 최대 4배 이상 제거 속도가 증가하였으므로, Fe(II)/과황산을 이용하여 오염된 퇴적물의 신속한 처리가 가능할 것으로 보인다.
모래와 점토질 퇴적물 내 킬레이터 주입 조건에서 1단계 속도상수는 각각 28.43 h-1, 33.88 h-1으로 모래 퇴적물에서 더
높은 속도상수가 확인되었지만, 2단계에서 각각 0.61 h-1, 0.33 h-1으로 점토질 퇴적물에서 속도상수는
약 3배 증가하면서 페놀은 점토질 퇴적물 조건에서 4시간이내 100% 분해되었다. 따라서, 모래 퇴적토에 비해 점토질 퇴적물에 포함된 고함량의
유기물은 Citrate ≡ Fe(II) 착물과 반응하여
과황산 활성화에 영향을 끼칠 것으로 판단된다.
본 연구에서 오염된 퇴적물이 1시간 이내 처리가 완료된 과황산:Fe(II):페놀 20:20:1의 농도비로 독성 평가를 진행하여 최종
무해화 결과를 확인하였을 때 71.3%의 독성저감 효율을 확인하였다. 따라서, 해당 지역의 오염된 퇴적물은 Fe(II)에 의해 활성화된 과황산을
이용하여 효율적으로 처리 가능할 수 있을 것으로 판단되지만 퇴적물의 특성 상 지역이나 환경에 따라 크게 상이하므로 각기 다른 환경의 퇴적물 특성을
확인하고 다른 환경의 퇴적물 내 Fe(II)/과황산에 대한 추가적인 연구가 필요하다.
이 과제는 부산대학교 기본연구지원사업(2년)에 의하여 연구되었음
- 1. Chen, J., Gu, B., Royer, R.A., and Burgos, W.D., 2003, The roles of natural organic matter in chemical and microbial reduction of ferric iron, The Sci. Total Env., 307(1-3), 167-178.
-

- 2. Dong, H., Qiang, Z., Hu, J., and Sans, C., 2017, Accelerated degradation of iopamidol in iron activated persulfate systems: Roles of complexing agents, Chem. Eng. J, 316, 288-295.
-

- 3. Fang, G., Chen, X., Wu, W., Liu, C., Dionysiou, D.D., Fan, T., Yujun W., Changyin Z., and Zhou, D., 2018, Mechanisms of Interac-tion between Persulfate and Soil Constituents: Activation, Free Radical Formation, Conversion, and Identification, Environ. Sci. Tecnol., 52(24), 14352-14361.
-

- 4. Han, D., Wan, J., Ma, Y., Wang, Y., Li, Y., Li, D., and Guan, Z., 2015, New insights into the role of organic chelating agents in Fe (II) activated persulfate processes., Chem. Eng. J., 269, 425-433.
-

- 5. House, D.A., 1962, Kinetics and mechanism of oxidations by peroxydisulfate, Chemical reviews, 62(3), 185-203.
-

- 6. Himes, Frank L., and Stanley A. Barber., 1957, Chelating ability of soil organic matter, Soil Sci Soc Am J, 21(4), 368-373.
-

- 7. Ingersoll, C.G., Brunson, E.L., Dwyer, F.J., Ankley, G.T., Benoit, D.A., Norberg‐King, T.J., Allen, G.A., Hoke, R.A., Landrum, P.F., and Winger, P.V., 1995, Toxicity and bioaccumulation of sediment‐associated contaminants using freshwater invertebrates: A review of methods and application, Environ. Toxi. Chem., 14(11), 1885-1894.
-

- 8. Kim, B.G., Jung, K.W., and Kim, H.J., 2009, A Study on the characteristics of sediment in suyeong River in: Division IWA., Busan Institute of Health and Environment, Annual Report, 154-167.
- 9. Kim, C., Ahn, J.Y., Kim, T.Y., Shin, W.S., and Hwang, I., 2018, Activation of persulfate by nanosized zero-valent iron (NZVI): mechanisms and transformation products of NZVI, Environ. Sci. Technol., 52(6), 3625-3633.
-

- 10. Kim, G.-H. and Kim, K.-H., 2000, Acid/Base Buffer Capacity of Clays, Journal of the Korean Geotechnical Society, 16(6), 97-103.
- 11. Kaiser, K. and Guggenberge, G., 2003, Mineral surfaces and soil organic matter, Europen J. Soil. Sci., 54(2), 219-236.
-

- 12. Karlsson, T., Persson, P., and Skyllberg, U., 2006., Complexation of Copper(II) in Organic Soils and in Dissolved Organic Matter – EXAFS evidence for chelate ring structures, Environ. Sci. Technol, 40(8), 2623-2628.
-

- 13. Korea institute of construction technology, 2003. Distribution survey of sediments and development technology for Enviromental dredging & reuse of dredged material in reservoir and stream.
- 14. Liang, C., Bruell, C.J., Marley, M.C., and Sperry, K.L., 2004, Persulfate oxidation for in situ remediation of TCE. II. Activated by chelated ferrous ion, Chemosphere, 55(9), 1225-1233.
-

- 15. Liang, C., Huang, C.F., and Chen, Y.J., 2008, Potential for activated persulfate degradation of BTEX contamination., Water Res., 42(15), 4091-4100.
-

- 16. Liang, C., Bruell, C.J., Marley, M.C., and Sperry, K.L., 2004, Persulfate oxidantion for in situ remediation of TCE. I. Activated by ferrous ion with and without a persulfate-thiosulfate redox couple, Chemosphere, 55, 1213-1223.
-

- 17. Liu, H., Bruton, T.A., Li, W., Buren, J.V., Prasse, C., Doyle, F. M., and Sedlak, D.L., (2016), Oxidation of benzene by persulfate in the presence of Fe (III)-and Mn (IV)-containing oxides: stoichiometric efficiency and transformation products, Environ. Sci. Technol. 50(2), 890-898.
-

- 18. Li, X., Wu, B., Zhang, Q., Xu, D., Liu, Y., Ma, F., Gu, Q., and Li, F, 2019., Mechanisms on the impacts of humic acids on persul-fate/Fe2+-based groundwater remdiation, Chem. Eng. J, 378, 122142.
-

- 19. Liu, Z., Guo, W., Han, X., Li, X., Zhang, K., and Qiao, Z., 2016, In situ remediation of ortho-nitrochlorobenzene in soil by dual oxi-dants (hydrogen peroxide/persulfate), Springer, 23(19), 19707- 19712.
-

- 20. Ministry of Environment, 2006, Final report on the development of comprehensive water environment evaluation research (III).
- 21. Piasecki, W., Szymanek, K., and Charmas, R., 2019, Fe2+ adsorption on iron oxide: the importance of the redox potential of the ad-sorption system., Springer, 25(3), 613-619.
-

- 22. Rastogi, A., Al-Abed, S. R., and Dionysiou, D.D., 2009, Effect of inorganic, synthetic and naturally occurring chelating agents on Fe (II) mediated advanced oxidation of chlorophenols, Water Res., 43(3), 684-694.
-

- 23. Siegrist, R.L., Crimi, M., and Simpkin, T.J. (Eds)., 2011, In Situ Chemical Oxidation for Groundwater Remediation. Chapter 4: fun-damentals Of ISCO using persulfate, Vol. 3, Springer.
- 24. Tan, C., Gao, N., Chu, W., Li, C., and Templeton, M.R., 2012, Degradation of diuron by persulfate activated with ferrous ion, Sep. Purif. Technol, 95, 44-48.
-

- 25. Wang, Z., Qiu, W., Pang, S., and Jiang, J., 2019, Effect of chelators on the production and nature of the reactive intermediates formed in Fe(II) activated peroxydisulfate and hydrogen peroxide processes., Water Res., 164, 114957.
-

- 26. Zhou, L., Zheng, W., Ji, Y., Zhang, J., Zeng, C., Zhang, Y., Wang, X., and Yang, X., 2013, Ferrous-activated persulfate oxidation of arsenic(III) and diuron in aquatic system, J. Hazard. Mater., 263, 422-430.
-

 This Article
This Article
-
2020; 25(4): 77-86
Published on Dec 31, 2020
- 10.7857/JSGE.2020.25.4.077
- Received on Nov 2, 2020
- Revised on Feb 2, 2020
- Accepted on Dec 14, 2020
 Services
Services
Shared
 Correspondence to
Correspondence to
- Inseong Hwang
-
Department of Civil and Environmental Engineering, Pusan National University, Pusan, Korea
- E-mail: ihwang@pusan.ac.kr