- Removal of 2,4-D by an Fe(II)/persulfate/Electrochemical Oxidation Process
Young Hwan Hyun·Jiyeon Choi·Won Sik Shin*
School of Architectural, Civil, Environmental and Energy Engineering, Kyungpook National University, Daegu 41566, Korea
- Fe(II)/과황산/전기화학적 산화 공정에 의한 2,4-D의 제거
현영환·최지연·신원식*
경북대학교 건설환경에너지공학부
This article is an open access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
The removal of 2,4-dichlorophenoxyacetic acid (2,4-D) in aqueous solution by coupled electro-oxidation and Fe(II) activated persulfate oxidation process was investigated. The electrochemical oxidation was performed using carbon sheet electrode and persulfate using Fe(II) ion as an activator. The oxidation efficiency was investigated by varying current density (2 - 10 mA/cm2), electrolyte (Na2SO4) concentration (10 - 100 mM), persulfate concentration (5 - 20 mM), and Fe(II) concentration (10 -20 mM). The 2,4-D removal efficiency was in the order of Fe(II) activated persulfate-assisted electrochemical oxidation (Fe(II)/PS/ECO, 91%) > persulfate-electrochemical oxidation (PS/ECO, 51%) > electro-oxidation (EO, 36%). The persulfate can be activated by electron transfer in PS/ECO system, however, the addition of Fe(II) as an activator enhanced 2,4-D degradation in the Fe(II)/PS/ECO system. The 2,4-D removal efficiency was not affected by the initial pHs (3 - 9). The presence of anions (Cl- and HCO3-) inhibited the 2,4-D removal in Fe(II)/PS/ECO system due to scavenging of sulfate radical. Scavenger experiment using tert-butyl alcohol (TBA) and methanol (MeOH) confirmed that although both sulfate (SO4•−) and hydroxyl (•OH) radicals existed in Fe(II)/PS/ECO system, hydroxyl radical (SO4•−) was the predominant radical.
Keywords: 2,4-D, Electrochemical oxidation, Ferrous, Herbcide, Persulfate
페녹시계 제초제인 2,4-D(2,4-dichlorophenoxyacetic acid)는 내분비계 교란물질로 식물 호르몬(auxin)과 같은 계열의 유기화합물질이다(Jaafarzadeh et al., 2018). 가격이 저렴하고, 효과가 좋아 전세계적으로 널리 사용되나 화학적 안정성과 잔류성으로 인하여 토양에 축적되거나 지하수 및 하천수로 유출되어 환경 문제를 유발한다. 2,4-D는 인간에 대한 신경 독성이 알려져 있고, 난분해성 물질로 자연상태에서 분해되거나 하수처리장에서 처리가 어렵다. 세계보건기구(WHO, World Health Organization)에서는 2,4-D를 인체 발암가능성 물질로 분류하였고(IARC, 2015), 국내에서도 먹는 물의 안정성을 확보하기 위하여 수질 기준 항목 이외에 “감시항목”을 정하여 운영하고 있는데 2,4-D를 감시 대상 물질로 관리하고 있다(MOE, 2019). 국내에서도 2015년 조사 결과에 따르면, 0.009~ 0.0664 μg/L 농도 범위로 검출되어(NIER, 2015) 잠재적 위험성이 있으므로 효과적인 제거 연구가 필요하다.
1990년대 후반에는 과산화수소(H2O2), 과망간산(per- manganate), 오존(O3), 과황산(persulfate) 등 강력한 산화제를 기반으로 하는 지중 화학적 산화기술(in-situ chemical oxidation, ISCO)이 효과적인 복원공법으로 많은 주목을 받았으나(Devi et al., 2016), 최근 난분해성 유기오염물질을 처리하는 기술 중 전기화학(Dargahi et al., 2018; Cai et al., 2020), 전기-펜톤(Brillas et al., 2004; Liu et al., 2007), 광촉매 산화(Fiorenza et al., 2019; Carvalho et al., 2020)와 같은 고도 산화 처리 방법에 대한 연구가 각광받고 있다. 전기산화 기술은 친환경적인 기술로 전극 표면에서 물분자 산화로 수산화 라디칼(hydroxyl radical)을 발생하는 원리로 양극 산화(anodic oxidation)로 잘 알려져있다(Jaafarzadeh et al., 2018). 효율이 뛰어난 전극을 이용한 전기 산화 연구에서 하이브리드 공법에 대한 연구로 연구 분야가 확대되고 있는 추세이다. Brillas et al. (2004)과 Cai et al.(2020)은 BDD(Boron-doped diamond) 전극을 이용한 양극 산화와 전기 펜톤 산화(electro-Fenton oxidation)로 2,4-D를 처리하는 연구를 수행하였으며, 약 90% 이상의 처리효율을 보였다. Birllas et al. (2007)는 Pt 전극 또는 BDD 전극과 UVA light를 이용한 광전기 펜톤(photoelectro-Fenton) 처리를 연구하였고, Oxone과 전기산화를 연계하여 2,4-D를 처리하는 연구(Jaafarzadeh et al., 2018)가 수행된 바 있다. 기존에 많이 연구된 산화제와 전기산화 기술을 연계한 전기화학적 산화 기술의 경우 처리 효율은 높아 효율적인 측면에서는 검증이 되었으나 연구되고 있는 전극들이 대부분 Pt, BDD 또는 개질된 graphite 전극으로 고가인 경우가 많아 현장에서 사용하기에 어려움이 있어 저비용, 고효율의 산화 기술 개발이 필요하다. 과황산(persulfate)은 기존의 산화제(과산화수소, 과망간산, 오존 등)와 비교하여 효과적인 산화제로 주목받고 있으며, 과황산 산화제는 oxidation reduction potential(ORP) 값이 2.01 V 이상의 강력한 산화제로서, 그 자체만으로도 산화력이 있으나 촉매와 반응시 SO4•− 라디칼을 형성하여 산화력이 2.6 V까지 증가되는 특징이 있다(Amasha et al., 2018). 전류에 의한 과황산 활성은 전자 이동을 통해 전극 표면에서 황산 라디칼을 생성함으로써 일어난다(Matzek et al., 2018). 일반적으로 과황산 활성화제로 많이 사용되는 철 이온은 전극과 과황산 사이에서 효과적인 산화/환원 매개체로의 역할을 수행할 수 있어 기존 철 활성화한 과황산 공정에서보다 철 활성화환 과황산 전기화학적 산화 공정에서의 오염물질 처리효율이 더 높게 나타나 효과적인 기술임을 알 수 있다(Long and Zhang, 2014).
본 연구에서는 과황산과 카본 전극을 이용한 전기화학적 산화 기술을 통하여 수계내 2,4-D의 처리 효율을 확인하였다. 전기 산화실험에서 전류밀도, 전해질 농도 영향 실험을 수행하였고, 산화 효율 증가를 위하여 산화제로 과황산, 추가 활성화제로 Fe(II)를 추가하였다. 이에 따른 과황산 농도, Fe(II) 농도, pH, 음이온 영향을 확인하여 최적 조건을 도출하였으며, Fe(II)로 활성화한 과황산 전기화학적 산화 실험의 주요 라디칼을 규명하였다.
2.1. 전기화학적 산화 실험 방법
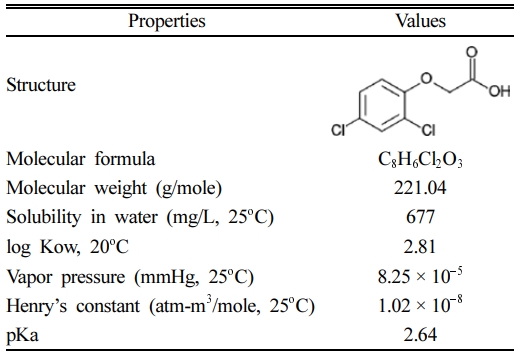
본 실험에서는 대상오염물질로 2,4-dichloropheno- xyacetic acid(2,4-D, C8H6Cl2O3, Sigma-Aldrich, 98.0%)를 사용하였으며, Table 1에 2,4-D의 물리화학적 특성을 정리하여 나타내었다. 실험에 사용된 용액은 ultrapure water(MilliporeSigmaTM SynergyTM Ultrapure Water Purifi- cation System, Thermo Fisher Scientific, USA)에 용해시켜 제조하였고, 대상오염물질인 2,4-D는 2 mM 농도의 stock 용액을 제조하여 사용하였다. 산화제로는 과황산칼륨(potassium persulfate, PS, K2S2O8, Duksan, 95%), 활성화제로 황산 제1철(ferrous sulfate heptahydrate, Fe(II), FeSO4·7H2O, Duksan, 98.0~102.0%)을 사용하였다.
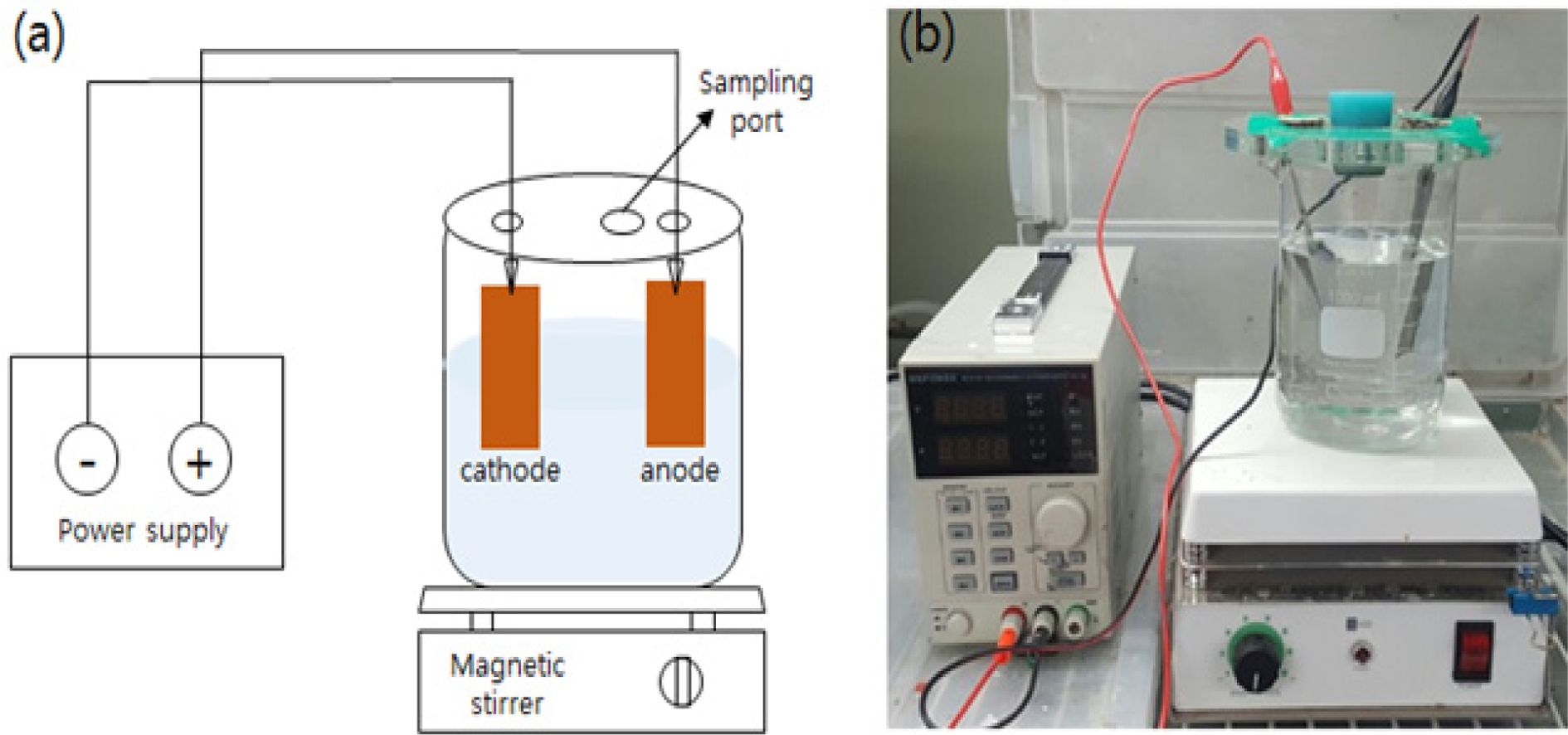
전기화학적 산화에 사용된 탄소 전극은 Toyo(Japan)로 부터 구매하여 5 × 10 × 0.1 cm 크기로 잘라 사용하였으며, 각 전극 간격은 8 cm로 하였다. 전원공급장치(MK-3005D, MK power, Korea)로 전류 밀도를 조절하였으며, 실험 모식도 및 실험 장치를 Fig. 1에 나타내었다. 모든 실험은 3회 반복으로 수행하였으며, 1 L 비커에 미리 제조하여 준비한 2,4-D stock 용액을 2,4-D 농도 1 mM이 되도록 주입하여 과황산 용액을 일정 농도가 되도록 주입한 후 총 반응용액의 부피가 1 L가 되도록 하였다. 전류밀도를 설정하고 기계식 교반기(HT-120DX, Daihan Scientific Co., Ltd., Korea)을 이용하여 200 rpm으로 교반하였다. 시간대별로 시료 5 mL를 채취하여 1 M n-butanol(CH3 (CH2)CH2OH, Yakuri, 98.0%)을 넣어 quenching(Chan et al., 2017)한 다음, 0.45-μm polytetrafluoroethylene syringe filter(PTFE membrane, Ф= 25 mm, Whatman, USA)로 여과 후 HPLC(high-performance liquid chromato- graphy, 2695 Alliance, Waters, USA)를 이용하여 2,4-D 농도를 분석하였다. 활성화제의 첨가 영향 실험에서는 앞선 전기화학적 산화 실험과 동일하게 2,4-D와 과황산, 전해질을 주입한 후 Fe(II)를 일정 농도가 되도록 주입한 후 실험을 수행하였다. 초기 pH 및 음이온 영향을 평가하기 위하여 2,4-D, 과황산, 전해질과 Fe(II)를 동일한 방법으로 주입한 다음, 초기 pH의 경우 0.1 N 염산(Hydro- chloric acid, HCl, Duksan, 35~37%)과 수산화나트륨(sodium hydroxide, NaOH, Duksan, 93%) 용액을 이용하여 초기 pH를 3, 5, 7, 9로 조절하여 실험하였고, 음이온 영향 실험의 경우 20 mM의 염화나트륨(NaCl, Duksan, 99%)과 탄산수소나트륨(NaHCO3, Duksan, 99.5%)를 주입하여 실험하였다.
과황산-전기화학적 산화 실험에서 라디칼 반응 기작을 규명하기 위하여 scavenger 실험을 수행하였다. tert-butyl alcohol(TBA, C4H10O, Daejung, 99.0%)를 hydroxyl radical (•OH)로, 메탄올(MeOH, CH3OH, Merck Company, LC grade)를 hydroxyl radical(•OH)과 sulfate radical(SO4•−)의 scavenger로 선정하여 실험하였다(Cai et al., 2018). 과황산-전기화학적 산화 실험과 동일하게 진행하되 probe/scavenger 시약 주입하여 실험 진행 후 2,4-D의 농도를 분석하여 평가하였다.
2.2. 분석 방법
2,4-D 농도는 HPLC(2695 Alliance, Waters, USA)를 이용하여 분석하였으며, 검출기는 UV(2487 Dual absor- bance detector, Waters, USA)를 사용하였다. 컬럼은 SunFire® C18(4.6 × 250 mm, 5 μm particle size, Waters, USA), 이동상 조건은 2상(two phase) 농도 구배로 acetonitrile(CH3CN, Merck, 99.9%)과 10%의 아세트산을 포함한 초순수(HPLC grade, Merck)의 비율을 75:25로 하였다. 유속은 0.7 mL/min, 시료 주입량은 20 μL, 파장 284 nm에서 측정하였다(Chen et al., 2017).
2.3. 산화 속도 모델
2,4-D의 산화 반응 속도는 다음의 유사 1차 속도 모델(pseudo-first-order kinetic model, PFOKM) 식 (1)로 표현할 수 있다.

여기서 C(t)는 반응시간 t(min)에서 산화 후 2,4-D의 농도(mmol/L), C0는 초기 2,4-D의 농도(mmol/L), k는 PFOKM의 반응속도 상수(min-1)이다. 각 모델의 매개변수는 Table Curve 2D®(Version 5.1, SPSS, Inc.)를 이용하여 결정하였다.
|
Fig. 1 Experimental equipment: (a) schematic diagram and (b) experimental apparatus |
3.1. 전기 산화시 전류밀도 영향
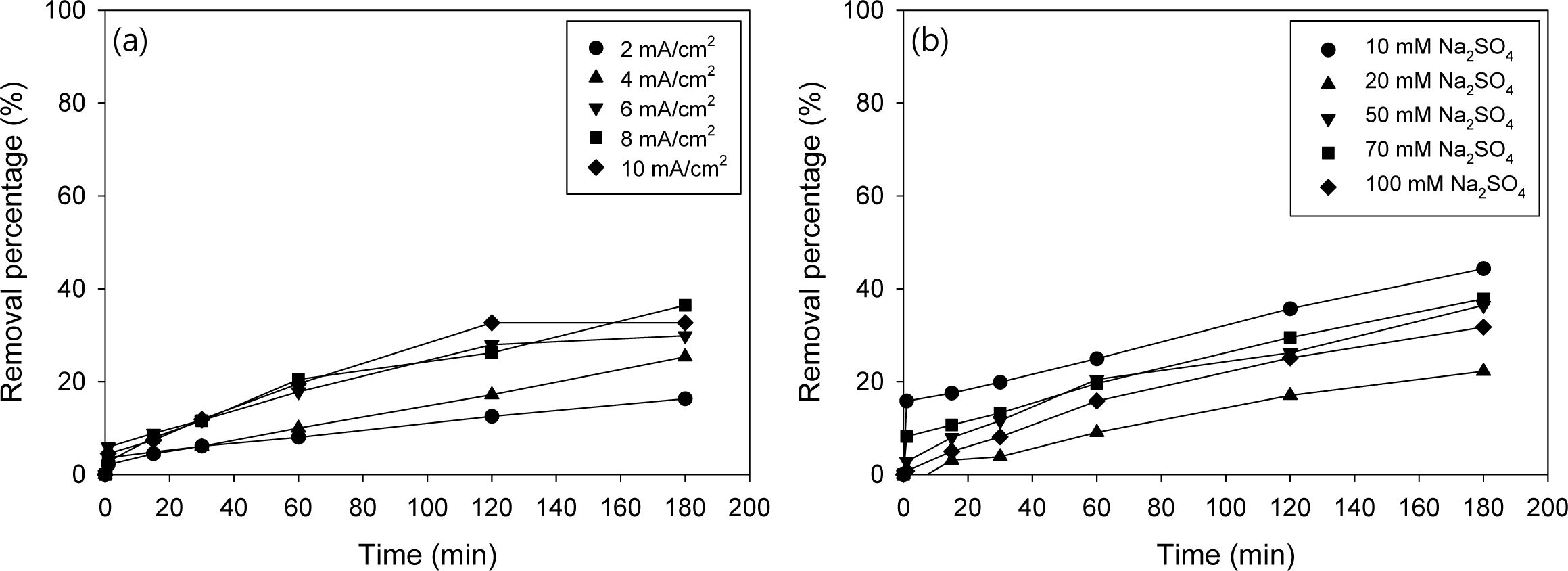
전기 산화(electro-oxidation, EO) 처리시 전류밀도의 영향을 평가하기 위하여 2,4-D 농도 1 mM, 전해질 Na2SO4 용액 농도 50 mM로 고정하고, 전류밀도를 2, 4, 6, 8, 10 mA/cm2으로 변화하여 실험하였다. 실험 결과는 Fig. 2에 나타내었다. 전류밀도가 증가할수록 제거율은 16, 25, 30, 36, 33%로 증가하였으며 6~10 mA/cm2에서는 큰 차이는 없는 것으로 나타났다. 2,4-D 농도 1 mM, 전류밀도는 8 mA/cm2으로 고정하고 전해질 Na2SO4 농도를 10, 20, 50, 70, 100 mM로 변화하여 실험한 결과를 Fig. 1(b)에 나타내었으며, 10 mM 농도일 때 제거효율이 가장 높게 나타났다. 이후 전기화학적 산화 실험에서 최적 전류밀도는 8 mA/cm2. 전해질 농도는 10 mM로 하여 실험하였다.
3.2. 과황산-전기화학적 산화 실험 결과
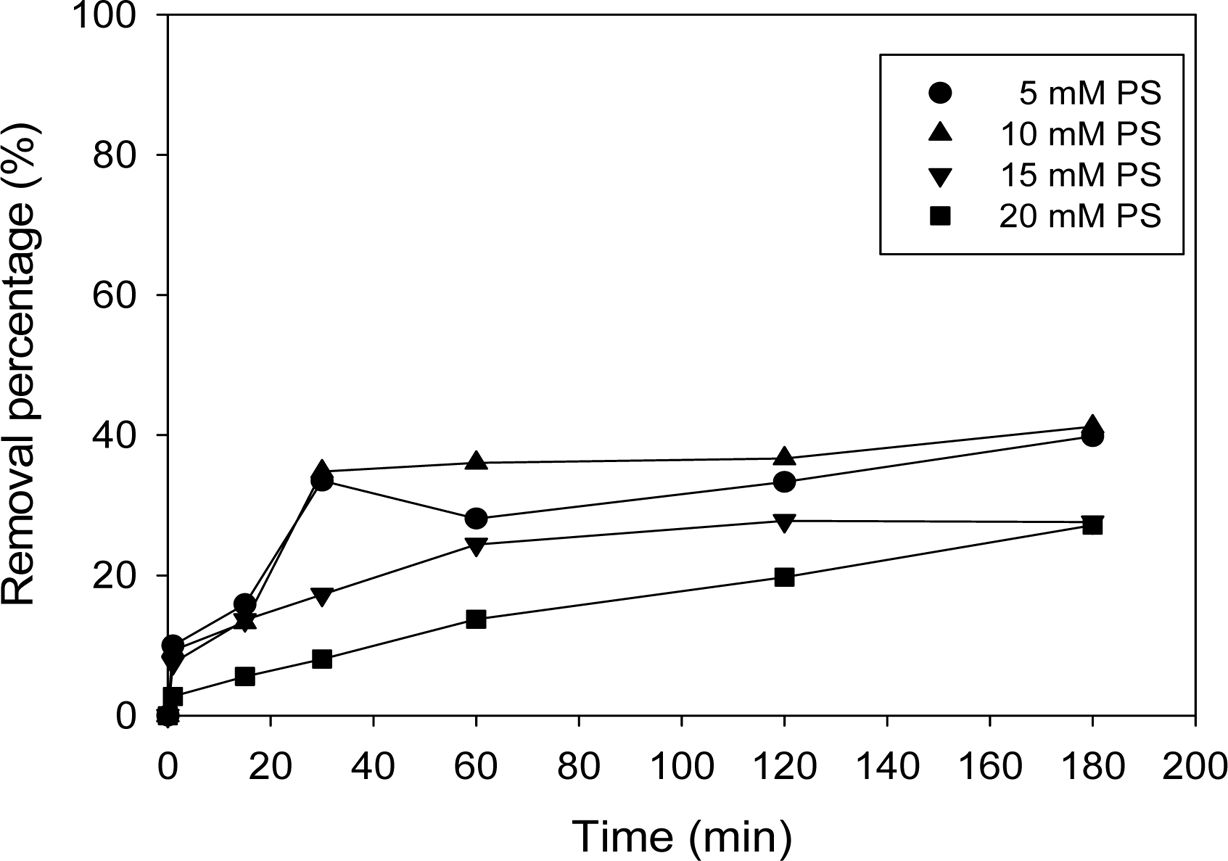
과황산-전기화학적산화(persulfate/electrochemical oxi- dation, PS/ECO) 시스템에 의한 2,4-D의 제거에 있어 과황산 초기 농도의 영향을 Fig. 3에 나타내었다. 2,4-D의 초기농도는 1 mM, 전해질 Na2SO4 농도 10 mM로 고정하고, 과황산 농도를 0, 2, 5, 10, 20 mM로 변화시켜 산화 실험을 수행하였다. 2,4-D 제거율이 PS 농도 0일 때 36%에서 과황산 주입 후 과황산의 농도가 증가함에 따라 46, 51, 33, 35%로 나타났다. 대부분의 연구결과를 보면 과황산 농도가 증가할수록 발생하는 황산 라디칼의 양이 증가하기 때문에 처리효율이 증가하나 과량의 과황산이 주입될 경우 제거율이 감소하는 경우가 있다고 보고되었다(Liang et al., 2007; Malakootian and Ahmadian, 2019). 전기산화에서 과황산을 주입하였을 때, 전자를 통하여 황산 라디칼이 발생하여 산화 효율이 증가됨을 식 (2)로 설명할 수 있으며, 식 (3)-(4)에 나타난 바와 같이 과량의 과황산이 존재할 경우 발생한 황산 라디칼이 소모되어 산화 효율을 저해하는 것으로 판단된다.
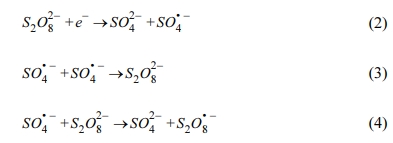
Fig. 3에서 알 수 있듯이 PS/ECO 공정에 의한 2,4-D의 제거효율이 최대 51%로 제한되며, 이를 개선하기 위해 Fe(II) 추가의 영향을 살펴보았다.
3.3. Fe(II)로 활성화한 과황산-전기화학적 산화 실험 결과
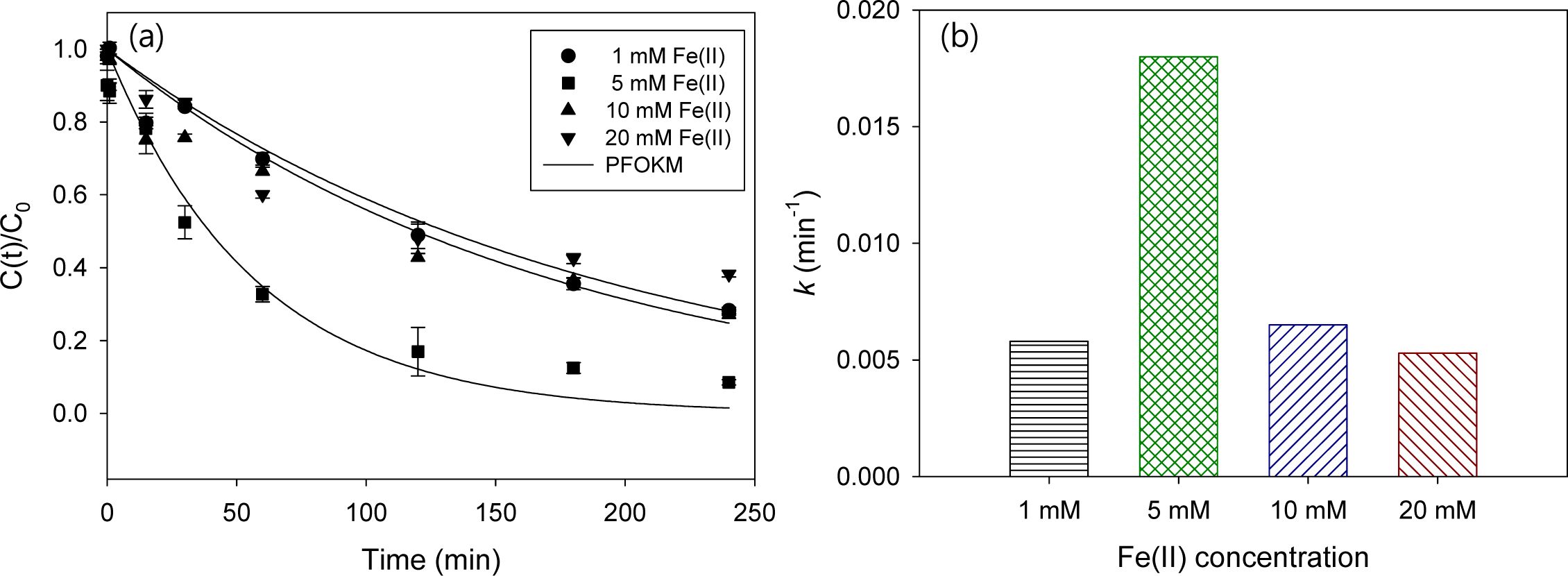
과황산-전기화학적 산화(Fe(II) activated persulfate/electrochemical oxidation, Fe(II)/PS/ECO) 실험에서 Fe(II)를 활성화제로 추가 주입한 Fe(II)/PS/ECO 시스템에 의한 2,4-D 제거 실험결과를 Fig. 4과 Table 2에 나타내었다. 2,4-D의 초기농도는 1 mM, 전해질 Na2SO4 농도 10 mM, 과황산 농도 10 mM로 고정하고, Fe(II) 농도 1, 2.5, 5, 10, 20 mM로 변화시켜 산화 실험을 수행하였다. Fe(II) 농도별 2,4-D 제거효율을 보면, 1 mM일 때 72%, 5 mM일 때 91%, 10 mM일 때 73%, 20 mM일 때 62%로 각각 나타났다. Fe(II) 농도 5 mM까지는 제거효율이 증가하였으나, 이후 Fe(II)의 농도를 더 증가시킬 경우 제거효율이 감소하였으며, 이는 Fe(II)가 과량으로 존재할 경우 황산 라디칼이 Fe(II)와 반응하여 소모되어 유기오염물질 제거를 저해한다는 Liang et al.(2004)의 연구결과로 설명될 수 있다. 유사 1차 속도 모델의 곡선맞춤 결과 속도상수 k를 비교해보면, 5 mM(1.8 × 10-2 min-1) > 10 mM (6.5 × 10-3 min-1) > 1 mM(5.8 × 10-3 min-1) > 20 mM (5.3 × 10-3 min-1) 순으로 나타나 제거효율이 가장 높게 나타난 5 mM에서 반응속도도 가장 빠른 것으로 나타났다.
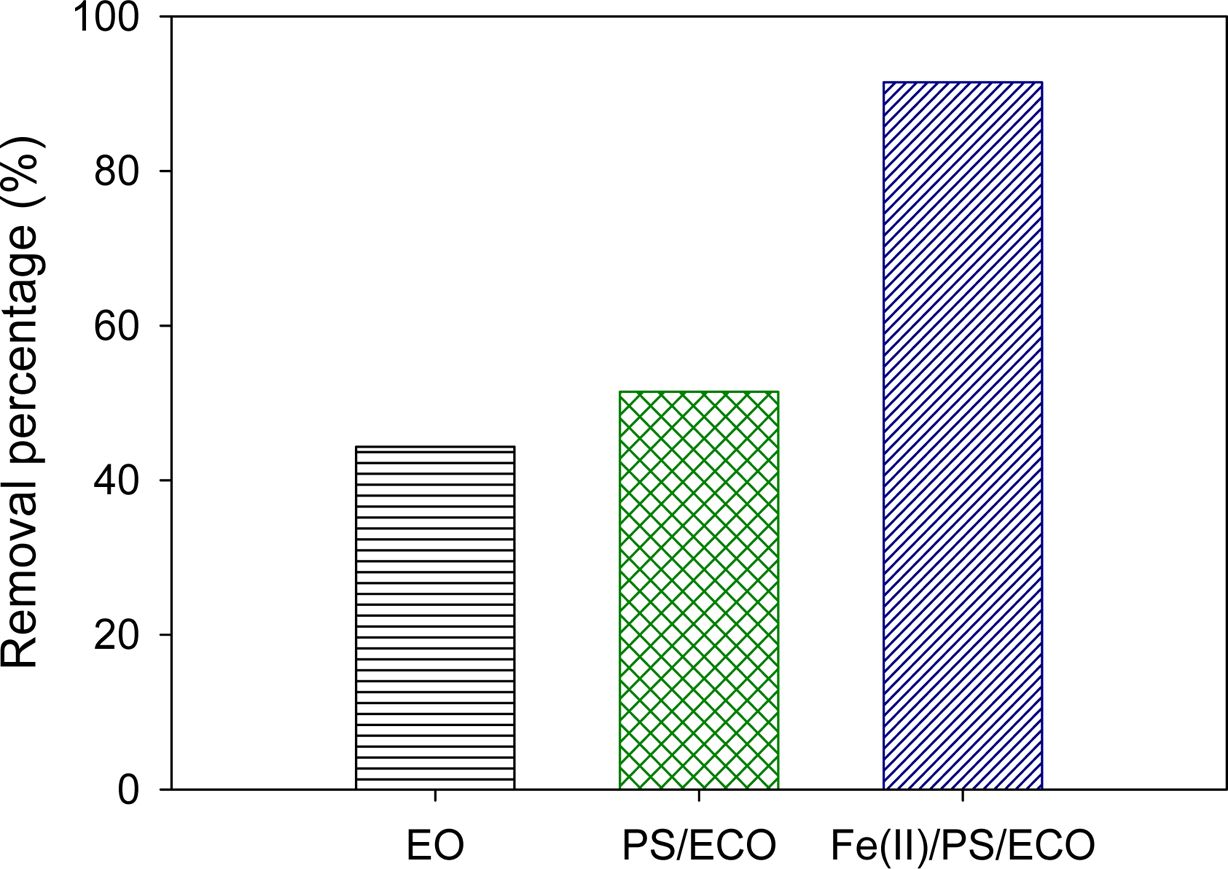
전기 산화 실험(EO, electro-oxidation), 과황산-전기화학적 산화 실험(PS/ECO, persulfate-electrochemical oxida- tion) 및 Fe(II)로 활성화한 과황산-전기화학적 산화 실험(Fe(II)/PS/ECO, Fe(II) activated persulfate-electroche- mical oxidation)의 최적 조건에서의 2,4-D 제거 효율을 비교해보면 Fe(II)/PS/ECO(91%) > PS/ECO(51%) > EO (44%) 순으로 나타나 철 활성화제와 과황산이 모두 주입된 전기 화학적 산화 실험에서 가장 제거효율이 높은 것으로 나타났다(Fig. 5 참조). Fe(II)/PS/ECO 실험에서 산화제인 과황산이 활성화제인 Fe(III)에 의해 활성화되는 동시에 전극 표면에서의 이온에 의해서도 활성화된다. 또한, Fe(III)가 전극 표면에서 나오는 전자로 인하여 Fe(II)로 다시 환원되어 산화 효율 증가 효과를 기대할 수 있다(식 (5))(Long and Zhang, 2015).

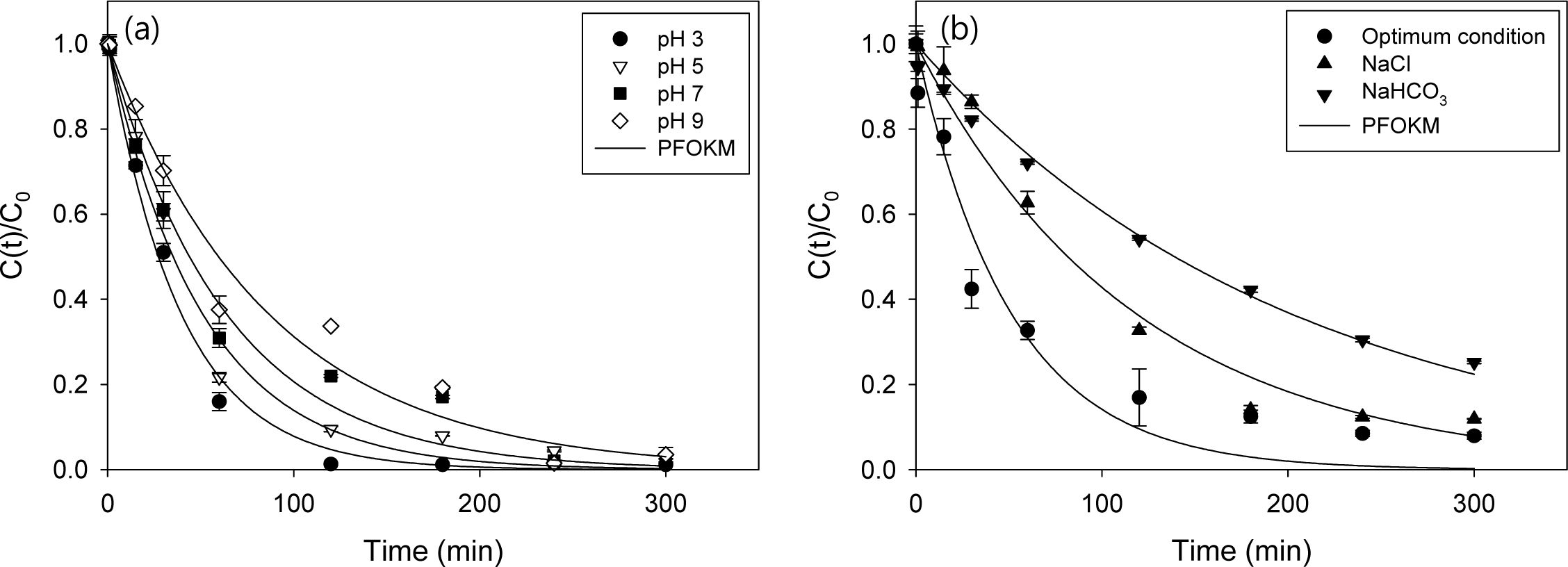
Fe(II)/PS/ECO 실험에서 초기 pH 영향 및 음이온의 영향을 확인하였으며, 실험 결과를 Fig. 6과 Table 3에 나타내었다. 초기 pH에 따른 제거효율은 큰 차이가 거의 없는 것으로 나타났으나 산화속도를 비교해보면, pH 3 (2.5 × 10-2 min-1) > pH 5(2.0 × 10-2 min-1) > pH 7(1.6 × 10-2 min-1) > pH 9(1.2 × 10-2 min-1) 순으로 pH가 낮을수록 빠른 것으로 나타났다(Fig. 6(a) 참조). 지하수 내에 존재하는 주요 음이온으로는 SO42−, Cl−, HCO3− 이온이 검출되므로(Choo et al., 2009; Saha et al., 2019) 이와 같은 음이온이 산화 효율에 미치는 영향을 실험하였고, 그 결과를 Fig. 6(b)에 나타내었다. SO42−의 경우 전해질 용액으로 주입하여 시험하여 음이온 영향에서는 제외하였으며, Cl-와 HCO3-를 각각 NaCl, NaHCO3를 주입하여 실험하였다. 제거효율을 비교해보면, Cl- 이온이 존재할 경우 88%, HCO3- 이온이 존재할 경우 75%로 제거효율이 감소하는 것을 확인하였다. 과황산 산화에서 Cl-와 HCO3- 이온이 과황산 라디칼과 반응하여 오염물질 제거효율이 감소하며(식 (6)-(10) 참조)(Liang et al., 2006; Bennedsen et al., 2012), 유사 1차 속도 모델의 곡선맞춤 결과 최적의 실험 조건(2,4-D = 0.1 mM, Na2SO4 = 10 mM, current density = 8 mA/cm2, PS = 10 mM, Fe(II) = 5 mM)의 속도상수(1.8 × 10-2 min-1)와 비교하면 현저하게 감소한 것(Cl- 이온 : 8.5 × 10-3 min-1, HCO3- 이온 : 0.5 × 10-3 min-1)을 알 수 있다 (Table 3 참조).
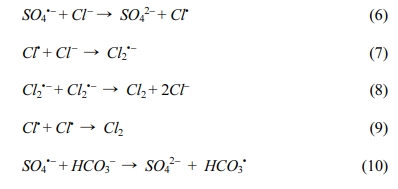
3.4. 주요 반응 라디칼 규명
과황산 산화 반응에서 과황산이 전기 산화 과정에서 발생하는 이온과 활성화제로 주입한 Fe(II)과 반응하여 황산 라디칼(sulfate radical, SO4•−) 뿐만 아니라 수산화 라디칼(hydroxyl radical, •OH)을 생성한다(식 (2), (11)-(13) 참조)(Zhao et al., 2016).
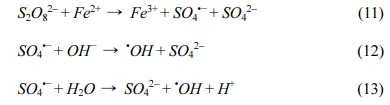
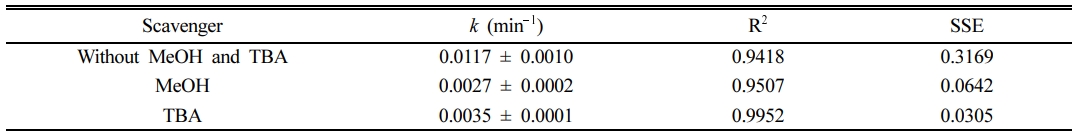
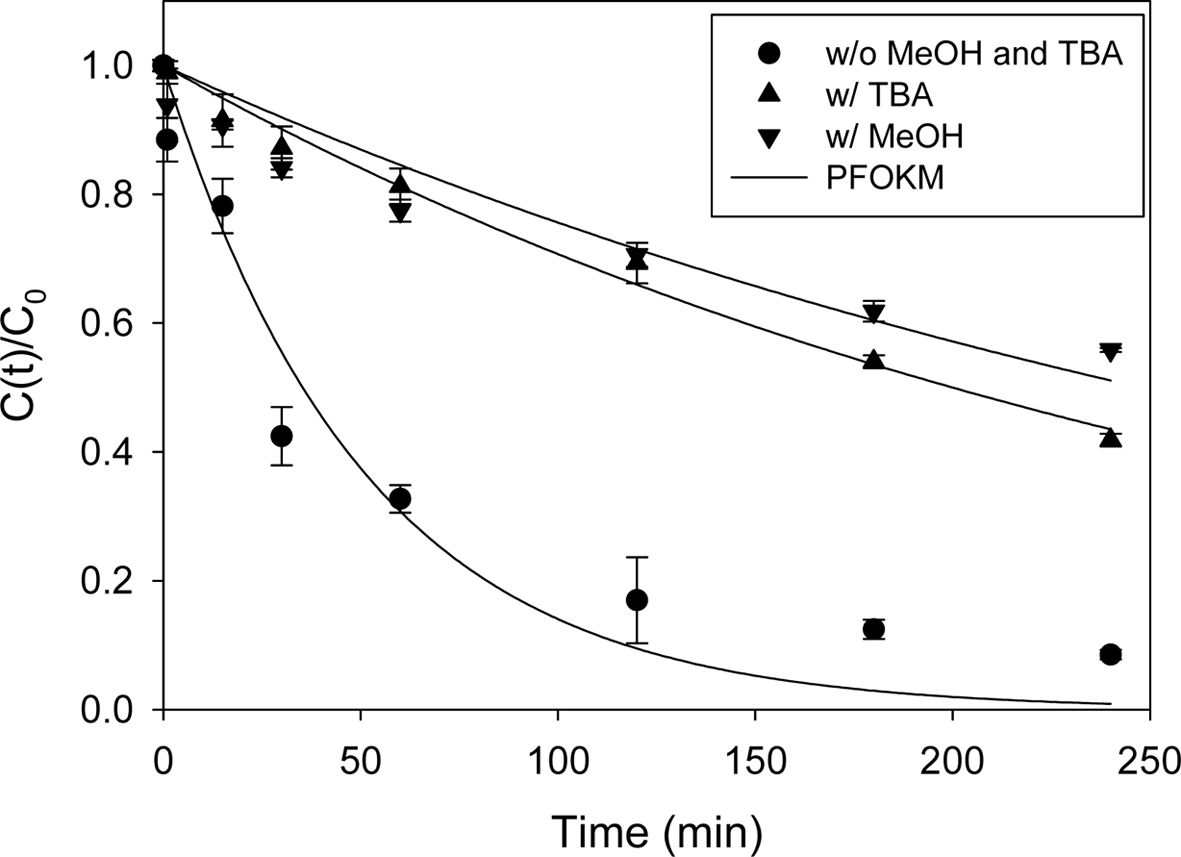
Fe(II)/PS/ECO에 의한 2,4-D 처리에서 주요하게 작용하는 라디칼을 확인하기 위해 메탄올과 TBA를 scavenger로 이용하여 실험을 수행하였다. 메탄올은 수산화 라디칼(1.2 – 2.8 × 109 M-1s-1)과 황산 라디칼(1.6 – 7.7 × 109 M-1 s-1)과의 반응에서 비슷한 반응속도상수를 가지는 반면, TBA는 수산화 라디칼과의 반응속도상수(3.9 – 7.6 × 108 M-1s-1)가 황산 라디칼과의 반응속도상수(4.0 – 9.1 × 105 M-1s-1)보다 훨씬 높게 나타난다(Bu et al., 2016; Cai et al., 2018). 그러므로 메탄올은 황산 라디칼과 수산화 라디칼의 scavenger로 사용하였으며, TBA는 수산화 라디칼의 scavenger로 사용하였다. 앞선 실험 결과를 통하여 도출한 최적 조건, 2,4-D 농도 1 mM, 전해질 Na2SO4 농도 10 mM, 과황산 농도 10 mM, Fe(II) 농도 5 mM 그리고 전류밀도 8 mA/cm2에서 실험을 수행하였다. Scavenger로 사용된 메탄올과 TBA는 각각 1 M로 하여 실험하였고(Cai et al., 2018), 실험결과는 Fig. 7과 Table 4에 나타내었다. 실험 결과 메탄올과 TBA를 주입하였을 때 2,4-D의 제거율이 92%에서 각각 51%, 67%로 감소하였으며, 속도상수 변화 정도(R (%), 식 (14) 참조)는 메탄올을 주입하였을 때 –78%, TBA를 주입하였을 때 –70%로 큰 차이가 없는 것으로 나타났다. 이 결과를 통하여 수산화 라디칼이 이 반응에서 주요한 라디칼임을 확인하였다.
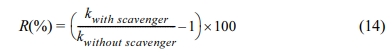
|
Fig. 2 Effect of (a) current density at Na2SO4 = 10mM and (b) electrolyte concentration at current density = 8 mA/cm2 on the 2,4-D removal by electro-oxidation (EO). The initial 2,4-D concentration was 0.1 mM in each test. |
|
Fig. 3 Effect of PS concentration on 2,4-D removal efficiency by PS/ECO process (experiment conditions: 2,4-D = 1 mM, Na2SO4 = 10mM, current density = 8 mA/cm2 , and PS = 5, 10, 15, 20mM). |
|
Fig. 4 Effect of Fe(II) concentration on 2,4-D removal efficiency by Fe(II)/PS/ECO process (experiment conditions: 2,4-D = 0.1 mM, Na2SO4 = 10mM, current density = 8 mA/cm2 , PS = 10mM, and Fe(II) = 1, 5, 10, 20mM). |
|
Fig. 5 Effect of the oxidation process type on 2,4-D removal (EO = electro-oxidation at current density = 8 mA/cm2 , Na2SO4 = 10mM, PS/ECO = persulfate-electrochemical oxidation at current density = 8 mA/cm2 , Na2SO4= 10mM, and PS = 10mM, and Fe(II)/PS/ECO = Fe(II) activated persulfate-electrochemical oxidation at current density = 8 mA/cm2 , Na2SO4 = 10 mM, PS = 10mM, and Fe(II) = 5 mM). |
|
Fig. 6 The 2,4-D removal efficiency by in Fe(II)/PS/ECO process (a) effect of initial pH, (b) effect of anion (experiment conditions: 2,4- D = 1 mM, Na2SO4 = 10mM, current density = 8 mA/cm2 , PS = 10mM, Fe(II) = 5 mM, and pH = 3, 5, 7, 9 or Anion = 20mM NaCl, NaHCO3). |
|
Fig. 7 Effect of radical scavengers on 2,4-D degradation in Fe(II)/PS/ECO (experiment conditions: 2,4-D = 1 mM, Na2SO4 = 10mM, current density = 8 mA/cm2 , PS = 10mM, and Fe(II) = 5 mM). |
본 연구는 수계내 유기염소계 농약, 2,4-D의 처리를 위한 Fe(II)로 활성화한 과황산 전기화학적 산화 효율을 확인하고 산화 반응에 관여하는 주요 라디칼을 규명하였다. 2,4-D의 전기 산화(EO) 처리를 위하여 전류밀도 및 전해질 농도 변화 실험을 수행하였고, 전류밀도가 증가할수록 산화 효율은 증가하였으나 6 mA/cm2 이상에서는 큰 변화가 없었으며, 전해질 농도가 높아질수록 산화 효율이 감소하는 것으로 나타났다. 전기 산화 효율 증가를 위하여 산화제로 과황산을 주입하였으며, 과황산 농도 10 mM까지는 전극에서 발생하는 전자로 인하여 과황산이 활성화되어 황산 라디칼을 형성함으로써 산화 효율이 증가하였다. 과황산 농도를 더욱 증가하였을 경우에는 과황산이 과량으로 주입할 경우 생성된 황산 라디칼이 과황산과 반응하여(self-scavenging) 오히려 과황산과 오염물질이 경쟁함에 따라 산화효율이 감소하였다. 과황산을 주입한 전기화학적 산화(PS/ECO) 실험에서의 최대 제거효율이 51%로 나타나 제거효율 증가를 위하여 Fe(II)를 활성화제로 추가 주입한 Fe(II)/PS/ECO 공정 실험을 수행하였으며, 전극에서 발생하는 전자와 Fe(II)의 산화 과정에서 발생하는 전자로 인하여 과황산 활성이 증대되어 Fe(II) 5 mM 주입시 최대 91%까지 제거효율이 증가하였다. 2,4-D의 제거효울은 Fe(II) 활성화한 과황산-전기화학적 산화(Fe(II)/PS/ECO, 91%) > 과황산-전기화학적 산화(PS/ECO, 51%) > 전기 산화(EO, 36%) 순으로 나타나 Fe(II)와 탄소 전극으로 활성화 한 과황산 산화 반응의 2,4-D 제거능이 가장 좋은 것으로 나타났다. Fe(II)/PS/ECO 공정의 최적 조건에서 초기 pH 영향은 없는 것으로 나타났으며, 음이온 Cl-와 HCO3-가 존재할 경우 음이온들이 황산 라디칼과 반응하여 산화 반응을 저해하는 것으로 나타났다. Scavenger를 이용하여 Fe(II)/PS/ECO 공정의 산화 반응 기작을 규명하였으며, scavenger로는 황산 라디칼과 수산화 라디칼에 모두 작용하는 메탄올과 수산화 라디칼과 더 높게 작용하는 TBA를 사용하였다. 실험결과 2,4-D 처리 Fe(II)/PS/ECO 공정에서는 수산화 라디칼이 주요한 반응 라디칼임을 확인하였다. 최종적으로 Fe(II)/PS/ECO 공정을 이용하여 수계내 2,4-D를 효과적으로 처리할 수 있을 것으로 판단된다.
이 논문은 2018학년도 경북대학교 국립대학육성사업 지원비에 의하여 연구되었음.
- 1. Amasha, M., Baalbakim A., and Ghauch, A., 2018, A comparative study of the common persulfate activation techniques for the complete degradation of an NSAID: The case of ketoprofen, Chem. Eng. J., 350, 395-410.
-

- 2. Bennedsen, L.R., Muff, J., and Sogaard, E.G., 2012, Influence of chloride and carbonates on the reactivity of activated persulfate, Chemosphere, 86(11), 1092-1097.
-

- 3. Brillas, E., Boye, B., Sirés, I., Garrido, J.A., Rodríguez, R.M., Arias, C., Cabot. P.-L., and Comninellis, C., 2004, Electrochemical destruction of chlorophenoxy herbicides by anodicoxidation and electro-Fenton using a boron-doped diamond electrode, Electrochim. Acta, 49(25), 4487-4496.
-

- 4. Brillas, E., Baños, M.Á., Skoumal, M., Cabot, P.L., Garrido, J.A., and Rodríguez, R.M., 2007, Degradation of the herbicide 2,4-DP by anodic oxidation, electro-Fenton and photoelectro-Fenton using platinum and boron-doped diamond anodes, Chemosphere, 68(2), 199-209.
-

- 5. Bu, L., Shi, Z., and Zhou, S., 2016, Modeling of Fe(II)-activated persulfate oxidation using atrazine as a target contaminant, Sep. Purif. Technol., 169, 59-65.
-

- 6. Cai, J., Zhou, M., Yang, W., Pan, Y., Lu, X., and Serrano, K.G., 2018, Degradation and mechanism of 2,4-dichlorophenoxyacetic acid (2,4-D) by thermally activated persulfate oxidation, Chemosphere, 212, 784-793.
-

- 7. Cai, J., Zhou, M., Pan, Y., and Lu, X., 2020, Degradation of 2,4-dichlorophenoxyacetic acid by anodic oxidation and electro-Fenton using BDD anode: Influencing factors and mechanism, Sep. Purif. Technol., 230, 115867.
-

- 8. Carvalho, L., Soares-Filho, A., Lima, M.S., Cruz-Filho, J.F., Dantas, T.C.M., and Luz, G.E.Jr., 2020, 2,4-Dichlorophenoxyacetic acid (2,4-D) photodegradation on WO3-TiO2-SBA-15 nanostructured composite, Environ. Sci. Pollut. Res., 28, 7774-7785, Published online: https://doi.org/10.1007/s11356-020-11085-4.
-

- 9. Chen, H., Zhang, Z., Feng, M., Liu, W., Wang, W., Yang, Q., and Hu, Y., 2017, Degradation of 2,4-dichlorophenoxyacetic acid in water by persulfate activated with FeS (mackinawite), Chem. Eng. J., 313, 498-507.
-

- 10. Choo, C.-O., Lee, J.0K., Lee, C.-J., Park, K.-H., and Jeong, G.-C., 2009, Origin of B, Br and Sr in groundwater from Bukahn-myeonn, Yeongcheon, Gyoengbuk province, with emphasis on hydrochemistry, J. Eng. Geol., 19(2), 235-250, 2009.
- 11. Dargahi, A., Nematollahi, D., Asgari, G., Shokoohi, R., Ansari, A., and Samarghandi, M.R., 2018, Electrodegradation of 2,4-dichlorophenoxyacetic acid herbicide from aqueous solution using three dimensional electrode reactor with G/¥â-PbO2 anode: Taguchi optimization and degradation mechanism determination, RSC Adv., 8, 39256-39268.
-

- 12. Devi, P., Das, U., and Dalai, A.K., 2016, In-situ chemical oxidation: Principle and applications of peroxide and persulfate treatments in wastewater systems, Sci. Total Environ., 571, 643-657.
-

- 13. Fiorenza, R., Mauro, A.D., Cantarella, M., Privitera, V., and Impellizzeri, G., 2019, Selective photodegradation of 2,4-D pesticide from water by molecularly imprinted TiO2, J. Photochem. Photobiol. A, 380, 111872.
-

- 14. IARC (International Agency for Research on Cancer), 2015. World Health Organization, Press Release No 236. IARC Monographs evaluate DDT, Lindane, and 2,4-D, www.iarc.fr/en/media-centre/pr/2015/pdfs/pr236_E.pdf.
- 15. Jaafazadeh, N., Ghanbari, F., and Zahedi, A., 2018, Coupling electroxodiation and oxone for degradation of 2,4-dichlorophenoxyacetic acid (2,4-D) from aqueous solution, J. Water Process Eng., 22, 203-209.
-

- 16. Köster, D., Jochmann, M.A., Lutze, H.V., and Schmidt, T.C., 2019, Monitoring of the total carbon and nitrogen balance during the mineralization of nitrogen containing compounds by heat activated persulfate, Chem. Eng. J., 367, 160-168.
-

- 17. Liang, C., Wang, Z.-S., and Bruell, C.J., 2007, Influence of pH on persulfate oxidation of TCE at ambient temperatures, Chemosphere, 66(1), 106-113.
-

- 18. Liang, C., Bruell, C.J., Marley, M.C., and Sperry, K.L., 2004, Persulfate oxidation for in situ remediation of TCE. I. Activated by ferrous ion with and without a persulfate–thiosulfate redox couple, Chemosphere, 55(9), 1213-1223.
-

- 19. Liang, C., Wang, Z.S., and Mohanty, N., 2006, Influences of carbonate and chloride ions on persulfate oxidation of trichloroethylene at 20oC, Sci. Total Environ., 370(2-3), 271-277.
-

- 20. Liu, H., Wang, C., Zhong, X., Xuanm X., Jiang, C., and Cui, H., 2007, A novel electro-Fenton process for water treatment: reaction-controlled pH adjustment and performance assessment, Environ. Sci. Technol., 41(8), 2937-2942.
-

- 21. Long, A. and Zhang, H., 2015, Selective oxidative degradation of toluene for the recovery of surfactant by an electro/Fe2+/persulfate process, Environ. Sci. Pollut. Res., 22, 11606-11616.
-

- 22. Malakootian, M. and Ahmadian, M., 2019, Removal of ciprofloxacin from aqueous solution by electro-activated persulfate oxidation using aluminum electrodes, Water Sci. Technol., 80(3), 587-596.
-

- 23. Matzek, L.W., Tiption, M.J., Farmer, A.T., Steen, A.D., and Carter, K.E., 2018, Understanding electrochemically activated persulfate and its application to ciprofloxacin abatement, Environ. Sci. Technol., 52(10), 5875-5883.
-

- 24. MOE (Ministry of Environment), 2019, Framework act on water management, Sejong, Korea.
- 25. NIER (National Institute of Environmental Research), 2015, Candidate list analysis of water and water-ecosystem quality criteria, NIER-SP2014-359.
- 26. Saha, S., Reza, A.H.M.S., and Roy, M.K., 2019, Hydrochemical evaluation of groundwater quality of the Tista floodplain, Rangpur, Bangladesh, Appl. Water Sci., 9, 198.
-

- 27. Zhao, L., Ji, Y., Kong, D., Lu, J., Zhou, Q., and Yin, X., 2016, Simultaneous removal of bisphenol A and phosphate in zero-valent iron activated persulfate oxidation process, Chem. Eng. J., 303, 458-466.
-

 This Article
This Article
-
2021; 26(1): 45-53
Published on Feb 28, 2021
- 10.7857/JSGE.2021.26.1.045
- Received on Jan 22, 2021
- Revised on Jan 26, 2021
- Accepted on Feb 19, 2021
 Services
Services
Shared
 Correspondence to
Correspondence to
- Won Sik Shin
-
School of Architectural, Civil, Environmental and Energy Engineering, Kyungpook National University, Daegu 41566, Korea
- E-mail: wshin@knu.ac.kr